脂肪酶催化棕榈酸和大豆磷脂的酸解反应研究
2011-11-06班婷婷陈国安张显久
班婷婷,曹 栋,陈国安,张显久
(1.江南大学食品学院,江苏无锡214122;2.无锡江大百泰科技有限公司,江苏无锡214122)
脂肪酶催化棕榈酸和大豆磷脂的酸解反应研究
班婷婷1,曹 栋1,陈国安2,张显久2
(1.江南大学食品学院,江苏无锡214122;2.无锡江大百泰科技有限公司,江苏无锡214122)
以大豆磷脂为原料,Lipozyme TL IM为酶试剂,正己烷为溶剂,棕榈酸为酰基供体,对大豆磷脂和棕榈酸进行酶法酸解研究。通过实验得出较优的反应条件:液料比(正己烷/磷脂)5∶1,底物摩尔比(棕榈酸/磷脂)5∶1,加酶量(以底物总量为准)20%,反应温度65℃,反应时间60h,水分添加量(以酶量为准)2%,该条件下验证得磷脂中棕榈酸的含量可达到34.45%。
大豆磷脂,棕榈酸,脂肪酶,酸解
1 材料与方法
1.1 材料与仪器
大豆磷脂 北京华清美恒天然产物技术开发有限公司;固定化脂肪酶Liposome TL IM 诺维信公司;棕榈酸 CP级,上海凌峰化学试剂有限公司;丙酮、氯仿、冰醋酸、正己烷、乙醚、三氟化硼、氢氧化钠、甲醇 中国医药(集团)上海化学试剂公司,色谱纯。
GC-14B气相色谱仪 日本岛津;R-205旋转蒸发器 上海申科生物科技有限公司;CS501型超级恒温水浴 上海浦东荣丰科学仪器有限公司;AB104-N电子分析天平 梅特勒-托利多仪器有限公司;78HW-1磁力搅拌器 江苏金坛市荣华仪器制造有限公司;SHB-!循环水式多用真空泵 上海豫康科教仪器设备有限公司。
1.2 实验方法
1.2.1 磷脂酸解的方法 按底物摩尔比(棕榈酸/磷脂,n/n)称取一定量的棕榈酸和磷脂置于100mL的锥形瓶中,加入一定量的溶剂,混匀后按加酶量(酶/底物,m/m)加入脂肪酶,在特定的温度下密封反应一定时间后,加入氯仿-甲醇(2∶1,V/V),振荡浸提,抽滤除去酶后脱溶。冷却后加入适量丙酮反复洗涤产物,直至TLC分析无游离脂肪酸残留为止。55℃真空干燥脱去残留丙酮,样品低温保存,待分析。
1.2.2 薄层层析TLC 以氯仿-甲醇-水=65∶25∶4(V∶V∶V)为展开剂,浸入展开剂的深度距离薄板底边0.5~1.0cm。展开至要求距离,取出薄板晾干,显色剂显色,呈紫红色[11]。
1.2.3 气相色谱分析磷脂的脂肪酸组成 气相色谱分析前,制备脂肪酸甲酯。具体方法如下:称取0.1g左右的试样,置于10mL的试管中,加入2mL的0.5mol/L的NaOH-甲醇溶液,60℃恒温水浴中皂化30min以上,冷却后,加入2mL的BF3-甲醇(1∶3,V/V)溶液,70℃恒温水浴中酯化5min,加入1mL的正己烷和2mL饱和NaCl溶液,萃取分层后取出上层清液加入少量无水硫酸钠。
气相色谱条件:检测器:氢火焰离子化检测器(FID);毛细管柱:CP-Si188,100m×0.25mm;膜厚:0.2"m;温度:检测器(250℃),进样口(250℃);程序升温:起始温度170℃保持3min,以3℃/min的速度升至215℃,保持30min;载气类型:N2,50kPa;进样量:1"L;氢气:60kPa;空气:50kPa;衰减:1;分流比:1∶50。
2 结果与分析
2.1 体系选择
2.1.1 溶剂的选择 考察石油醚、正己烷、氯仿、甲苯、四氯化碳、苯,几种常见的溶剂对磷脂酸解的影响,其他反应条件为液料比(溶剂/磷脂,mL/g)5∶1,底物摩尔比(棕榈酸/磷脂,mol/mol)5∶1,加酶量(酶/总底物,g/g)20%,反应温度60℃,反应时间24h,水分添加量(水/酶,g/g)0%,结果如图1所示。

图1 不同溶剂对反应的影响
水是酶促反应最常用的反应介质,但对于大多数有机化合物来说,在水介质中难溶或不溶。由此产生了使用有机溶剂取代溶剂水,形成固相酶分散在有机溶剂中的体系。
研究表明酶的结构在水相和有机相中并没有显著的变化[13],一定量的水维持酶正确构象是必需的,真正的非水体系中酶是没有催化活性的,实现酶的天然结构和功能只需要非常少量的水,即所谓的微水环境[13-14]。
溶剂会影响酶的活力,主要是由于溶剂影响酶分子微环境的水化层,从而改变酶的催化活性。溶剂分子与蛋白质分子表面残基上的水分子之间产生的静电引力越强,溶剂极性越强,相对的,蛋白分子和水分子的静电引力越弱,使水分子从酶分子表面脱落,进入溶剂体系中而导致酶失活。而非极性的溶剂则有利于维持酶的微水环境。
用logP值来衡量溶剂的疏水性,即溶剂在正辛醇与水之间的分配系数的对数值,logP越大,溶剂疏水性越强[15]。在所使用的六种有机溶剂中,正己烷的logP=3.5,四氯化碳的logP=3.0,有利于维持酶的微水环境,使酶保持最佳的伸展状态,从而表现出较高的活性;其他几种溶剂logP均小于3,破坏了酶分子周围的水层,使酶分子处于蜷缩状态,抑制了酶的活性。
另一方面,溶剂直接或间接地与底物和产物相互作用,进而影响酶的活力。底物必须渗入必需水层,产物移出此水层,才能使反应继续下去,溶剂能改变酶分子必需水层中底物或产物的浓度,直接影响到反应的动力学和热力学平衡。溶剂的疏水性太强,底物不容易从溶剂扩散至酶分子表面,间接影响酶的活力。logP在2.0~3.5之间,就可以达到较高的活性[16]。因此,最终选择正己烷作为反应溶剂。
2.1.2 pH的影响 考察pH对磷脂酸解的影响,其他反应条件为液料比(正己烷/磷脂,mL/g)5∶1,底物摩尔比(棕榈酸/磷脂,mol/mol)5∶1,加酶量(酶/总底物,g/g)20%,反应温度60℃,反应时间24h,水分添加量(水/酶,g/g)0%,结果如图2所示。
酶的催化活性取决于其带电官能团的正确的离子化状态。在水溶液中,这些官能团的离子化状态取决于溶液的pH。有机溶剂不会改变酶蛋白带电基团的离子化状态,因此酶在有机溶剂中的离子状态就与从中提取该酶的水溶液中的离子状态保持一致,有机溶剂酯交换反应的最适pH与水中酶的最适pH大致相同[13-14]。因此可以将酶颗粒悬浮于不同的pH水溶液中,冷冻干燥后加入有机溶剂中,考察不同pH的影响[17]。由图2所示,酶在pH9左右活力最高。以下实验中,酶的pH均调节为9,不再做详细的说明。

图2 pH对反应的影响
酶要表现活性,它活性部分的有关基团都必须选取一定的解离状态,其中任何一种基团的解离状态发生了变化就将使酶从活性状态转入无活性状态,或是从无活性转入活性状态,pH改变了酶的活性中心或是与之有关的基团的解离状态,从而表现出不同的酶活性[14]。
2.2 主要因素对磷脂酸解的影响
2.2.1 液料比对磷脂酸解的影响 考察液料比对磷脂酸解反应的影响,其他反应条件为底物摩尔比(棕榈酸/磷脂,mol/mol)5∶1,加酶量(酶/总底物,g/g)20%,反应温度60℃,反应时间24h,水分添加量(水/酶,g/g)0%,结果如图3所示。

图3 液料比对反应的影响
由图3可知,开始阶段,随着正己烷/磷脂比例的增大,即溶剂添加量的增多,棕榈酸的含量呈增长趋势,直至正己烷/磷脂达到5∶1后,棕榈酸的质量分数趋于稳定,随后又呈略微下降趋势。
液料比直接影响底物的浓度,在底物浓度低时,分子的运动空间较大,同一时间内,底物和酶碰撞的几率较小,只有少部分的酶分子和底物分子结合,溶液中还有较多的未结合的分子。随着浓度的增加,愈来愈多的底物与酶结合,反应速度加快,产物的含量逐渐增大。一旦所有的酶分子与底物相结合后(酶被底物饱和),进一步增加底物浓度不能提高反应速度。当浓度过高时,转化率降低,这是由于底物浓度过高,分子的扩散速度降低,底物和产物相互包埋,一定程度上增大了产物分子离开酶的结合位点的空间位阻,反应速度降低。因此,液料比控制在5∶1较为合适。
2.2.2 底物摩尔比对磷脂酸解的影响 考察底物摩尔比对磷脂酸解反应的影响,其他反应条件为液料比(正己烷/磷脂,mL/g)5∶1,加酶量(酶/总底物,g/g)20%,反应温度60℃,反应时间24h,水分添加量(水/酶,g/g)0%,结果如图4所示。
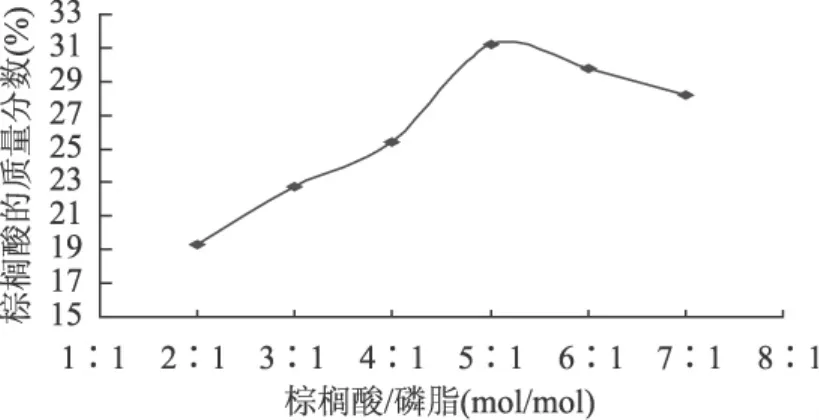
图4 底物摩尔比对反应的影响
由图4可知,随着摩尔比增加,脂肪酸相对含量增大,提高了脂肪酸与磷脂结合的几率,同时从反应平衡角度看,反应向正方向进行。当底物摩尔比为5∶1,转化率达到最高,磷脂充分地与棕榈酸进行酶促反应。随着棕榈酸的继续增加,反应体系粘度过高,致使产物和底物的扩散系数下降;同时也可能使酶周围的水相酸化,导致酶活的降低或是部分失活,使得棕榈酸的质量分数随摩尔比增加反而呈现减少的趋势。所以,底物摩尔比应控制在5∶1。
2.2.3 加酶量对磷脂酸解的影响 考察加酶量对磷脂酸解反应的影响,其他反应条件为液料比(正己烷/磷脂,mL/g)5∶1,底物摩尔比(棕榈酸/磷脂,mol/mol)5∶1,反应温度60℃,反应时间24h,水分添加量(水/酶,g/g)0%,结果如图5所示。

图5 加酶量对反应的影响
增加酶的用量可以缩短达到相同酯化率所需的反应时间,但同时也会增加生产成本。由图5所示,棕榈酸的质量分数随着脂肪酶添加量的增加而增大,直至脂肪酶添加量为20%时,反应趋于平衡。脂肪酶添加量5%~20%时,酶量较少,溶液中存在大量未与酶结合的底物,这一阶段的反应速率主要由酶的浓度决定,反应速率随酶量的增加而加快。当加酶量到达20%时,底物分子都与酶分子结合,继续增加酶的用量,反应速率基本不变,这是由于这一阶段的反应速率主要由底物浓度决定,而实验条件中底物浓度是恒定不变的,因此棕榈酸的含量呈现平稳的趋势。从反应的趋势和成本两个方面考虑,加酶量以20%为宜。
2.2.4 反应温度对磷脂酸解的影响 考察反应温度对磷脂酸解反应的影响,其他反应条件为液料比(正己烷/磷脂,mL/g)5∶1,底物摩尔比(棕榈酸/磷脂,mol/mol)5∶1,加酶量(酶/总底物,g/g)20%,反应时间24h,水分添加量(水/酶,g/g)0%,结果如图6所示。
酶促反应受温度的影响较大,一方面,温度升高,反应速率加快;另一反面,温度过高,使酶蛋白变性而失活。由图6所示,反应在50~65℃范围内,产物中棕榈酸的含量随温度的升高而增加,在这个温度范围内,温度升高,反应速率加快,升至酶的最适温度时,酶具有最高的催化活性。当温度继续升高,高温使一部分酶发生变性,酶的催化活性减弱,反应速率降低,表现为产物中棕榈酸的含量降低。由分析可得出,脂肪酶TLIM催化磷脂酸解的最佳温度为65℃。

图6 反应温度对反应的影响
2.2.5 反应时间对棕榈酸酸解的影响 考察反应时间对磷脂酸解反应的影响,其他反应条件为液料比(正己烷/磷脂,mL/g)5∶1,底物摩尔比(棕榈酸/磷脂,mol/mol)5∶1,加酶量(酶/总底物,g/g)20%,反应温度60℃,水分添加量(水/酶,g/g)0%,结果如图7所示。
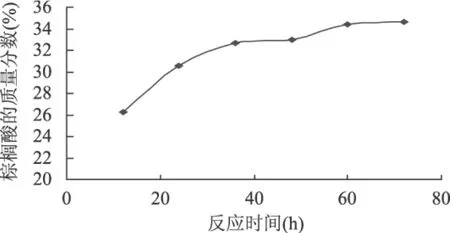
图7 反应时间对反应的影响
由图7可以看出,随着反应时间的延长,更多的游离脂肪酸和磷脂发生反应,产物中棕榈酸的含量随时间的延长而增长;60h后,时间进一步延长,整个反应体系趋向于平衡状态,棕榈酸的含量随反应时间的延长而无法实现进一步的增加。较长时间反应,甚至会造成产物部分水解,降低了终产物的得率。结合生产成本考虑,反应时间选择60h较为合适。
2.2.6 加水量对磷脂酸解的影响 考察加水量对磷脂酸解反应的影响,其他反应条件为液料比(正己烷/磷脂,mL/g)5∶1,底物摩尔比(棕榈酸/磷脂,mol/mol)5∶1,加酶量(酶/总底物,g/g)20%,反应温度60℃,反应时间24h,结果如图8所示。

图8 水分添加量对反应的影响
由图8所示,棕榈酸的含量变化不大,水分添加量为2%时,足以使酶表现出较高的活性。只有在一定量的水存在的条件下,酶分子才能进行催化反应。所以酶在有机介质中进行催化反应时,水是不可缺少的成分之一。有机介质中的水含量多少与酶的空间构象、酶的催化活性、酶的稳定性、酶的催化反应速度等都有密切关系,水还与酶催化作用的底物和反应产物的溶解度有关。
含水量影响酶分子的刚性与柔性,酶在催化反应时,必须有一定的柔性,以使酶能趋向于最佳催化状态所需的构象变化。当含水量降低时,蛋白质带电基团之间静电作用加强,会使酶的刚性增加,酶活降低,其活性部位会变得较难接受体积较大的底物。含水量过高,酶的柔性过大也会引起酶的失活。只有达到最适水量,酶结构的动力学刚性与热力学稳定性之间达到平衡,酶的活力才最大,所以水分添加量为2%较合适。
2.3 磷脂脂肪酸组成的分析
根据脂肪酸的出峰规律:不同碳原子数的脂肪酸甲酯,碳原子数少的先出峰;相同碳原子数的脂肪酸甲酯,双键少的先出峰,在本实验气相色谱检测条件下,脂肪酸的出峰顺序分别为棕榈酸、硬脂酸、油酸、亚油酸、亚麻酸。
在单因素实验的基础上,最终得出较优的反应条件为正己烷/磷脂5∶1,底物摩尔比5∶1,加酶量20%,反应温度65℃,反应时间60h,加水量2%,使得棕榈酸的质量分数由15.29%上升至34.45%。由图9和图10所示,保留时间在11min左右棕榈酸的含量明显增加。
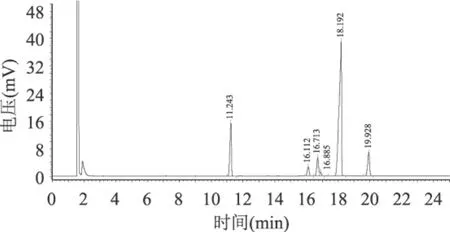
图9 原料磷脂的脂肪酸组成气相色谱图

图10 反应后磷脂的脂肪酸组成气相色谱图
3 结论
通过脂肪酶Liposome TL IM催化可制得富含棕榈酸的结构化磷脂。单因素实验基础上,得出的较优条件为正己烷/磷脂5∶1,底物摩尔比5∶1,加酶量20%,反应温度65℃,反应时间60h,加水量2%,该条件下验证得到产物中棕榈酸的含量为34.45%。
[1]曹栋,裘爱泳,王兴国.磷脂结构、性质、功能及研究现状[J].粮食与油脂,2004(4):3-6.
[2]李立.大豆磷脂的开发与应用[J].饲料工业,1999,20(12):33-36.
[3]邵晓芬,张介玲,王凤玲,等.注射用磷脂的研究[J].中国油脂,2000,25(5):34-35.
[4]黄国文,赵俊廷,谷克仁.大豆粉末磷脂的氢化[J].中国油脂,2003,28(2):51-54.
[5]Anna-Maria Aura,Pirkko Forssell,Annikka Mustranta,et al. Transesterification of soy lecithin by lipase and phospholipase[J].JAOCS,1995,72(11):1375-1379.
[6]宋兰,张敏,于殿宇.氢化大豆卵磷脂的研制与应用[J].农产品加工,2008(8):203-205.
[7]J R C Reddy,T Vijeeta,M S L Karuna,et al.Lipase-catalyzed preparation of palmitic and stearic acid-rich phosphatidylcholine[J].JAOCS,2005,82(10):727-730.
[8]Ingemar Svensson,Patrick Adlercreutz,Bo Mattiasson.Lipase -catalyzed transesterification of phosphatidylcholine at controlled water activity[J].JAOCS,1992,69(10):986-991.
[9]Yuji Tanaka,Tsunetomo Takei,Toshimitsu Aiba,et al. DeveIopment of synthetic Iung surfactants[J].Journal of Lipid Research,1986,27:475-485.
[10]Z Wang,A L Schwan,L L Lairson,et al.Surface activity of a synthetic lung surfactant containing a phospholipase-resistant phosphonolipid analog of dipalmitoyl phosphatidylcholine[J].AJP -Lung Cell Mol Physiol,2003,285:L550-L559.
[11]汤逢.油脂化学[M].南昌:江西科学技术出版社,1985:171-177.
[13]Aleksey Zaks,Alexander M,Klibanov.Enzyme-catalyzed processes in organic solvents[J].Proceedings of the National Academy of Sciences of the United States of America,1985,82:3192-3196.
[14]高修功.非水相酶学的原理与应用[J].国外医学生物医学工程册,1994,17(5):268-273.
[15]Colja Laane,Sjef Boeren,Kees Vos,et al.Rules for optimization of biocatalysis in organic solvents[J].Biotechnology and Bioengineering,1987,30:81-87.
[16]S G Cao,Y Feng,Z B Liu,et al.Lipase Catalysis in Organic Solvents[J].Biochernistry and Biotechnology,1992,32:7-13.
[17]Aleksey Zaks,Alexande M.Klibanov,Enzymatic catalysisin nonaqueous solvents[J].The Journal of Biological Chemistry,1988,263(7):3194-3201.
Lipase-catalyzed acidolysis of palmitic and soybean phospholipids
BAN Ting-ting1,CAO Dong1,CHEN Guo-an2,ZHANG Xian-jiu2
(1.School of Food Science and Technology,Jiangnan University,Wuxi 214122,China;2.Wuxi Southern Yangtze University Biotech Co.,Ltd.,Wuxi 214122,China)
With soybean phospholipids as raw materials,palmitic acid as acyl donor,Lipozyme TL IM as enzyme reagent and hexane as solvent,soybean phospholipids with palmitic acid acidolysis was prepared using lipasecatalyzed.The optimal reaction conditions were obtained through experiment:phospholipids concentration(hexane/ phospholipids)5∶1,substrate ratio(palmitic acid/phospholipids)5∶1,lipase dosage(based on the total substrates)20%,reaction temperature 65℃,reaction time 60h,and water addition(based on lipase)2%.Incorporation of palmitic acid was up to 34.45%.
soybean phospholipids;palmitic acid;lipase;acidolysis
TS201.2
A
1002-0306(2011)02-0236-05
大豆磷脂是大豆油精炼时的副产品,我国大豆制油能力已达2400~2500万t/年,磷脂资源十分丰富。大豆磷脂具有双亲性,是一种天然表面活性剂,有乳化、分散、起泡、脱膜、降低粘度、保持水分等各种功能,因此,研究大豆磷脂的性质,拓宽它的应用领域,具有重要的意义[1-3]。天然磷脂分子中含有较多的不饱和双键,因而很不稳定,在空气中易氧化,使颜色变深且产生难闻气味。因而,目前大豆磷脂产品存在色深、异味、不稳定、易氧化等缺点,这些缺陷在很大程度上限制了它的应用。为了使磷脂在应用科学和技术上充分发挥潜力,需要对其进行修饰[4-5]。目前主要采取的方法是对磷脂进行氢化,使脂肪酸的部分不饱和键变饱和。氢化后的磷脂的稳定性、亲水性、乳化性、渗透性、润湿性、分散性比天然磷脂优异[6]。磷脂的氢化同油脂的氢化原理相同,都属于加成反应,但磷脂的氢化较大豆油氢化困难,同时氢化过程中会产生大量的反式脂肪酸,反式脂肪酸对人体有害,有增加冠心病的危险性。磷脂改性的另一主要方法为酯交换,与化学法相比,酶法酯交换具有较大优势:反应温和,可在普通环境中进行;产物单一,不需要进行复杂的分离步骤;不会改变磷脂的天然构型;利用酶专一性,可以提高或强化磷脂某一功能特性,使其获得某种新的物理特性[7-8]。在磷脂的酯交换反应中,与脂肪酸酯相比,游离脂肪酸为更有效的酰基供体。可利用脂肪酶催化饱和脂肪酸与大豆磷脂进行酸解反应,提高磷脂的饱和度,同时也不会产生反式脂肪酸。二棕榈酰磷脂酰胆碱是肺部活性剂的重要组成部分,它能够稳定空气和肺界面的张力,维持肺部正常的呼吸功能,治愈早产儿的呼吸窘迫症,并且正延伸到用于临床肺损伤综合征患者的治疗上[9-10]。因此,实验选择棕榈酸为酰基供体。
2010-07-08
班婷婷(1986-),女,在读硕士研究生,研究方向:油脂与植物蛋白工程。
江苏省科技型中小企业创新资金(BC2008021)。
