前驱体对四氧化三钴形貌的影响与表征
2011-11-03杨幼平张平民刘人生黄可龙
杨幼平,张平民,刘人生,黄可龙
(中南大学 化学与化工学院,长沙 410083)
前驱体对四氧化三钴形貌的影响与表征
杨幼平,张平民,刘人生,黄可龙
(中南大学 化学与化工学院,长沙 410083)
以Co(CH3COO)2·4H2O为钴源,聚乙二醇(PEG)20 000为表面活性剂,在水−正丁醇溶剂体系中,分别以氢氧化钾、碳酸铵和草酸为沉淀剂,采用沉淀法制备氢氧化钴、碱式碳酸钴和草酸钴前驱体。氢氧化钴前驱体于160 ℃通过水热氧化法,可制得立方体状四氧化三钴(Co3O4);碱式碳酸钴和草酸钴前驱体采用水热−热分解法分别于 450 ℃和400 ℃煅烧3 h可制得球链状和棒状Co3O4。用热重分析、红外光谱、X射线衍射和透射电镜对所制得前驱体和产物Co3O4的形貌和结构进行表征,并对所制备的不同形貌Co3O4进行电化学性能测试。研究结果表明:产物Co3O4的形貌与其前驱体和制备方法有关,当采用氢氧化钴前驱体可制备平均晶粒度约为15 nm的立方体状Co3O4;当采用碱式碳酸钴和草酸钴前驱体可分别制得直径约为40 nm、长约为100 nm的球链状Co3O4和直径约为0.1 μm、长度可达1 μm的棒状Co3O4。通过对不同形貌的Co3O4进行循环充放电测试,可知纳米级Co3O4的电化学性能优于微米级Co3O4的;立方体状Co3O4的电化学性能优于其他形貌Co3O4的电化学性能,其循环10次后的充电比容量为406 mA·h/g。
四氧化三钴;前驱体;形貌;水热法;热分解;电化学性能
过渡金属氧化物四氧化三钴(Co3O4) 主要用作锂离子电池正极材料LiCoO2的生产原料,而锂离子电池负极材料应用最广的主要是石墨,它具有价格低廉,但其理论比容量只有372 mA·h/g[1]。随着锂离子电池需求量的增加,迫切需要开发新的负极材料。由于Co3O4具有较高的比容量(理论值为890 mA·h/g)[2],作为锂离子电池负极材料[2−3]受到广泛关注。
制备 Co3O4的方法有热分解法[4−5]、溶胶−凝胶法[6]、水热法[7−8]、溶剂热法[9−10]和化学气相沉淀法[11]等。工业上常用钴盐热分解制备 Co3O4,该法工艺简单、便于操作,但制得的Co3O4粒度较大且分布宽,其物理化学性能难以达到电子工业的要求。由于水热氧化法是在氧化剂存在的情况下通过水热处理制备纳米氧化物的方法,它具有经水热处理后可直接得到产品,不需要高温煅烧,所制得的材料具有活性好、纯度高、形貌和颗粒大小可控等优点[12];而水热−热分解法是利用水热反应制得前驱体,然后在空气中焙烧,是一种制备不同形貌纳米氧化物的有效方法[13],且水热处理起模板作用,这样能有效地解决采用单独热分解法的缺陷。又由于Co3O4的粒度大小、形貌、单分散性与其电化学性能有关[14],而材料的制备方法对其形貌及电化学性能会产生影响。为此,本文作者采用水热氧化法处理氢氧化钴前驱体制得纳米立方体状Co3O4;采用水热−热分解法处理碱式碳酸钴和草酸钴前驱体,制得球链状和棒状 Co3O4,并通过热重(TG)和导数热重(DTG)分析、红外(IR)光谱、X射线衍射(XRD)和透射电镜(TEM)对所制得的前驱体和 Co3O4产物的结构和形貌进行表征,此外,用不同前驱体所制备的不同形貌Co3O4作为锂离子电池负极材料,考查其电化学性能。
1 实验
1.1 Co3O4样品的制备
1) 以KOH为沉淀剂,采用水热氧化法制备立方体状Co3O4
将15 mmol Co(CH3COO)2·4H2O溶于10 mL去离子水,于室温和磁力搅拌下,加入15 mL 5%(质量分数)的表面活性剂聚乙二醇(PEG)20 000和15 mL有机溶剂正丁醇,缓慢滴加1.0 mol/L KOH溶液,得到蓝色悬浊液,控制悬浊液的pH值为8~9,再滴加一定量的30%H2O2,将此棕黑色悬浊液装进容积为100 mL内衬聚四氟乙烯的不锈钢高压反应釜内,其装填度为75%,密封后于160 ℃下反应10 h,自然冷却至室温。将所得的黑色沉淀离心分离,依次用去离子水和无水乙醇各洗涤3次,于80 ℃干燥6 h,即得到Co3O4产物。按上述制备方法在滴加H2O2后,未经水热处理,直接将沉淀物离心分离后洗涤、干燥,所得产物记为Co(OH)2前驱体。
2) 以(NH4)2CO3和H2C2O4为沉淀剂,采用水热−热分解法分别制备球链状和棒状Co3O4
将10 mmol Co(CH3COO)2·4H2O溶于10 mL去离子水中,加入15 mL 5% PEG20 000和15 mL正丁醇配成溶液A;将10 mmol (NH4)2CO3和H2C2O4·2H2O分别溶于30 mL去离子水中配成溶液B和C。于室温并在磁力搅拌下,分别将溶液B和C缓慢滴入溶液A中,滴加完后,将混合液移入体积为100 mL内衬聚四氟乙烯的不锈钢高压反应釜内,填装度为75%,密封后将其加热至160 ℃保温10 h,自然冷却。分别将其中紫红色和粉红色沉淀离心分离,然后依次用去离子水和无水乙醇各洗涤沉淀3次,于80 ℃时干燥6 h得 Co2(OH)2CO3和 CoC2O4前驱体,将前驱体分别于450 ℃和400 ℃煅烧3 h,得到Co3O4产物。
1.2 样品的表征
采用美国Mettler TGA/SDTA 851e同步热分析仪对前驱体进行热重和导数热重分析,测试时使用空气气氛,升温速率为5 ℃/min,温度分析范围为室温至800 ℃;用美国 Nicolet仪器公司的Avatar 360红外光谱仪测试前驱体和产物的红外光谱;用日本理学的Rigaku D/max 2500 型18 kW转靶X射线衍射仪(Cu Kα射线,λ=0.154 056 nm,管电压为40 kV,管电流为250 mA,步宽为 0.02°,衍射角(2θ)范围为 10°~70°)分析前驱体在25~500 ℃时的物相组成;用日本JEOL的JEM−1230型透射电子显微镜对前驱体和产物的形貌和粒径大小进行分析。
1.3 电池组装与测试
将合成的Co3O4粉末作为负极材料,以乙炔黑为导电剂,聚四氟乙烯(PTFE)乳液为粘结剂,按质量比80:10:10的比例混合均匀后,调成膏状物均匀涂在约1 cm×1 cm的不锈钢集流体上;将涂好的集流体置于真空干燥箱在80 ℃下烘干;用DY−20台式电动压片机(天津市科学仪器高新技术公司)以 20 MPa压片制成负极片。电池组装在充满氩气保护的MBRAUN手套箱中进行,H2O和O2体积分数均小于10−6。以金属锂片作为对电极,电解液为 1 mol/L LiPF6/EC+DMC+EMC(体积比1:1:1),组装成模拟电池。在室温下,用蓝电(LAND)系列CT2001A型号电池测试系统测试样品的充放电性能,采用恒流充放电法,在电压为0.01~3.0 V之间进行充放电测试。
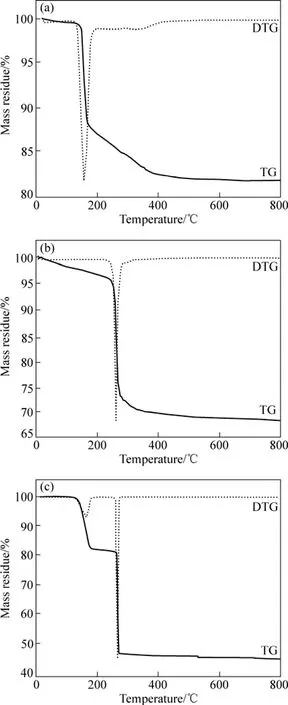
图1 不同前驱体的热重(TG)和导数热重(DTG)曲线Fig.1 TG and DTG curves of different precursors: (a)Co(OH)2; (b) Co2(OH)2CO3; (c) CoC2O4
2 结果与讨论
2.1 前驱体的热重和导数热重曲线
图1所示为 3种前驱体的热重(TG)和导数热重(DTG)曲线。由图1(a)中的TG曲线可见,Co(OH)2前驱体的质量损失分为2个过程:第1个过程是前驱体失去吸附水,其质量损失率约为 2%;第2个过程是Co(OH)2的分解,其质量损失率约为 12%。由图 1(a)中的DTG曲线可见,前驱体在160 ℃左右出现第1个吸热峰,对应于Co(OH)2的去羟基化作用和Co3O4相的转变。而温度为450~800 ℃时其质量基本不变,表明热分解形成的Co3O4在该温度区具有很好的热稳定性。
Co(OH)2前驱体的分解过程可用如下反应式表示:
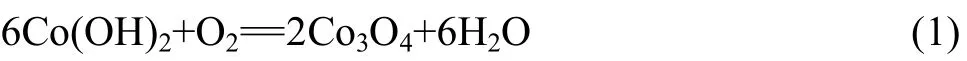
由图 1(b)中的 TG曲线可见,Co2(OH)2CO3前驱体的质量损失分为2个过程:第1个过程是前驱体失去吸附水,其质量损失率约为 4%;第 2个过程是Co2(OH)2CO3的分解,其质量损失率约为 28%。由图1(b)中的DTG曲线可见,前驱体在275 ℃左右出现1个峰,对应于Co2(OH)2CO3的分解,生成Co3O4。而温度为400~800 ℃时其质量基本不变,表明热分解形成的Co3O4在该温度区具有很好的热稳定性。
Co2(OH)2CO3前驱体的分解过程可用如下反应式表示:
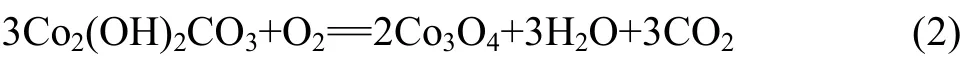
由图1(c)中的TG曲线可见,CoC2O4前驱体的质量损失分为2个过程:第1个过程是CoC2O4前驱体失去 2个结晶水,成为 CoC2O4,其质量损失率约为18%;第2个过程是CoC2O4分解为Co3O4,其质量损失率约为38%。由图1(c)中的DTG曲线可见,前驱体分解过程中存在1个较宽的吸热峰和1个强烈的放热峰,分别位于180 ℃和272 ℃左右。而在350~800 ℃之间,其质量基本没变化,这表明热分解形成的Co3O4在该温度区具有很好的热稳定性。
CoC2O4前驱体的分解过程可用如下反应式表示:

2.2 红外光谱分析
图2(a)所示为Co(OH)2前驱体和前驱体于160 ℃水热处理10 h得到的Co3O4产物的红外光谱图。由前驱体的红外光谱图可见,3 409.88 cm−1宽大吸收峰归属于羟基伸缩振动模式;在1 560.45和1 382.79 cm−1处的吸收峰分别归属于 CH3COO−的反对称和对称伸缩振动模式;在593.85和 517.52 cm−1出现的吸收峰与Co—O振动有关。由Co(OH)2前驱体经水热处理所得 Co3O4的红外光谱图可见,662.73和 570.64 cm−1处出现 Co3O4中 Co—O键的伸缩振动吸收峰,表明Co(OH)2前驱体经水热处理后的产物为Co3O4。
图2(b)所示为 Co2(OH)2CO3前驱体和前驱体于450 ℃煅烧3 h得到的Co3O4产物的红外光谱图。可见,前驱体中的O—H键伸缩振动吸收峰位于3 500.81和3 380.02 cm−1处,CO32−的特征吸收峰位于1 548.20,1 348.26和836.15 cm−1处,没有出现Co3O4中Co—O键的吸收峰,表明水热处理后的前驱物为碱式碳酸钴。Co2(OH)2CO3前驱物于450 ℃煅烧3 h的产物在660.81和562.47 cm−1处出现Co3O4中Co—O键的伸缩振动吸收峰,表明此时产物为Co3O4。
图2(c)所示为CoC2O4前驱体和前驱体于400 ℃煅烧3 h得到的Co3O4产物的红外光谱图。可见,前驱体中结晶水的O—H键伸缩振动吸收峰在3 371.54 cm−1,结晶水的H—O—H弯曲振动峰1 628.14 cm−1,1 360.17和1 316.86 cm−1处是C—O键的伸缩振动吸收峰,C—C键骨架振动在 825.42 cm−1,没有出现Co3O4中Co—O键的吸收峰;CoC2O4前驱体在400 ℃煅烧3 h的产物中在662.20和565.98 cm−1处出现了Co3O4中 Co—O键的强吸收峰,表明此时形成了Co3O4,但在3 448.42 cm−1处还有吸附水中O—H键伸缩振动的弱吸收峰,在1 654.96 cm−1处是吸附水的H—O—H弯曲振动的弱吸收峰。
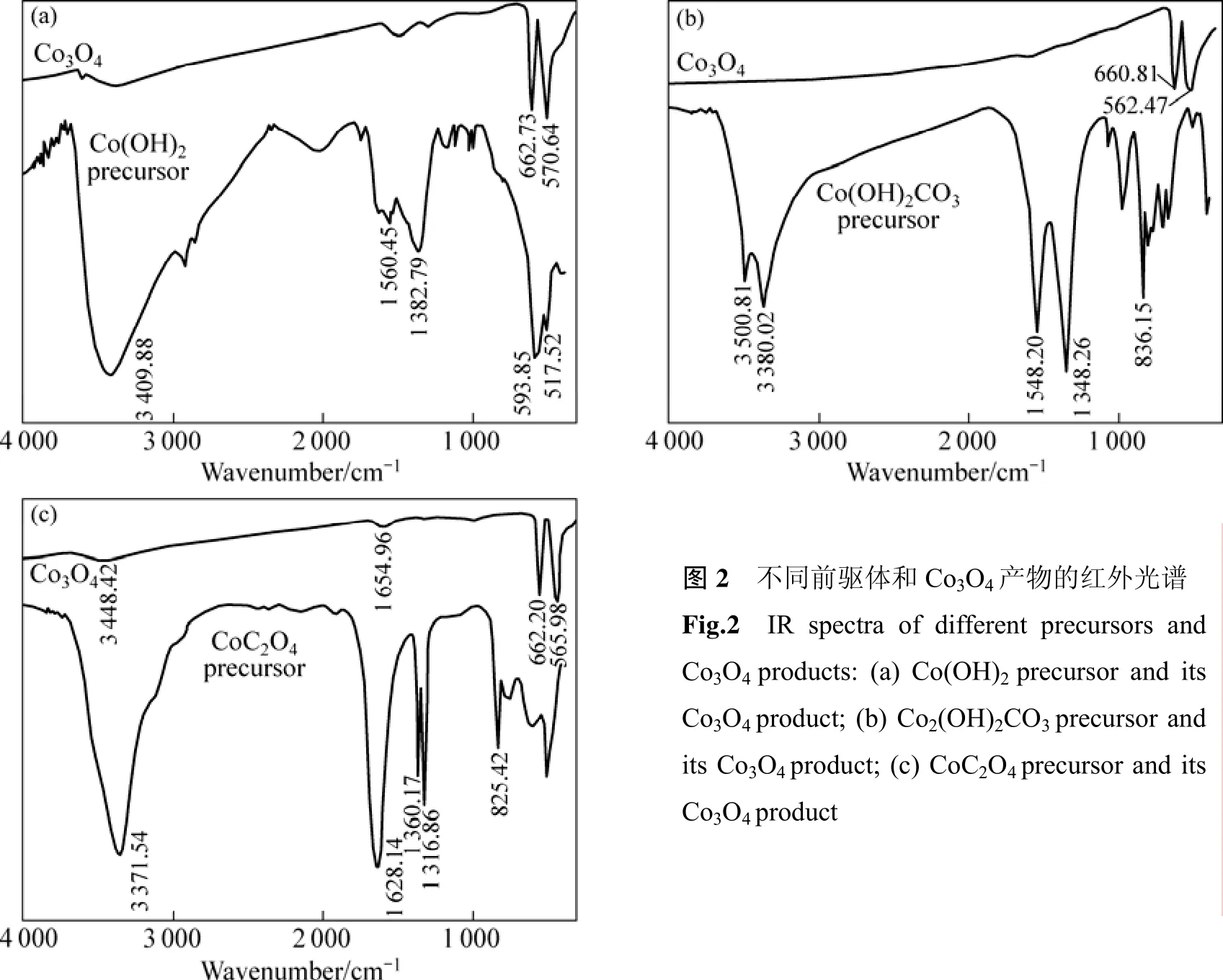
图2 不同前驱体和Co3O4产物的红外光谱Fig.2 IR spectra of different precursors and Co3O4 products: (a) Co(OH)2 precursor and its Co3O4 product; (b) Co2(OH)2CO3 precursor and its Co3O4 product; (c) CoC2O4 precursor and its Co3O4 product
2.3 X射线衍射分析
图3(a)所示为 Co(OH)2前驱体在 25~500 ℃时的XRD谱。由图3(a)可见,前驱体在25~140 ℃时的衍射峰为 β-Co(OH)2的特征峰(JCPDS 74−1057)[10]。这是因为当过量的 KOH溶液滴加到钴盐溶液里,会有蓝色Co(OH)2凝胶形成。当双氧水加入之后,一部分Co2+被氧化成Co3+,为平衡正电荷,溶液中的阴离子嵌入到凝胶内层空间,形成了水滑石结构氢氧化钴[15]。而前驱体在160~500 ℃时的产物,其X射线衍射结果与立方相Co3O4(JCPDS 42−1467)的结果一致,无其他杂质峰出现,且随着温度升高,产物的各衍射峰变尖锐,说明Co3O4晶粒逐渐长大,它的晶体结构更为完整。当温度为140~160 ℃时,β-Co(OH)2转变成Co3O4,此相变温度与热重分析结果基本一致。
图3(b)所示为 Co2(OH)2CO3前驱体在 25~500 ℃时的XRD谱。由图3(b)可见,前驱体在25~250 ℃时的X射线衍射峰与Co2(OH)2CO3的特征峰一致,表明采用(NH4)2CO3作沉淀剂并经水热处理后,所得前驱体为Co2(OH)2CO3。前驱体在270~500 ℃时的产物为立方相Co3O4,不含任何杂质峰。当温度为250~270 ℃时,Co2(OH)2CO3转变成立方相 Co3O4,此相变温度与热重分析结果基本一致,图 3(c)所示为 CoC2O4前驱体在25~500 ℃时的XRD谱。由图3(c)可见,前驱体在25~170 ℃时的X射线衍射峰与CoC2O4·2H2O的特征峰(JCPDS 25−0251)一致,这与文献[16]报道一致;当温度为170~190 ℃时,CoC2O4·2H2O脱去结晶水,因此,在190~250 ℃时的产物为CoC2O4;当温度为250~270 ℃时,CoC2O4转变成立方相Co3O4,此相变温度与热重分析结果基本一致,故在270~500 ℃时的产物为 Co3O4,此时不含任何杂质峰,且随着温度升高,产物的各衍射峰变尖锐。

图3 不同前驱体在25~500 ℃时的XRD射谱Fig.3 XRD patterns of different precursors at 25−500 ℃: (a) Co(OH)2; (b) Co2(OH)2CO3; (c)CoC2O4
2.4 透射电镜分析
图4(a)和(b)所示分别为Co(OH)2前驱体和水热氧化产物 Co3O4的透射电镜(TEM)照片。由图 4(a)和(b)可见,经水热处理后得到Co3O4产物的形貌为立方体状,平均尺寸约为15 nm,纳米立方体颗粒结晶完美且粒径分布窄。
图4(c)和(d)所示分别为Co2(OH)2CO3前驱体和煅烧产物 Co3O4的 TEM 照片。由图4(c)和(d)可见,经水热处理后得到长约为 2 μm,宽约为 1 μm 的片状Co2(OH)2CO3前驱体;前驱体于450 ℃煅烧3 h得到直径约为40 nm,长约为100 nm的球链状Co3O4。
图4(e)和(f)所示分别为 CoC2O4前驱体和煅烧产物Co3O4的TEM照片。由图4(e)和(f)可见,经水热处理后得到板状CoC2O4前驱体,前驱体于400 ℃煅烧3 h得到直径约为0.1 μm,长度可达1 μm的纯物相棒状Co3O4。LI等[14]报道草酸钴前驱体中的C2O42−起模板作用,故在400 ℃煅烧时得到的Co3O4呈棒状。
2.5 Co3O4形貌对其电化学性能的影响
图5所示为3种不同形貌Co3O4样品前10次的循环充放电曲线图。由图 5(a)可见,单分散性纳米立方体状Co3O4有较好的电化学性能。在前4次充放电过程中,其比容量衰减较快,充电比容量由首次的 939 mA·h/g降为 555 mA·h/g,而随后的循环性能趋向稳定,10次循环后,稳定比容量保持406 mA·h/g。这可能是因为:一方面,前4次循环充放电时伴随着SEI界面膜形成,消耗的大量锂源导致不可逆容量损失,随后该钝化膜趋于稳定,从而又有利于提高循环稳定性能;另一方面,当采用单分散性纳米Co3O4作电极材料时,在充放电过程中,随着锂离子脱出和嵌入产生了纳米级 Co,Li2O和Co3O4晶体,体积膨胀小,活性物质不易脱落,锂离子能顺利嵌入和脱出 Co3O4结构内部,从而保持较高的可逆比容量。
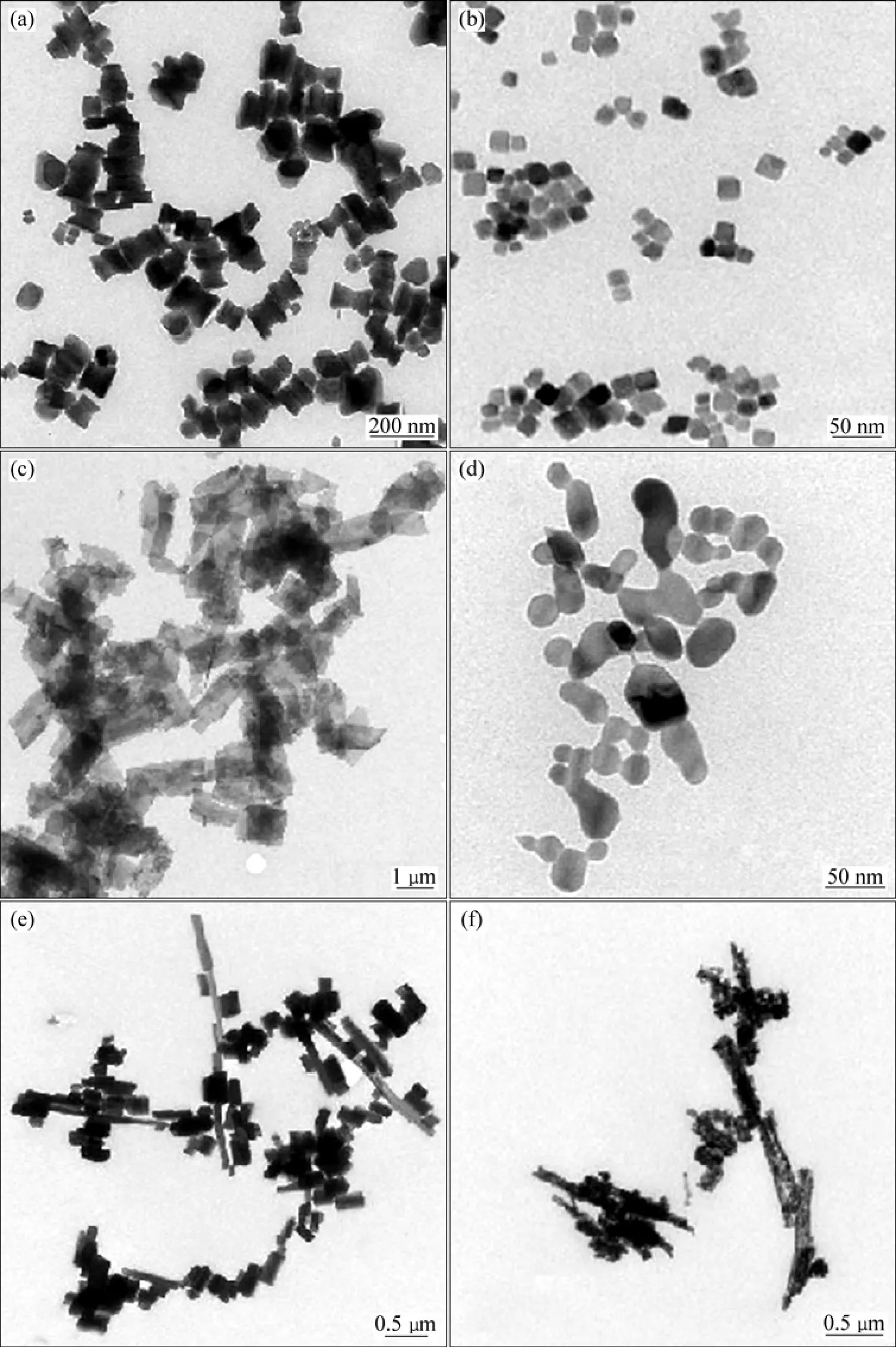
图4 不同形貌的前驱体和Co3O4产物的TEM像Fig.4 TEM images of precursors and Co3O4 with different morphologies: (a) Co(OH)2 precursor; (b) Cubic Co3O4; (c)Co2(OH)2CO3 precursor; (d) Catenuliform-like Co3O4; (e) CoC2O4 precursor; (f) Rod-like Co3O4
由图5可见,采用水热氧化法制备的纳米立方体状Co3O4的电化学性能更好(见图5(a)),说明其物质颗粒的大小对其电化学性能影响很大,物质颗粒越小,其电化学性能越好。其原因可能是由于纳米结构的材料在充放电过程中结构破坏较小,活性物质不易脱落,锂离子顺利嵌入和脱出Co3O4结构内部。
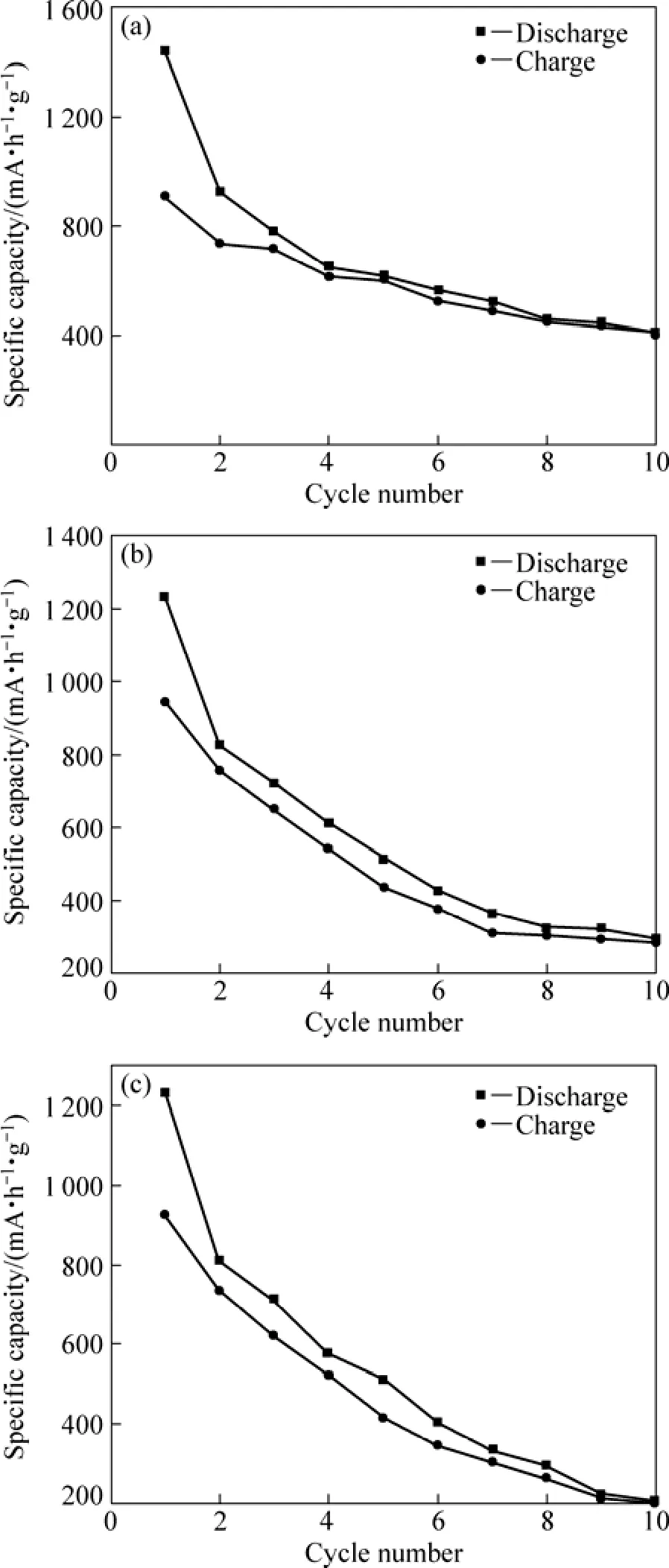
图5 不同形貌Co3O4的循环性能曲线Fig.5 Cycle performance curves of Co3O4 with different morphologies: (a) Cubic Co3O4 prepared from Co(OH)2 precursor; (b) Catenuliform-like Co3O4 prepared from Co2(OH)2CO3 precursor; (c) Rod-like Co3O4 prepared from CoC2O4 precursor
Co3O4的电化学性能与颗粒大小、单分散性和形貌有关。纳米Co3O4电化学性能优于微米级样品的电化学性能,形貌规则且单分散性好的产品性能较好,而纳米立方体状 Co3O4的电化学性能优于其他形貌Co3O4的电化学性能。
3 结论
1) 以 Co(CH3COO)2·4H2O 为钴源,聚乙二醇20 000为表面活性剂,在水−正丁醇溶剂体系中,分别以氢氧化钾、碳酸铵和草酸为沉淀剂,采用沉淀法制备了氢氧化钴、碱式碳酸钴和草酸钴前驱体。氢氧化钴前驱体通过水热氧化法,可制得形貌可控、形状大小均匀的纯物相平均晶粒度约为15 nm的立方体状Co3O4;碱式碳酸钴和草酸钴前驱体采用水热−热分解法,分别于 450 ℃和400 ℃煅烧3 h可制得直径约为40 nm,长约为100 nm的球链状Co3O4和直径约为0.1 μm,长度可达1 μm的棒状Co3O4。因此,产物Co3O4的形貌与其前驱体有关。
2) 以制备的不同形貌的 Co3O4为锂离子电池负极材料进行电化学性能测试,可知物质的电化学性能不仅与物质颗粒大小及粒径分布有关,还与物质形貌有关。纳米级Co3O4的电化学性能优于微米级Co3O4的电化学性能;立方体状Co3O4的电化学性能优于其他形貌Co3O4的电化学性能,其循环10次后的比容量为 406 mA·h/g。
REFERENCES
[1] WANG G X, CHEN Y, KONSTANTINOV K, LINDSAY M,LIU H K, DOU S X. Investigation of cobalt oxides as anode materials for Li-ion batteries[J]. Journal of Power Sources, 2002,109: 142−147.
[2] LIU Han-chang, YEN Shiow-kang. Characterization of electrolytic Co3O4thin films as anodes for lithium-ion batteries[J]. Journal of Power Sources, 2007, 166: 478−484.
[3] LU Yan, WANG Yong, ZOU Yu-qin, JIAO Zheng, ZHAO Bing,HE Ya-qin, WU Ming-hong. Macroporous Co3O4platelets with excellent rate capability as anodes for lithium ion batteries[J].Electrochemistry Communications, 2010, 12(1): 101−105.
[4] ARDIZZONE S, SPINOLO G, TRASATTI S. The point of zero charge of Co3O4prepared by thermal decomposition of basic cobalt carbonate[J]. Electrochimca Acta, 1995, 40(16):2683−2686.
[5] SALAVATI-NIASARI M, MIR N, DAVAR F. Synthesis and characterization of Co3O4nanorods by thermal decomposition of cobalt oxalate[J]. Journal of Physics and Chemistry of Solids,2009, 70: 847−852.
[6] CAO Jin-zhang, ZHAO Yan-chun, YANG Wu, TIAN Jian-niao,GUAN Fei, MA Yong-jun. Sol-gel preparation and characterization of Co3O4nanocrystals[J]. Journal of University of Science and Technology Beijing, 2003, 10(1): 54−57.
[7] TRIPATHY S K, CHRISTY M, NAM-HEE PARK, SUH E K,ANAND S, YU Y T. Hydrothermal synthesis of singlecrystalline nanocubes of Co3O4[J]. Materials Letters, 2008, 62:1006−1009.
[8] LIU Yan, MI Chang-huan, SU Ling-hao, ZHANG Xiao-gang.Hydrothermal synthesis of Co3O4microspheres as anode material for lithium-ion batteries[J]. Electrochimica Acta, 2008,53: 2507−2513.
[9] NETHRAVATHI C, SEN S, RAVISHANKAR N,RAJAMATHI M, PIETZONKA C, HARBRECHT B.Ferrimagnetic nanogranular Co3O4through solvothermal decomposition of colloidally dispersed monolayers of α-cobalt hydroxide[J]. J Phys Chem B, 2005, 109(23): 11468−11472.
[10] SUN Ling-na, LI Hui-feng, REN Ling, HU Chang-wen.Synthesis of Co3O4nanostructures using a solvothermal approach[J]. Solid State Sciences, 2009, 11: 108−112.
[11] BAHLAWANE N, RIVERA E F, KOHSE-HÖINGHAUS K,BRECHLING A, KLEINEBERG U. Characterization and tests of planar Co3O4model catalysts prepared by chemical vapor deposition[J]. Applied Catalysis B: Environmental, 2004, 53:245−255.
[12] JIANG Yang, WU Yue, XIE Bo, QIAN Yi-tai. Moderate temperature synthesis of nanocrystalline Co3O4via gel hydrothermal oxidation[J]. Materials Chemistry and Physics,2002, 74: 234−237.
[13] 张卫民, 孙思修, 俞海云, 宋新宇. 水热−固相热解法制备不同形貌的四氧化三钴纳米微粉[J]. 高等学校化学学报, 2003,24(12): 2151−2154.ZHANG Wei-min, SUN Si-xiu, YU Hai-yun, SONG Xin-yu.Synthesis of Co3O4nanopowder with different morphologies by hydrothermal treatment followed by decomposition[J]. Chemical Journal of Chinese Universities, 2003, 24(12): 2151−2154.
[14] LI W Y, XU L N, CHEN J. Co3O4nanomaterials in lithium-ion batteries and gas sensor[J]. Advanced Functional Materials, 2005,15: 851−857.
[15] XU Z P, ZENG H C. A new approach for design and synthesis of Co and Co hydroxide materials[J]. International Journal of Inorganic Materials, 2000, 2(2/3): 187−196.
[16] THOTA S, KUMAR A, KUMAR J. Optical, electrical and magnetic properties of Co3O4nanocrystallites obtained by thermal decomposition of sol-gel derived oxalates[J]. Materials Science and Engineering B, 2009, 164: 30−37.
Influence of precursor on morphology of Co3O4and characterization
YANG You-ping, ZHANG Ping-min, LIU Ren-sheng, HUANG Ke-long
(School of Chemistry and Chemical Engineering, Central South University, Changsha 410083, China)
The Co(OH)2, Co2(OH)2CO3and CoC2O4precursors were prepared by precipitation method using Co(CH3COO)2·4H2O as cobalt source, polyethylene glycol(PEG) 20 000 as surfactant, water−n-butanol as solvent system,and KOH, (NH4)2CO3and H2C2O4·2H2O as precipitating agent, respectively. The nanocubic Co3O4was synthesized through Co(OH)2precursor at 160 ℃ by hydrothermal oxidation method. The catenuliform-like and rod-like Co3O4powders were obtained when Co2(OH)2CO3and CoC2O4precursors were calcined at 450 ℃ and 400 ℃ for 3 h by hydrothermal−thermal decomposition method, respectively. The morphology and structure of precursor and Co3O4product were characterized by thermogravimetry(TG), infrared(IR) spectrum, X-ray diffractometry(XRD) and transmission electron microscopy(TEM). The electrochemical performance of as-prepared Co3O4with different morphologies was tested. The results show that the morphologies of Co3O4change with the precursors prepared using different precipitating agents and methods. The cubic Co3O4with particle size of 15 nm can be obtained using Co(OH)2as precursor, and catenuliform-like Co3O4with about 40 nm in diameter and 100 nm in length and rod-like Co3O4with about 0.1 μm in diameter and 1 μm in length can be obtained using Co2(OH)2CO3and CoC2O4as precursors, respectively.The electrochemical performance of nano-Co3O4is superior to that of micro-Co3O4. The cubic Co3O4shows the best electrochemical performance in all the as-prepared Co3O4samples, and its specific charge capacity retains 406 mA·h/g after 10 discharge-charge cycles.
Co3O4; precursor; morphology; hydrothermal method; thermal decomposition; electrochemical performance
O614.81+2
A
1004-0609(2011)02-0442-08
国家自然科学基金资助项目(50542004);中南大学“大学生创新创业启航行动”资助项目(CX39)
2010-06-09;
2010-09-22
黄可龙,教授,博士;电话:0731-88879850; E-mail: klhuang@mail.csu.edu.cn
(编辑 龙怀中)
