不同含砷类型金矿的细菌氧化−氰化浸出
2011-11-03崔日成杨洪英
崔日成,杨洪英,富 瑶,陈 森,张 硕
(东北大学 材料与冶金学院,沈阳 110004)
不同含砷类型金矿的细菌氧化−氰化浸出
崔日成,杨洪英,富 瑶,陈 森,张 硕
(东北大学 材料与冶金学院,沈阳 110004)
对含砷类型不同的金精矿和单矿物进行细菌氧化−氰化浸出研究,分析毒砂和雄黄对金精矿细菌氧化−氰化浸出效果的影响。结果表明:在细菌氧化过程中,含砷金精矿中的毒砂易被氧化分解,经过192 h的细菌氧化后,脱砷率可达93.10%;而雄黄无法被细菌氧化分解,且影响细菌活性,延长浸矿的停滞期;在氰化浸出过程中,毒砂非常稳定,不参与任何副反应;而雄黄易与CN−及保护碱发生副反应,且产生的沉淀物质会在金粒表面形成薄膜,从而降低氰化浸出效率。
雄黄;毒砂;细菌氧化;氰化浸出
我国含砷难处理金矿资源丰富、分布广泛,云南、贵州、广西、陕西、甘肃、四川、安徽、湖北和辽宁等省蕴藏着大量此类矿石。由于常规氰化浸出率较低、经济效益不理想,大部分已成为“呆矿”[1−2]。目前,国际上主要采用加压氧化、焙烧氧化和细菌氧化3种方法对此类矿石进行预处理后再氰化提金。其中,细菌氧化法较前两种方法具有投资少、生产成本低廉、流程简单、操作安全及环境污染小等优点,显示出很好的发展前景[3−9]。在氧化过程中,细菌以矿石中的铁和硫为能源物质来满足自身新陈代谢的需求,从而达到脱砷、脱硫和提高矿石品位的目的[10−14]。对于含砷金矿的细菌氧化,目前亟待解决的问题是提高细菌浸矿效率和缩短氧化周期,而对细菌活性影响最大的物质是矿物中的砷。砷是剧毒物质,通常以毒砂及雄黄等形式伴生于金矿中,给矿石的细菌氧化及后续的氰化浸出带来诸多不便。它们不仅削弱了细菌的浸矿活性,而且在氰化浸出过程中还会增加许多副反应,严重影响金的浸出效果[15−16]。为此,本文作者以两种含砷类型不同的金精矿及硫化单矿物为研究对象,分析不同含砷矿物对细菌氧化−氰化浸出过程的影响,从而明确不同含砷矿物的载金状况,为有效地开发利用同类金矿资源提供参考数据。
1 实验
1.1 材料
1.1.1 菌种
试验用HQ0211菌为实验室自行采集分离,并经长期驯化得到的中温嗜酸耐砷菌,该菌是以氧化亚铁硫杆菌为主的混合菌,适应pH范围为1.0~2.0,扫描电镜下细菌呈长杆状、螺旋状和短杆状(见图1)。

图1 矿物表面细菌吸附的SEM像Fig.1 SEM image of bacteria adhering to surface of mineral
1.1.2 矿样
矿样由某企业提供,1号矿样为毒砂型含砷金矿,2号矿样为雄黄型含砷金矿(其中含有少量毒砂),其成分及物相分析结果见表1~2和图2。

表1 1号矿样主元素分析结果Table 1 Main elementary analytical results of ore sample 1

表2 2号矿样主元素分析结果Table 2 Main elementary analytical results of ore sample 2
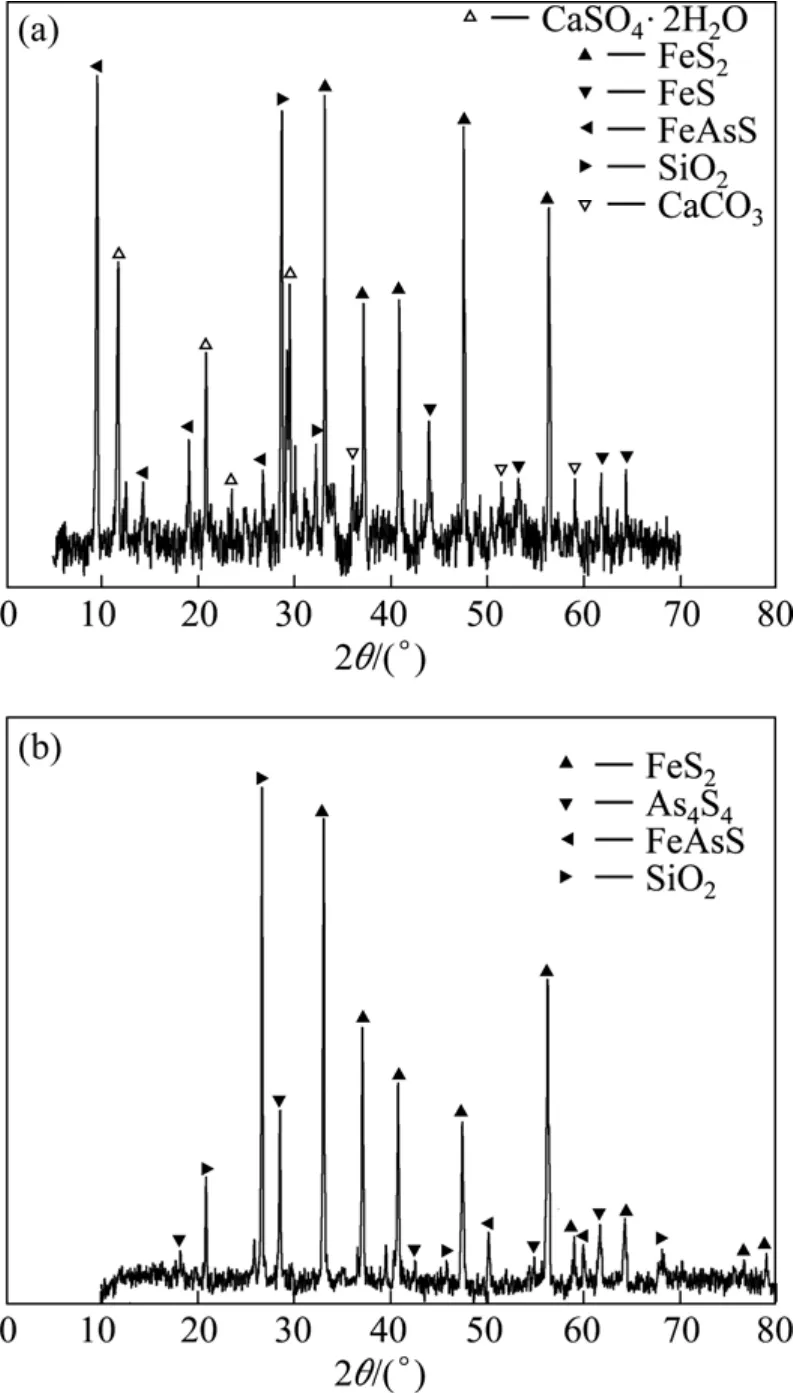
图2 1号和2号矿样的XRD谱Fig.2 XRD patterns of ore samples 1 (a) and 2 (b)
1.2 方法
1.2.1 金精矿的细菌氧化
试验在体积为 3 L的细菌氧化恒温搅拌器中进行。将300 g金精矿加入至已活化好的菌液中,使矿浆浓度为10 %(质量分数),并重新调节pH为1.60。氧化搅拌器的温度为44 ℃,充气量为0.2 m3/h,搅拌速度为1 050 r/min。当溶液的电位达到600 mV以上并保持2 d不变、且Fe2+含量为0 g/L时,即为氧化终点。细菌氧化过程中每24 h测定体系的电位、pH及溶液中的总砷(Ast)和 Fe2+含量。采用卑磷酸盐滴定法测定Ast含量,采用重铬酸钾滴定法测定Fe2+含量[17]。
1.2.2 含砷单矿物的细菌氧化
采用摇瓶浸出方法。向装有200 mL新鲜菌液的两个摇瓶中分别加入3 g FeSO4和10 g无砷金精矿,再分别添加3 g毒砂和雄黄,于44 ℃恒温振荡箱中进行培养。每24 h测定体系的电位、pH及溶液中的总砷(Ast)和Fe2+含量。
1.2.3 细菌氧化渣的氰化浸出
试验在0.5 L的氰化浸出槽中进行,矿浆浓度为30%,浸出条件如表3所列。
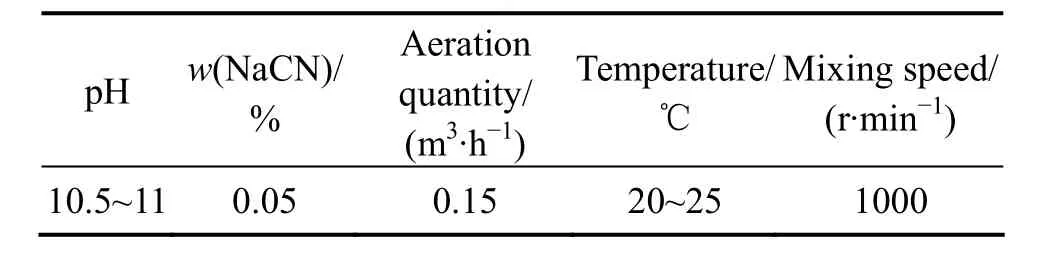
表3 氰化浸出条件Table 3 Cyanidation leaching conditions
1.2.4 含砷单矿物的氰化浸出
试验模拟金矿石的化学组成。分别将15 g毒砂和雄黄与金矿石中常见的几种脉石矿物混合进行氰化浸出,配矿条件见表4。
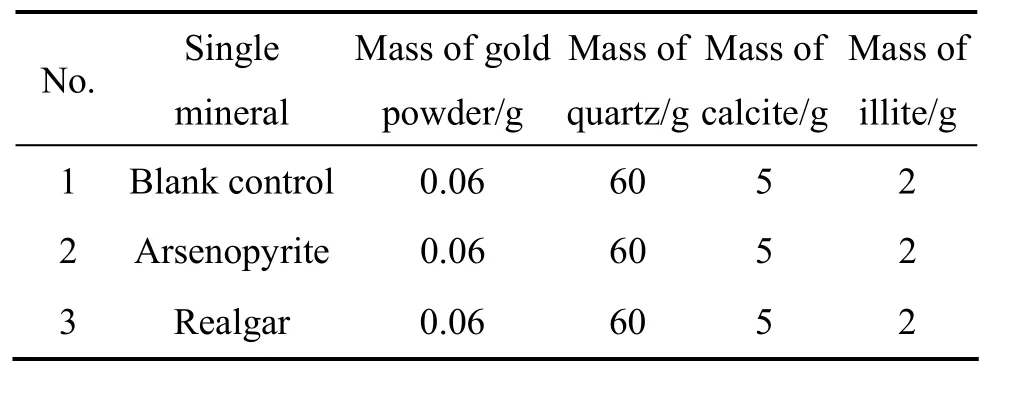
表4 模拟配矿条件Table 4 Mimic ore proportioning conditions
1.2.5 砷消耗CN−的检测
在 500 mL烧杯中加入一定量的 As3+标准液和NaCN标准液,使其浓度分别为1.5 g/L和0.05 %,然后于磁力搅拌器上进行搅拌。10 h后,测定体系中As3+和CN−的浓度,并计算As3+和CN−的消耗量。
2 结果与讨论
2.1 常规氰化浸出
氰化浸出前,将以上两种含砷金矿进行6 h的碱处理,以稳定体系和去除一些干扰离子的影响。氰化条件如1.2.3节所述,经过48 h的氰化浸出,1号矿样的浸出率仅为25.4 %,2号矿样的浸出率为32.1 %,浸出率均很低。经换算,1号和2号矿样的NaCN消耗量分别为7.5和9.2 kg/t。金回收率的高低一般与矿石的矿物组成和金粒的赋存状态有关,在1 500倍光学显微镜下进行观察,两种样品中均无法观察到金粒。由于金粒很细,故将两种样品梯度细磨后继续进行氰化浸出,使金粒单体解离或从伴生矿物中部分暴露。结果表明:随着矿石细度的增加,金的浸出率略有增加,但仍无法获得较高的回收率(见图3)。当粒度小于38 μm的矿石比例达到90 %以上时,1号和2号矿样的浸出率分别仅为41.9 %和50.9 %(见图3)。由此判断,两种矿均属于超细浸染包裹型金矿,微粒金通过细磨很难从包裹物中分离或暴露出来,必须通过适当的预处理才能使金粒与浸金试剂有效接触。
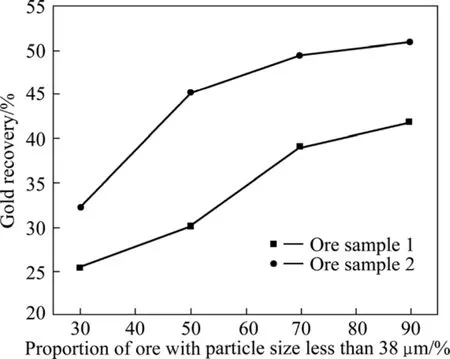
图3 金回收率与矿石细度关系Fig.3 Relationship between gold recovery and ore fineness
2.2 细菌氧化预处理-氰化浸出
2.2.1 不同含砷类型金精矿的细菌氧化
金与砷特殊的地球化学性质决定了金矿物中常伴生含砷矿物。在此类矿石中,金以微细粒状产出,并与这些含砷硫化矿物紧密共生,严重影响金的氰化浸出[18−20]。在细菌氧化过程中,矿石中的硫化矿物会不断分解并游离到溶液中,因此,可通过监测体系中的Ast和 Fe2+浓度以及氧化还原电位来间接反映矿物的氧化分解程度。图4所示为两种矿样的电位随时间的变化关系曲线。由图4可知:1号矿样较适应细菌氧化体系,细菌很快进入对数期,48 h后电位上升至518 mV,而此时2号矿样的电位仅为429 mV,细菌仍处在停滞期。这表明,1号矿样较2号矿样更加适合采用HQ0211菌进行氧化浸出。从两种矿样的脱砷率变化也可以看出,砷存在形式的差异导致两种矿样的脱砷率变化截然不同。经过192 h的细菌氧化后,1号矿样的脱砷率达到93.1 %,几乎所有砷都被分解游离到溶液中,而2号矿样的脱砷率只有41.02 %(见图5)。为了进一步分析雄黄和毒砂在细菌氧化中的影响,在Fe2+及无砷金精矿为能源基质的条件下,分别加入毒砂和雄黄进行对比分析。结果表明:雄黄不但没有被细菌氧化,而且影响了细菌活性,使Fe2+与金精矿的氧化速度减慢;相反地,毒砂很快被细菌间接氧化,而且金精矿与毒砂的氧化都较完全。由此可知,雄黄与其他硫化矿不同,它无法作为细菌生长的能源物质被氧化分解,并且对细菌活性具有抑制作用,导致细菌的浸矿停滞期延长。

图4 两种矿样的电位与时间的关系Fig.4 Relationship between potential and time for two ore samples
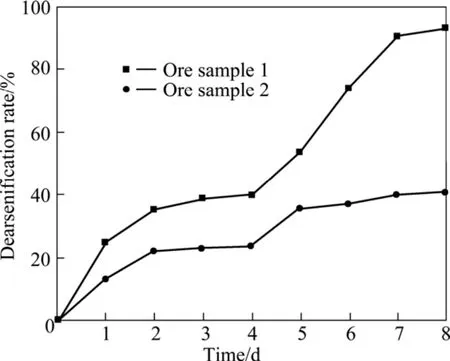
图5 两种矿样脱砷率与时间的关系Fig.5 Relationship between dearsenification rate and time for two ore samples
2.2.2 细菌氧化渣的氰化浸出
细菌氧化结束后,将矿浆固液分离,用稀硫酸及清水分别洗涤3次以去除覆盖在矿粒表面的铁矾类沉淀物质。氰化条件如1.2.3节所述,当氰化浸出时间为24 h时,1号和2号矿样中的金回收率分别为86.2 %和69.8 %;当浸出时间延长至48 h时,1号和2号矿样的金回收率分别达到95.7 %和94.9 %,与细菌氧化前相比分别提高了53.8 %和44.0 %(见图6)。由此可知,两种矿均属于微细浸染包裹型金矿,只有进行氧化预处理才能获得理想的浸出效果。需要指出的是,2号矿样中的雄黄并没有被氧化脱除,但经过48 h的氰化浸出,提金率仍可达到94.9 %。这表明,当砷以雄黄形式存在时,金不被其包裹,包裹物为其他硫化矿物。但与1号矿样相比,2号矿样的溶金速度较慢,且NaCN消耗量增加了2.4 kg/t。分析其原因,雄黄在氰化浸出过程中发生了分解反应,并在金粒表面形成沉淀薄膜,使浸金试剂不能与金粒完全接触,导致金的溶解速率下降。试验结束后经检测,1号矿样的NaCN消耗量为4.8 kg/t,2号矿样的NaCN消耗量为7.2 kg/t。
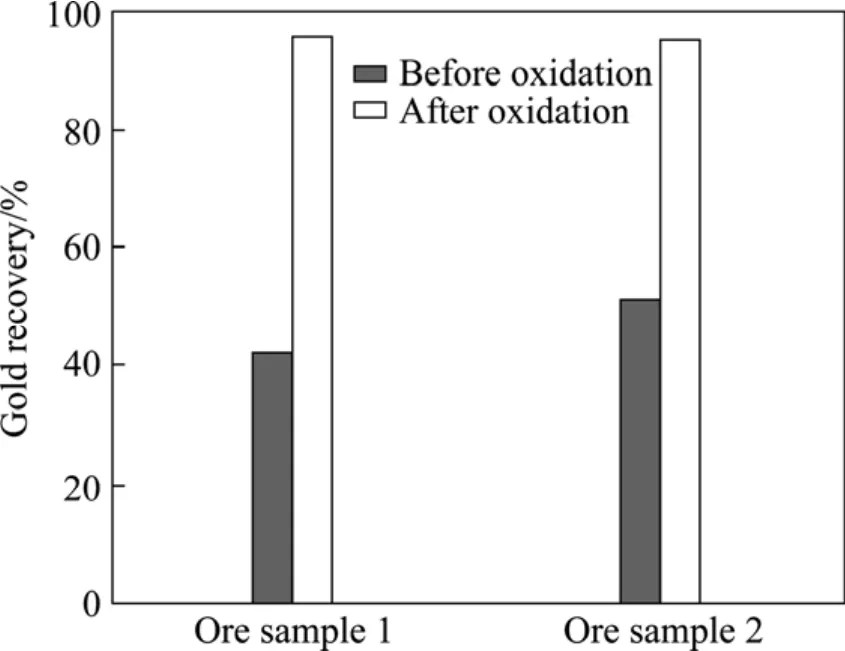
图6 细菌氧化前后氰化浸出率的对比Fig.6 Comparison of cyanidation leaching rate of two ore samples before and after bacterial oxidation
2.3 毒砂和雄黄对氰化溶金过程的影响
由以上试验可知,金精矿中的毒砂与雄黄对氰化浸出具有一定影响,因此,采用人工配制矿石的方式(见1.2.4节)对毒砂和雄黄的影响进行比较分析。人工模拟配制的矿石不存在金的解离与暴露等问题,试验结果只与溶液−固体界面、固体内部和溶液内部的化学反应有关。经过5 h的氰化浸出后,空白对照的金浸出率达到100 %,而加入1.5 %(质量分数)毒砂与雄黄试样体系的金浸出率分别为95.67 %和58.05 %。由此可见,雄黄的干扰作用较为明显。当氰化浸出时间延长至10 h时,含毒砂矿浆的金溶解率达到100 %,而含雄黄矿浆的金溶解率仅为79.17%;随着氰化时间延长至 15 h,含雄黄矿浆的金浸出率也上升至100 %(见图7)。由此可知,金矿中雄黄对金的氰化溶解具有一定影响,而毒砂对氰化浸出的影响较小。经检测,含雄黄矿浆中的液砷浓度为 0.56 g/L,而含毒砂矿浆中的液砷浓度在检测限以下。这表明,雄黄在氰化浸出过程中发生了分解反应,部分砷溶解至溶液中。雄黄的分解反应也使NaCN的消耗量明显上升。为了进一步分析雄黄的高耗CN−原因,将配制的As3+标准液与CN−标准液混合,进行10 h的搅拌反应(见1.2.5节)。经测定,溶液中的 As3+与 CN−的浓度分别为1.49 g/L和0.052 %,与初始浓度基本一致。由此推出,CN−没有与砷形成络合物而消耗,因此,雄黄分解反应过程中 SCN−的形成才是氰化物消耗的主要原因。后期的试验结果表明,增加砷浓度同样不会消耗体系中的CN−。
由此可知,雄黄对氰化浸出产生干扰作用的原因是:雄黄的分解产物能很好地溶于碱介质,形成亚砷酸盐及硫代亚砷酸盐等物质;当砷的溶解和氧化达到一定程度时,就会在金粒表面形成一层钝化膜,阻碍
CN−和氧与金粒接触,导致溶金速率明显减缓。浸金速率也随着雄黄的分解和薄膜的形成逐渐下降,但形成的薄膜不够致密,并不能完全隔绝金粒与外界环境的接触,延长氰化时间仍然可以得到较好的氰化效果。
毒砂在氰化浸出过程中则非常稳定,砷很难溶于溶液,浸出过程中也不会增加CN−与碱的消耗,因此,在氰化浸出前对载金毒砂的氧化预处理极为重要。
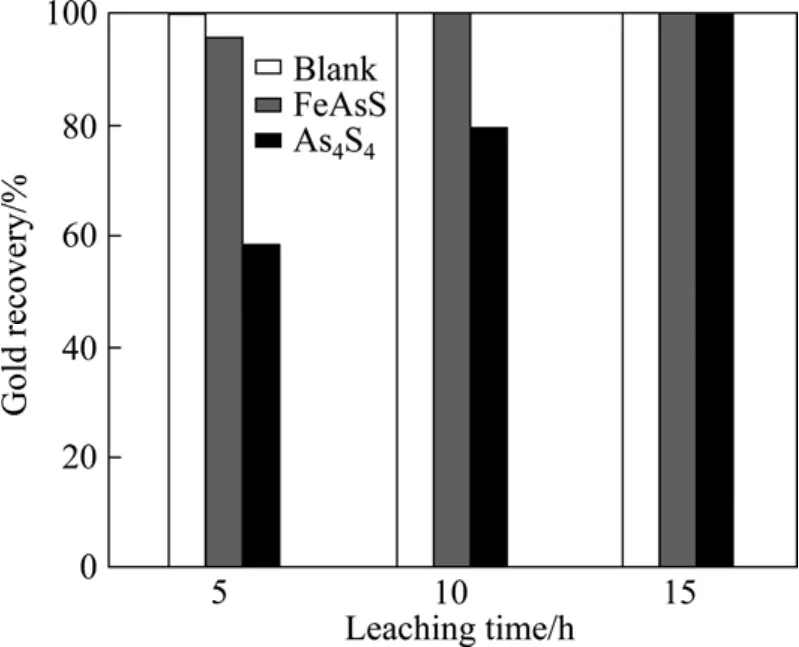
图7 氰化浸出率与浸出时间的关系Fig.7 Relationship between cyanidation leaching rate and leaching time
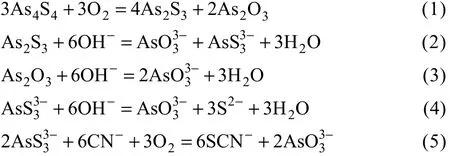
3 结论
1) 当含砷金矿中的砷以不同形式存在时,其载金状况也不同,即毒砂是载金矿物,雄黄不是载金矿物。
2) 当砷以雄黄形式存在时,金矿中的含砷矿物不仅无法被HQ0211菌氧化分解,而且影响HQ0211菌活性,延长细菌浸矿停滞期。
3) 氰化浸出过程中雄黄易被氧化分解,其分解产物不仅易与CN−和碱介质反应,而且会在金粒表面形成薄膜、减缓浸金速率,因此,在浮选操作时应尽量抑制雄黄。
4) 当砷以毒砂形式存在时,金矿中的含砷矿物易被HQ0211菌氧化分解,脱砷率可达93.01 %;而在氰化过程中含砷矿物无法被氧化分解,因此,必须强化细菌氧化过程,使载金毒砂中的金粒充分解离或暴露。
REFERENCES
[1] 孙兆学. 中国金矿资源现状及可持续发展对策[J]. 黄金, 2009,30(1): 12−13.SUN Zhao-xue. Status of gold mineral resources and its sustainable development strategies in China[J]. Gold, 2009,30(1): 12−13.
[2] 王科强, 李汉光, 王春宏. 我国黄金矿产资源特点, 勘查进展与可持续发展建议[J]. 资源与产业, 2006, 8(4): 17−21.WANG Ke-qiang, LI Han-guang, WANG Chun-hong. The characteristics, surveying progress and sustainable development suggestions of gold resources in China[J]. Resources and Industries, 2006, 8(4): 17−21.
[3] BRIERLEY J A, BRIERLEY C L. Present and future commercial applications of biohydrometallurgy[J].Hydrometallurgy, 2001, 59(2/3): 233−239.
[4] 朱长亮, 杨洪英, 王大文, 于海恩, 汤兴光, 段新红, 张东方,周宏波. 含砷含碳双重难处理金矿石预处理方法研究现状[J].中国矿业, 2009, 18(4): 66−69.ZHU Chang-liang, YANG Hong-ying, WANG Da-wen, YU Hai-en, TANG Xing-guang, DUAN Xin-hong, ZHANG Dong-fang, ZHOU Hong-bo. Current situations of pretreatment method research of the refractory gold ores with As and carbon[J]. China Mining Magazine, 2009, 18(4): 66−69.
[5] 陈 聪, 姚 香. 难处理金矿石预处理方法简述[J]. 黄金科学技术, 2004, 12(4): 27−30.CHEN Cong, YAO Xiang. Nutshell of pretreatment method of refractory gold ores[J]. Gold Science and Technology, 2004,12(4): 27−30.
[6] KMI M S, KMI H K, BYUN S W. PET fabric polypyrrole composite with high electrical conductivity for EMI shielding[J].Synthetic Metal, 2002, 126: 232−238.
[7] TIPRE D R, DAVE S R. Bioleaching process for Cu-Pb-Zn bulk concentrate at high pulp density[J]. Hydrometallurgy, 2004, 75:37−43.
[8] WATLING H R. The bioleaching of sulphide minerals with emphasis on copper sulphides: A review[J]. Hydrometallurgy,2006, 84(1/2): 81−108.
[9] 杨洪英, 巩恩普, 訾建威, 杨 立. 嗜热菌对高砷金精矿氧化−氰化提金试验研究[J]. 东北大学学报, 2006, 27(4): 426−429.YANG Hong-ying, GONG En-pu, ZI Jian-wei, YANG Li.Experimental investigation on gold recovery from high-As concentration through bio-oxidation/cyanidation with thermophilic bacteria[J]. Journal of Northeastern University,2006, 27(4): 426−429.
[10] 杨洪英, 杨 立, 赵玉山, 陈 刚. 难处理金矿石中硫化物细菌氧化的活性序列[J]. 有色金属, 2002, 54(2): 42−44.YANG Hong-ying, YANG Li, ZHAO Yu-shan, CHEN Gang.Active alignment of sulphide minerals biooxidized by Thiobacillus ferrooxidans[J]. Nonferrous Metal, 2002, 54(2):42−44.
[11] YANG Hong-ying, GONG En-pu, YANG Li-li, WANG Da-wen.Chemical behavior of different arsenic-bearing sulphides bio oxidated by Thermophilic bacteria[J]. Transaction of Nonferrous Metals Society of China, 2005, 15(3): 648−652.
[12] 杨洪英, 杨 立, 魏绪钧. 氧化亚铁硫杆菌(SH-T)氧化毒砂的机理研究[J]. 中国有色金属学报, 2001, 11(2): 323−327.YANG Hong-ying, YANG Li, WEI Xu-jun. Mechanism on biooxidation of arsenopyrite with Thiobacillus ferrooxidans strain SH-T[J]. The Chinese Journal of Nonferrous Metals, 2001,11(2): 323−327.
[13] 杨洪英, 杨 立, 赵玉山, 陈 刚, 吕久吉, 范有静. 氧化亚铁硫杆菌对难处理金矿石中常见硫化物单矿物的氧化[J]. 有色金属, 2001, 53(3): 9−12.YANG Hong-ying, YANG Li, ZHAO Yu-shan, CHEN Gang, LÜ Jiu-ji, FAN You-jing. Bio-oxidation of sulphide minerals in refractory gold ores by Thiobacillus ferrooxidans[J]. Nonferrous Metal, 2001, 53(3): 9−12.
[14] 杨洪英, 杨 立, 范有静, 陈 刚, 赵玉山, 吕久吉. 广西某难处理金矿金的赋存状态研究[J]. 贵金属, 2003, 24(4): 32−35.YANG Hong-ying, YANG Li, FAN You-qing, CHEN Gang,ZHAO Yu-shan, LÜ Jiu-ji. Study on gold occurrence state of refractory gold concentrates in Guangxi[J]. Precious Metal, 2003,24(4): 32−35.
[15] SHARMA P K, DAS A, HANUMANTHA R K. Surface characterization of Acidathio bacillus ferrooxidans cells grown under different conditions[J]. Hydrometallurgy, 2003, 71(4):285−292.
[16] 卢宜源, 宾万达. 贵金属冶金学[M]. 长沙: 中南大学出版社,2004: 74−85.LU Yi-yuan, BIN Wan-da. Metallurgy of noble metal[M].Changsha: Central South University Press, 2004: 74−85.
[17] 孙淑媛, 孙龄高, 殷齐西, 符 斌. 矿石及有色金属分析手册[M]. 北京: 冶金工业出版社, 1990: 112−113.SUN Shu-yuan, SUN Ling-gao, YIN Qi-xi, FU Bin. The mineral and nonferrous metals analysis manual[M]. Beijing:Metallurgical Industry Press, 1990: 112−113.
[18] EHRILICH H L. Past, present and future of biohydrometallurgy[J]. Hydrometallurgy, 2001, 59(2): 127−134.[19] SAMPSON M I, PHILIPS C V, BLAKE R C. Influence of the attachment of Acidophilic bacteria during the oxidation of mineral sulfides[J]. Minerals Engineering, 2000, 13(4):373−389.
[20] BREED A W, HANSFORD G S. Studies on the mechanism and kinetics of bioleaching[J]. Minerals Engineering, 1999, 12(4):383−392.
Biooxidation-cyanidation leaching of gold concentrates with different arsenic types
CUI Ri-cheng, YANG Hong-ying, FU Yao, CHEN Sen, ZHANG Shuo
(School of Materials and Metallurgy, Northeastern University, Shenyang 110004, China)
The biooxidation and cyanidation leaching of gold concentrates and monominerals with different arsenic types were studied. The effects of arsenopyrite and realgar on the biooxidation and cyanidation leaching of gold concentrate were investigated. The results show that arsenopyrite in the arsenic-bearing gold concentrate is easily oxidized and decomposed. The dearsenification rate rises up to 93.10% after 192 h biooxidation. On the contrary, realgar cannot be biooxidated, which restrains the growth of bacteria and extends the lag phase. In the process of cyanidation leaching,arsenopyrite is very stable and does not participate in any side reactions, conversely, realgar participates in the side reactions with cyanide and alkali. The efficiency of cyanidation leaching is depressed because the precipitates produced form the film on the surface of gold grain in the process of cyanidation leaching.
realgar; arsenopyrite; biooxidation; cyanidation leaching
TF831
A
1004-0609(2011)03-0694-06
国家自然科学基金资助项目(50674029, 50874030);国家高技术研究发展计划资助项目(2006AA06Z127);高等学校博士学科点专项科研基金资助项目(20060145015)
2010-03-16;
2010-07-23
杨洪英, 教授; 电话: 024-83680373; E-mail: yanghy@smm.neu.edu.cn
(编辑 陈卫萍)
