乙醇熏蒸处理对杨梅果实保鲜及抗氧化活性的影响
2011-10-30杨爱萍汪开拓金文渊郑永华
杨爱萍,汪开拓,金文渊,郑永华*
(1.江苏经贸职业技术学院食品系,江苏 南京 210007;2.重庆三峡学院生物系,重庆 404100;3.苏州大福外贸食品有限公司,江苏 苏州 215111;4.南京农业大学食品科技学院,江苏 南京 210095)
乙醇熏蒸处理对杨梅果实保鲜及抗氧化活性的影响
杨爱萍1,汪开拓2,金文渊3,郑永华4,*
(1.江苏经贸职业技术学院食品系,江苏 南京 210007;2.重庆三峡学院生物系,重庆 404100;3.苏州大福外贸食品有限公司,江苏 苏州 215111;4.南京农业大学食品科技学院,江苏 南京 210095)
研究不同乙醇用量熏蒸处理对“乌种”杨梅果实采后腐烂、品质及抗氧化活性的影响。先将果实置于20℃下用100、250、500μL/L和1000μL/L乙醇熏蒸处理3h,然后转入1℃冷藏8d。结果表明:500μL/L乙醇处理能最显著的抑制杨梅果实贮藏期间腐烂率和细菌总数的上升,降低果实可溶性固形物和可滴定酸损失,维持其较高的硬度及VC含量;同时,乙醇处理还有效抑制了杨梅果实在贮藏期间总酚和总花色苷含量的下降,诱导果实中主要酚类单体物质杨梅黄酮和槲皮素-3-O-芸香苷及花色苷类主要单体物质矢车菊-3-葡萄糖苷的合成,抑制DPPH (1,1-diphenyl-2-picrylhydrazyl)清除率和还原力的下降,从而保持较高的果实抗氧化活性。结论:乙醇处理在杨梅果实保鲜中具有较好的应用前景。
杨梅;乙醇处理;腐烂;品质;抗氧化活性
杨梅(Mycira rubraSieb. et Zucc.)为我国南方特色水果,果实色泽鲜艳、风味独特,同时果实中还富含多酚类、花色苷类和黄酮类等多种天然抗氧化活性成分,能有效清除人体内的活性氧,预防各种慢性疾病的发生,因而深受消费者喜爱[1]。但杨梅果实水分高、组织柔软且无外果皮包裹,采后易受病原菌的侵染而发生腐烂变质,在常温下的货架期仅为1~2d[2]。因此,研究杨梅果实采后腐烂控制技术,已成为解决杨梅果实贮运保鲜问题的关键。
乙醇作为一种植物天然产生次生代谢物质具有强烈的杀菌作用,采用适当用量外源乙醇处理可显著抑制青花菜[3]、豌豆[4]、葡萄[5]、樱桃[6]和桃[7]等多种果蔬采后腐烂的发生。此外,乙醇处理还可以显著促进葡萄采后抗氧化物质的合成,从而提高果实的抗氧化活性[8]。因而乙醇处理在食品保藏中显示出了较好的应用前景[9]。对杨梅[10-11]的研究也发现,适当用量的乙醇熏蒸处理可显著抑制果实采后腐烂并保持品质,但乙醇处理对杨梅果实抗氧化活性的影响尚未见报道。本实验研究不同乙醇处理对杨梅果实采后腐烂、品质以及抗氧化活性的影响,旨在为乙醇处理在杨梅果实采后贮运保鲜中的应用提供依据。
1 材料与方法
1.1 材料、试剂与仪器
供试材料为“乌种”杨梅(Mycira rubraSieb. et Zucc. cv. Wumei),果实采摘于江苏省苏州市西山镇,采收后4h内运回实验室,选择大小一致、八成熟、无病虫害和机械损伤的果实。
碳酸钠、苯丙氨酸、β-巯基乙醇、脱氧核糖、二甲基亚砜 国药集团化学试剂有限公司;铁氰化钾、邻菲罗啉、硫酸亚铁、抗坏血酸 南京赛吉公司;辅酶A、ATP、4-香豆酸、Follin试剂、酚类和花色苷单体、DPPH 美国Sigma公司;乙腈、甲酸均为国产色谱纯;硼酸、硼砂、盐酸、磷酸氢二钠、磷酸二氢钠、醋酸、醋酸钠、丙酮、乙醇、三氯乙酸、三氯化铁均为国产分析纯。
GL-20G-H型冷冻离心机 上海安亭科学仪器厂;UV-1600型分光光度计 上海美谱达仪器有限公司;FA1104N电子天平 上海精密科学仪器有限公司;1100型高效液相色谱 美国安捷伦公司;E-200型生物显微镜 日本尼康公司;血球计数板 上海医用光学仪器厂;TA-XT2i型质构仪 英国Stable Micro System公司;WYT-4型手持折光仪 中国泉州光学仪器厂;MIR-233生化培养箱 日本三洋公司。
1.2 材料处理
在预试验中,将杨梅果实随机分为5组,放入密闭容器中,在20℃分别以0(对照)、100、250、500、1000μL/L乙醇熏蒸处理3h。处理结束后,将果实通风1h后用聚乙烯塑料盒(20×12×8cm)分装,于(1±1)℃贮藏8d后测定果实腐烂率。处理组果实最佳乙醇用量处理 3h,对照组在20℃密闭放置3h。处理结束后,将果实通风1h后用塑料盒分装,在(1±1)℃、相对湿度90%~95%条件贮藏8d。分别在果实处理前(0d)和贮藏期间每隔2d取样进行分析测定。
1.3 指标测定
1.3.1 腐烂率
杨梅果实表面出现霉菌性病斑即记为烂果。

1.3.2 菌落总数
杨梅果实菌落总数的测定:参照GB4789.2—2008《菌落总数测定方法》进行[12],略有改进。随机挑选每个处理组的5颗杨梅果实,质量大约为60~70g,以无菌操作分别放置于含有400mL生理盐水(内含0.1%(V/V) Tween-80)的锥形瓶中,经充分振荡30min后做成1:10(g/mL)均匀稀释液。取50μL稀释液涂布于营养琼脂培养基上,再置37℃恒温箱内培养24 h后显微观察并计算细菌的菌落形成单位(CFUs)。
1.3.3 果实可溶性固型物与可滴定酸含量测定
用手持折光仪测定可溶性固型物(total soluble solids,TSS)含量;采用标准氢氧化钠滴定法测定可滴定酸(titratable acidity,TA),结果以苹果酸百分含量表示。
1.3.4 果实硬度和VC含量测定
用质构仪测定果实硬度。探头(SMSP/6)直径为5mm,下压距离为5mm,下压速度为1mm/s。采用邻菲罗啉比色法测定VC含量,结果以mg/g表示。
1.3.5 果实总酚和总花色苷含量测定
取1g果肉用5mL丙酮匀浆并离心,取上清液用于总酚总花色苷含量的测定。采用Slinkard等[13]的Flion-Ciocalteu法测定果实总酚含量;采用Cheng等[14]的pH差异法测定果实总花色苷含量。以上结果均以mg/g表示。
1.3.6 酚类和花色苷类单体含量测定
参照Bao等[1]的液相色谱法进行,略有改进。取5g果肉用20mL丙酮匀浆并离心,取上清液旋转蒸发后过C18Sep-Pak萃取小柱再经0.45 μm孔径的纤维膜过滤,得滤液进行测定。手动进样,进样体积为20 μL提取液。分析色谱柱为反向C18分析柱,柱温20℃。流动相由3% (V/V)甲酸溶液和色谱纯的甲醇溶液两部分组成,梯度洗脱40min,流速为1mL/min。分别在280、370、520nm测定酚酸、黄酮和花色苷类单体物质。以外标法测定相关物质的含量,结果均以mg/kg表示。
1.3.7 DPPH(1,1-diphenyl-2-picrylhydrazyl)自由基清除力和总还原力测定
DPPH自由基清除率参照Larrauri等[15]方法进行测定,结果以清除百分率表示;还原力采用Ozsoy等[16]方法测定,结果以三氯化铁反应液在700nm处的吸光度(A)来表示。
1.4 数据分析
以上指标测定除腐烂率和硬度重复10次外,其余指标均重复3次。采用SPSS12.0进行数据处理分析,用邓肯氏多重比较方法进行差异显著性检验,5%为显著水平。
2 结果与分析
2.1 不同用量乙醇处理对杨梅果实腐烂的影响
果实腐烂是限制杨梅采后贮藏期最重要的因素。如图 1所示,100~1000μL/L乙醇处理均可显著(P<0.05)抑制杨梅果实在贮藏期间腐烂率的上升,且乙醇用量越高,果实腐烂率越低。但在1℃贮藏8 d后,1000μL/L乙醇处理果实的腐烂率(13.6%)反而略高于500μL/L乙醇处理(12.7%),因此在以下选用500μL/L乙醇熏蒸处理进一步研究其对杨梅果实冷藏时品质和抗氧化活性的影响。

图1 不同用量乙醇处理对1℃贮藏8d后杨梅果实腐烂率的影响Fig.1 Effect of different dosages of ethanol fumigation on decay incidence in Chinese bayberry after storage at 1 ℃ for 8 d
2.2 乙醇处理对杨梅果实细菌总数的影响

图2 乙醇处理对杨梅果实细菌总数的影响Fig.2 Effects of different dosages of ethanol fumigation on total aerobic bacteria count in Chinese bayberry
杨梅果实的细菌总数在冷藏期间逐渐上升(图2),从而影响果实的安全品质。500μL/L乙醇处理显著(P<0.05)抑制了果实细菌总数的上升。至冷藏8d时,乙醇处理果实的细菌总数比对照果实降低了近1000倍,从而有效的保证了实用的安全性。
2.3 乙醇处理对杨梅果实可滴定酸、可溶性固形物和VC含量以及硬度的影响
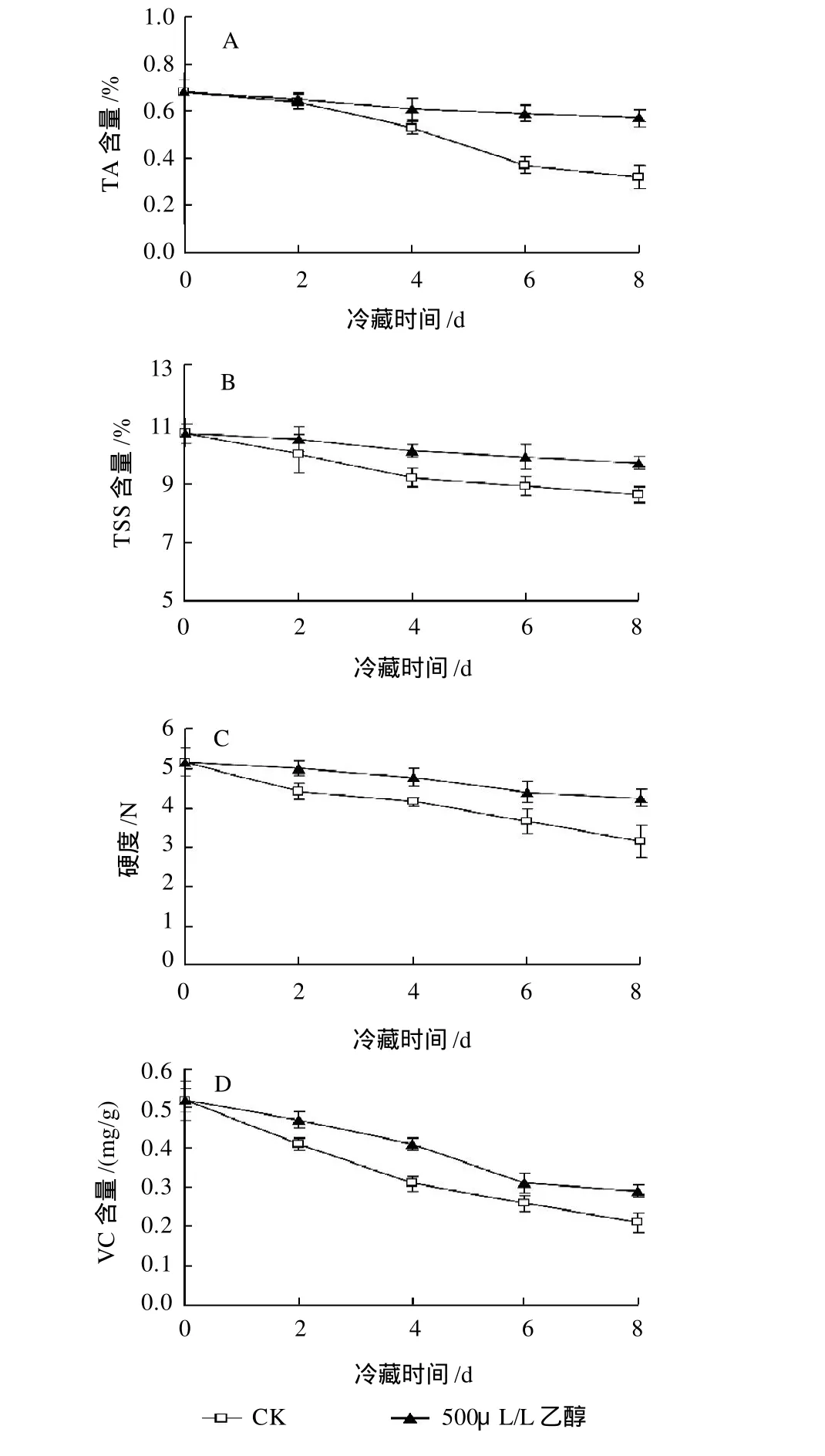
图3 乙醇处理对杨梅果实可滴定酸(A)、可溶性固形物(B)、硬度 (C)以及VC含量(D)的影响Fig.3 Effects of different dosages of ethanol fumigation on titratable acidity, total soluble solids, firmness and Vitamin C in Chinese bayberry
可滴定酸和可溶性固形物是形成杨梅果实特有风味的重要物质。如图 3A和3B所示,杨梅果实可滴定酸和可溶性固形物含量在冷藏期间呈逐渐下降趋势,乙醇处理能显著抑制(P<0.05)果实可滴定酸和可溶性固形物含量的下降。在冷藏8d后,乙醇处理果实中的可滴定酸和可溶性固形物含量分别是对照果实的1.78倍和1.23倍。果实硬度能够直接反应果实的贮藏效果,而VC含量是评价果实营养价值的重要指标。如图 3C和3D所示,随着贮藏时间的延长,杨梅果实硬度和VC含量逐渐下降。乙醇处理能显著抑制(P<0.05)果实硬度和VC含量的下降,在整个冷藏期间乙醇处理果实的硬度和VC含量均显著(P<0.05)高于对照果实。
2.4 乙醇处理对杨梅果实总酚、总花色苷和单体物质含量的影响
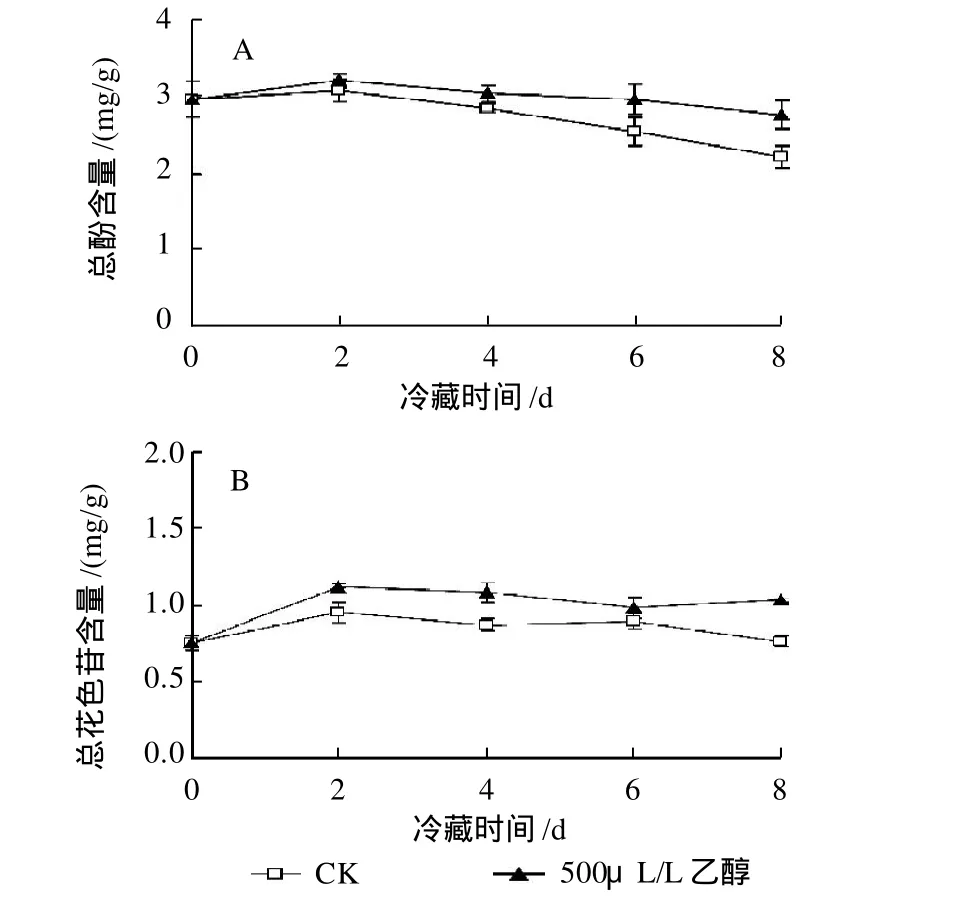
图4 乙醇处理对杨梅果实总酚(A)和总花色苷(B)含量的影响Fig.4 Effects of different dosages of ethanol fumigation on total phenolic and total anthocyanin contents in Chinese bayberry
杨梅果实在冷藏期间,总酚含量随着贮藏时间的延长而缓慢下降,而总花色苷含量则呈先上升再缓慢下降的趋势。乙醇处理明显抑制了杨梅果实总酚含量的下降,在整个冷藏期间乙醇处理果实的总酚含量都显著(P<0.05)高于对照果实(图4A)。同时,乙醇处理显著(P<0.05)诱导了花色苷的合成,乙醇处理果实中总花色苷含量在冷藏第2天达到峰值,其含量是对照果实的1.31倍,随后也保持了较高的含量(图4B)。
杨梅中酚类单体物质主要为没食子酸和原儿茶酸、杨梅黄酮和槲皮素-3-O-芸香苷;杨梅花色苷主要成分为矢车菊-3-葡萄糖苷。如表 1所示,上述5种单体物质含量在贮藏前期逐渐上升,随后缓慢下降。在贮藏前4d,乙醇处理可显著(P<0.05)诱导杨梅黄酮,槲皮素-3-O-芸香苷和矢车菊-3-葡萄糖苷的合成,并在贮藏后4 d维持了它们较高的含量。但乙醇处理对没食子酸和原儿茶酸含量无显著影响。
2.5 乙醇处理对杨梅果实抗氧化能力的影响
为评价杨梅果实的抗氧化能力,本实验选取了DPPH自由基清除率和总还原力来作为评价指标。如图5所示,对照果实的DPPH自由基清除率和总还原力在冷藏期间迅速下降。乙醇处理显著(P<0.05)抑制了DPPH自由基清除率和总还原力的下降,在整个贮藏期间乙醇处理果实的DPPH自由基清除率和总还原力都显著(P<0.05)高于对照果实这说明乙醇处理可保持果实较高的抗氧化活性。
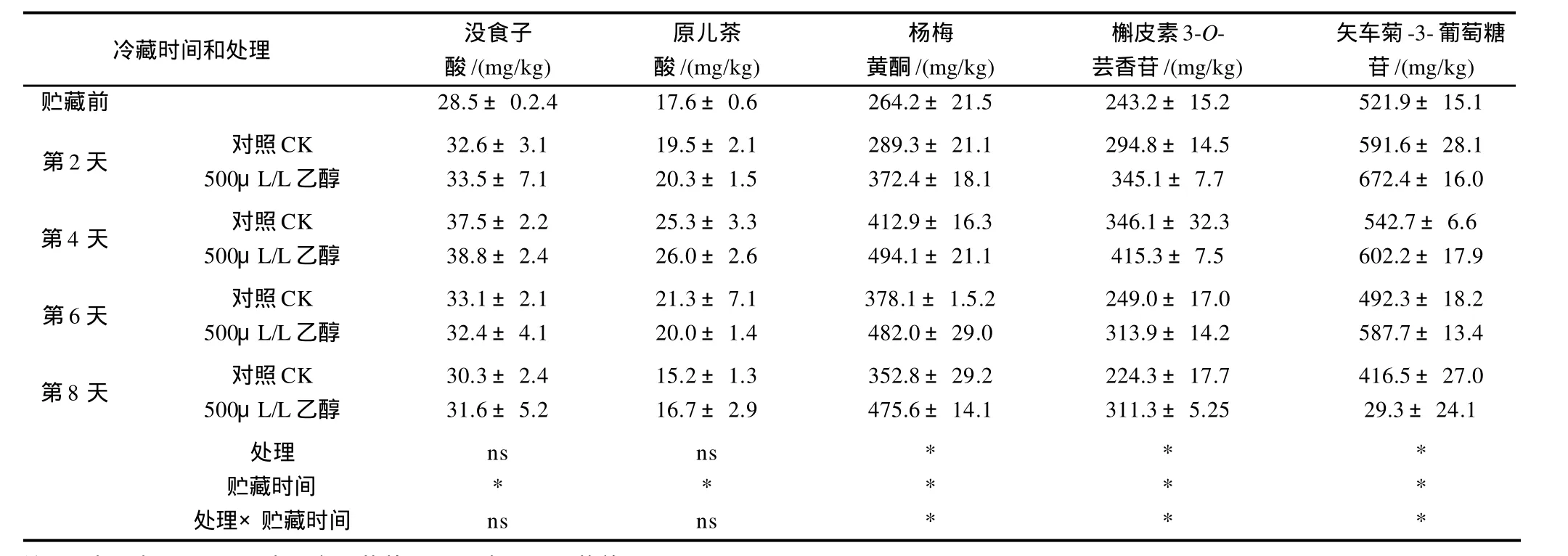
表1 乙醇处理对杨梅果实酚类和花色苷单体含量Table 1 Effect of different dosages of ethanol fumigation on the contents of individual phenolic and anthocyanin compounds in Chinese bayberry
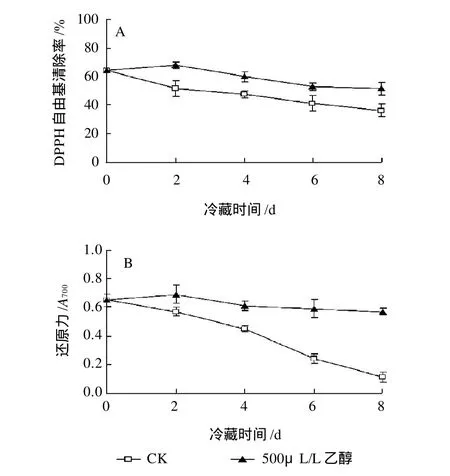
图5 乙醇处理对杨梅果实DPPH自由基清除率(A)和还原力(B)的影响Fig.5 Effects of different dosages of ethanol fumigation on DPPH free radical scavenging capacity and reducing power of Chinese bayberry
3 讨 论
组织腐烂是限制果蔬采后贮藏最重要的问题。许多研究表明,采用适当用量的外源乙醇处理可显著抑制多种果蔬采后腐烂的发生,从而延长贮藏期[9]。本研究发现500μL/L乙醇处理可以显著抑制杨梅果实采后腐烂的发生和细菌总数的上升,同时减少果实可滴定酸、可溶性固形物和VC含量的损失和延缓果实硬度的下降。这些结果表明,适当用量的乙醇熏蒸处理可有效控制杨梅采后病害的发生,同时保持果实固有品质,从而延长果实的贮藏期和保证实用的安全性,因而乙醇处理在杨梅果实保鲜中具有较好的应用前景。但乙醇处理对杨梅果实防腐的效果与处理浓度有关,在一定浓度范围内,乙醇用量越高,对果实防腐的作用越大。但乙醇用量过高,则会引起果实的渗透伤害[17],这是本研究中1000μL/L乙醇处理的防腐效果不及500μL/L处理的可能原因。
近年来的研究发现,乙醇能够调控植物一系列的生理生化反应,包括促进葡萄果实中花色苷的积累[8]和诱导青花菜中叶绿素的合成等[18]。在本试验中,500μL/L乙醇处理显著诱导了杨梅果实总酚和花色苷的增加,并在冷藏期间维持了它们较高的含量;进一步的液相色谱分析发现,乙醇处理也明显诱导了杨梅果实中一些活性单体物质如杨梅黄酮、槲皮素-3-O-芸香苷和矢车菊-3-葡萄糖苷的合成。伴随着这些抗氧化物质含量的提高,乙醇处理的杨梅果实DPPH自由基清除率及还原力均明显高于对照果实,这说明乙醇可以通过促进杨梅果实酚类和花色苷类物质的合成来提高果实抗氧化活性,从而提高果实的营养价值。但乙醇促进杨梅果实总酚和花色苷含量增加的机理还不清楚,尚待进一步研究。
4 结 论
4.1 500 μ L/L乙醇处理可以可显著抑制杨梅冷藏期间病害的发生,同时保持果实固有品质,延长果实的贮藏期,因而乙醇处理在杨梅果实保鲜中具有较好的应用前景。
4.2 500μL/L乙醇处理可有效抑制杨梅果实在贮藏期间总酚和总花色苷含量的下降,诱导果实中主要酚类和花色苷类单体物质的合成,抑制DPPH清除率和还原力的下降,保持较高的果实抗氧化活性,从而提高果实的营养价值。
[1]BAO J S, CAI Y, SUN M. Anthocyanins, flavonols and free radical scavenging activity of Chinese bayberry (Myrica rubra) extracts and their color properties and stability[J]. Journal of Agricultural and Food Chemistry, 2005, 53(6): 2327-2332.
[2]席玙芳, 郑永华, 应铁进, 等. 杨梅果实采后的衰老生理[J]. 园艺学报, 1994, 21(3): 213-216.
[3]CORCUFF R, ARUL J, HAMZA F, et al. Storage of broccoli florets in ethanol vapor enriched atmospheres[J]. Postharvest Biology and Technology, 1996, 7(3): 219-299.
[4]汪峰, 郑永华, 冯磊, 等. 乙醇处理对食荚豌豆保鲜效果的影响[J].食品科学, 2003, 24(4): 155-158.
[5]MLIKOTA GABLER F, SMILANICK J L, GHOSOPH G M, et al. Impact of postharvest hot water or ethanol treatment of table grapes on gray mold incidence, quality, and ethanol content[J]. Plant Disease, 2005, 89(3): 309-316.
[6]MARGOSAN D A, SMILANICK J L, SIMMONS G F, et al. Combination of hot water and ethanol to control postharvest decay of peaches and nectarines[J]. Plant Disease, 1997, 81(12): 1405-1409.
[7]KARABULUT OA, ARSLAN U, KURUOGLU G, et al. Control of postharvest diseases of sweet cherry with ethanol and hot water[J]. Journal of Phytopathology, 2004, 152(5): 298-303.
[8]KEREAMY A E, CHERVIN C, SOUQUET J M, et al. Ethanol triggers grape gene expression leading to anthocyanin accumulation during berry ripening[J]. Plant Science, 2002, 163(3): 449-454.
[9]DAO T, DANTIGNY P. Control of food spoilage fungi by ethanol[J]. Food Control, 2011, 22(3/4): 360-368.
[10]ZHANG Wangshu, LI Xian, WANG Xiaoxiao, et al. Ethanol vapour treatment alleviates postharvest decay and maintains fruit quality in Chinese bayberry[J]. Postharvest Biology and Technology, 2007, 46(2): 195-198.
[11]WANG Kaituo, JIN Peng, TANG Shangshang, et al. Improved control of postharvest decay in Chinese bayberries by a combination treatment of ethanol vapor with hot air[J]. Food Control, 2011, 22(1): 82-87.
[12]GB/T 4789.2—2008 食品卫生微生物检验: 菌落总数测定[S].
[13]SLINKARD K, SINGLETON V L. Total phenol analysis: Automation and comparison with manual methods [J]. American Journal of Enology and Viticulture, 1977, 28(1): 49-55.
[14]CHENG G W, BREEN P J. Activity of phenylalanine ammonialyase (PAL) and concentration of anthocyanins and phenolics in developing strawberry fruit[J]. Journal of the American Society for Horticultural Science, 1991, 116(5): 865-869.
[15]LARRAURI J A, SANCHEZ-MORENO C, SAURA-CALIXTO F. Effect of temperature on the free radical scavenging capacity of extracts from red and white grape pomace peels[J]. Journal of Agricultural and Food Chemistry, 1998, 46(7): 2694-2697.
[16]OZSOY N, CAN A, YANARDAG R, et al. Antioxidant activity ofSmilax excelsaL. leaf extracts[J]. Food Chemistry, 2008, 110(3): 571-583.
[17]FUKASAWA A, SUZUKI Y, TERAI H, et al. Effects of postharvest ethanol vapor treatment on activities and gene expression of chlorophyll catabolic enzymes in broccoli florets[J]. Postharvest Biology and Technology, 2010, 55(2): 97-102.
[18]KARABULUT O A, ROMANAZZI G, SMILANICK J L, et al. Postharvest ethanol and potassium sorbate treatments of table grapes to control gray mold[J]. Postharvest Biology and Technology, 2005, 37(2): 129-134.
Effect of Ethanol Fumigation on Fresh-keeping and Antioxidant Activity of Postharvest Chinese Bayberry
YANG Ai-ping1,WANG Kai-tuo2,JIN Wen-yuan3,ZHENG Yong-hua4,*
(1. Department of Food, Jiangsu Vocational Institute of Economy and Trade, Nanjing 210007, China;
2. Department of Biology, Chongqing Three Gorges University, Chongqing 404100, China;
3. Suzhou Full Fortune Food Co. Ltd., Suzhou 215111, China;
4. College of Food Science and Technology, Nanjing Agricultural University, Nanjing 210095, China)
In order to understand the effect of different dosages of ethanol fumigation on the decay, quality and antioxidant activity of Chinese bayberry cultivar Wumei, the fruit was fumigated by different dosages of ethanol at 20 ℃ for 3 h and then stored at 1 ℃ for 8 d. Ethanol fumigation at 500 μL/L had the most significant inhibitory effect on decay rate and total aerobic count during the storage period, the loss of total soluble solids and titratable acidity was reduced, and high firmness and VC content was maintained. Moreover, the reduction of total phenolics and anthocyanins contents was distinctly inhibited, the biosynthesis of individual phenolic compounds such as quercetin-3-O-rutinoside and myricetin, as well as the major anthocyanin cyanidin-3-glucoside was induced, and the decrease of DPPH free radical scavenging capacity and reducing power was also inhibited, suggesting the maintenance of high antioxidant activity for Chinese bayberry. These results demonstrate that ethanol fumigation has a promising application prospect in the fresh-keeping of Chinese bayberry.
Chinese bayberry;ethanol fumigation;fruit decay;quality;antioxidant activity
TS255.3;S668.4
A
1002-6630(2011)20-0277-05
2011-05-24
国家农业科技成果转化资金项目(2010GB2C100161);江苏高校优势学科建设工程项目
杨爱萍(1966—),女,副教授,硕士,研究方向为农产品安全与检测。E-mail:yap0420@163.com
*通信作者:郑永华(1963—),男,教授,博士,研究方向为农产品贮运技术。E-mail:zhengyh@njau.edu.cn
