油桃采后衰老与病害发生中品质与活性氧代谢相关性分析
2011-10-27杨宏伟陈小燕王友升李丽萍
杨宏伟,陈小燕,张 影,王友升*,李丽萍
(北京工商大学食品学院 北京市食品风味化学重点实验室,食品添加剂与配料北京高等学校工程研究中心,北京 100048)
油桃采后衰老与病害发生中品质与活性氧代谢相关性分析
杨宏伟,陈小燕,张 影,王友升*,李丽萍
(北京工商大学食品学院 北京市食品风味化学重点实验室,食品添加剂与配料北京高等学校工程研究中心,北京 100048)
探讨油桃果实在采后衰老与病害发生中近果核和近表皮处的品质与活性氧代谢的相关性。结果显示油桃采后衰老与病害发生中膜完整性、过氧化物酶(p er o x id as e,P O D)活性呈下降趋势,岀汁率、脂氧合酶(lipoxygenase,LOX)活性、H2O2含量呈升高趋势,过氧化氢酶(catalase,CAT)、抗坏血酸过氧化物酶(ascorbate peroxidase,APX)、多酚氧化酶(polyphenol oxidase,PPO)比活力呈先升高后下降的趋势。偏最小二乘回归分析结果表明:膜完整性与岀汁率、H2O2、LOX呈负相关,与POD、APX呈正相关。通径分析得出APX、POD、PPO对H2O2含量变化有强的负直接作用,其作用由强到弱为APX>POD>LOX。为进一步探讨相关酶在采后油桃果实抵抗病原菌侵染过程中所起的作用提供理论依据。
油桃;衰老;病害;主成分分析;偏最小二乘回归;通径分析
油桃属于呼吸跃变型果实,采后极易遭受病原菌的侵害而腐烂变质,严重影响油桃的贮运与销售[1]。当遭遇病原菌侵害时,果蔬体内的氧化还原体系的平衡被打破,随即产生大量的活性氧,过量活性氧的产生会使果蔬体内代谢失调。褐腐病菌(Monilinia fructicola)是导致核果类果实采后病害的重要病原菌[2],但对油桃采后抵制褐腐菌侵害的研究未见相关报道。有研究表明黄瓜果实不同部位的脂氧合酶(lipoxygenase,LOX)活性[3]、温州蜜柑果实不同部位活性氧含量[4]、苹果不同部位的H2O2含量[5]及芒果果实不同部位的抗氧化能力[6]有所不同,但对于油桃果实采后衰老和病害发生过程中不同部位活性氧代谢的变化研究国内未见报道。
利用不同统计方法解析果实品质与特征指标的关系,国内外已有相关报道。Wang等[7]利用单因素方差分析法(one-way ANOVA)研究甜樱桃果实与罗伦隐球酵母、褐腐病菌不同温度下的互作效应。陈小燕等[8]运用主成分分析法(principal component analysis,PCA)分析了1-MCP对桃果实低温贮藏期间挥发性物质的影响。Zheng等[9]利用偏最小二乘法回归(partial least squares regression,PLSR)预测了巴氏菠萝汁贮藏期间抗坏血酸、总酚和抗氧化能力的保留指数。滕建文等[10]运用通径分析(path coefficient analysis)解析了菠萝浓缩汁非酶褐变的原因。目前,未见关于比较多变量分析的不同方法解析果实采后品质变化与活性氧代谢相关性的研究。本研究综合运用不同分析方法研究油桃果实采后衰老与褐腐病害发生中近表皮和近果核的品质及活性氧代谢相关酶的变化规律及其相关性,为进一步探讨相关酶在采后油桃果实抵抗病原菌侵染过程中所起的作用提供理论依据。
1 材料与方法
1.1 材料与试剂
油桃品种为“丽春”,果实购买于北京市增光路美廉美水果市场上,挑选无病虫害、成熟度一致、大小均一的果实为试验材料,当天运至实验室;实验采用病原菌为桃褐腐病菌(Monilinia fructicola),将病原菌在相应寄主激活后,接种到马铃薯葡萄糖琼脂培养基(PDA)上,在28℃培养7~14d后待用。
丙酮、磷酸缓冲液(磷酸二氢钠、磷酸氢二钠)、硫酸钛、浓氨水、抗坏血酸、过氧化氢、硫酸、亚麻油酸钠、邻苯二酚溶液、愈创木酚溶液、聚乙烯吡咯烷酮(PVPP)、水杨酸、无水乙醇均为分析纯 北京北化精细化学品有限责任公司。
1.2 仪器与设备
Eppendorf 5810R型离心机、UV-2450型分光光度计、TP120电导率仪。
1.3 方法
1.3.1 材料处理
设计两组处理:衰老组,不接种病原菌;病害组,接种褐腐菌。每个果实接菌量为30μL,菌悬液透光度(T)相对于培养液均为75%。所有处理均置于25℃,相对湿度95%条件贮藏。每隔2d,病害组果实在距离病害发病部位5mol/L处取样,衰老组在相对应的位置分别取样,测定过氧化物酶(peroxidase,POD)、脂氧合酶(lipoxygenase,LOX)、过氧化氢酶(catalase,CAT)、抗坏血酸过氧化物酶(ascorbate peroxidase,APX)、多酚氧化酶(polyphenol oxidase,PPO)比活力和H2O2含量,直到大部分油桃果实腐烂时(贮藏6d)停止取样。
1.3.2 膜完整性和出汁率的测定
膜完整性测定:参考Wang等[11]方法,从10个果实中分别取直径10mol/L,厚度3mol/L的果肉圆片,置于布氏漏斗上,用去离子水冲洗伤口表面后,吸干,置于30mL去离子水中,3h后测定电导率(C1),随后将果肉在95℃煮沸15min并冷却至室温,测定电导率(C0)。
出汁率测定:参考王贵禧等[12]的方法,分别从10个果实取直径10mol/L,厚度3mol/L的果肉圆片,装入垫有吸水纸的离心管中,3000r/min离心多长时间,以果肉圆片离心后的质量损失率作为出汁率。

式中:m0为离心前果肉的质量;m1为离心后果肉的质量。
1.3.3 活性氧及相关酶的测定
用取样器在果实感染部位或伤口外大约2mm处的近果核处和近表皮处分别取样,置于提取液中,冰浴均质,4℃、10000r/min离心60min,取上清液立即测定。其中,H2O2含量的提取液为丙酮;LOX、CAT、APX、POD和PPO的提取液为磷酸缓冲液(100mol/L,pH7.8)+0.25g PVPP。
H2O2含量测定参照Brennan等[13]的方法;CAT比活力测定参照Wan g等[7]的方法;APX比活力测定按Nakano等[14]的方法;LOX、POD和PPO的比活力测定参照Wang等[15]的方法。
1.4 数据处理与分析
采用SPSS统计软件进行单因素方差分析,邓肯氏多重差异比较或t检验,当P<0.05时,表示差异显著。采用Unscrambler X 10.1统计分析软件进行主成分分析和偏最小二乘回归分析,采用DPS(v.8.01)软件进行通径分析。数据在进行各个分析前均先做标准化处理。
2 结果与分析
2.1 不同处理对各指标影响的显著性分析
由表1可知,油桃果实膜完整性近表皮处显著高于近果核处,贮藏前4d膜完整性随时间延长而显著下降,近表皮处较近果核处下降显著,病害组较衰老组下降显著;果实岀汁率贮藏前2d显著上升,4d时衰老组变化不显著,而病害组继续显著上升,前4d近表皮处均较近果核处上升显著;果实H2O2含量近表皮处2d时均显著上升,4d时变化不显著,近果核处,病害组前4 d显著上升,衰老组2d无显著变化,4d时显著上升;果实CAT比活力前4d均为先上升后下降,近表皮处较近果核处上升和下降变化更为显著,且近表皮处病害组较衰老组变化显著;果实APX比活力2d时均显著上升,4d时均显著下降,4d时病害组较衰老组下降更为显著;果实POD比活力近果核处显著高于近表皮处,衰老组前4d均显著下降,病害组2d时均显著下降,4d时近表皮处有升高趋势但变化不显著、近果核处继续显著下降;果实PPO比活力近果核处显著高于近表皮处,衰老组前4d均有上升趋势但变化不显著;而病害组2d时显著上升,4d时显著下降,且近表皮处较近果核处上升和下降变化显著;果实LOX比活力前2d均无显著变化,4d时均显著上升,且近果核处病害组较衰老组上升显著。
由以上分析可知,油桃果实PPO、CAT、膜完整性、岀汁率在近表皮处较近果核处的升高和下降的变化更为显著。病害的发生增大了CAT上升和下降的变化幅度,加速了APX、膜完整性的下降,诱导了岀汁率含量、近果核处LOX 、PPO和POD比活力的升高。
2.2 主成分分析
通过主成分分析得到前3个主成分(PC1、PC2、PC3)的累计贡献率为83%,因此设定这3个主成分即能够代表整体数据的信息特征。图1是各个理化指标在不同贮藏时间、不同处理下的载荷和得分散点的PCA双标图。油桃果实不同处理的样本按照贮藏时间在PCA双标图上被分成了4组,同一贮藏时间的不同处理的样本集中在一起,不同贮藏时间的样本分散在不同区域,这表明油桃果实理化特性与活性氧代谢相关酶活受贮藏时间的影响显著。
图1A中的PC1、PC2分别解释了变量的38%、27%。H2O2和岀汁率在PC1的负坐标处有较高的载荷,POD和膜完整性在PC1的正坐标处有较高的载荷。APX、LOX分别在PC2的正坐标和负坐标处有较高的载荷。由于H2O2、岀汁率、POD和膜完整性在PC1的高载荷量,PC1较好地区分了0d和4d时的样本差异。由于APX和LOX在PC2的高载荷量,PC2较好地区分了4d和6d时的样本差异。此外,POD和膜完整性区分了0d时近果核处和近表皮处的差异,H2O2、岀汁率和LOX区分了4d时的不同处理间的差异。POD靠近0d近果核处,膜完整性靠近0d近表皮处,说明POD的含量在0d时近果核处高于近表皮处,膜完整性在0d时近表皮处高于近果核处。图1B中的PC3解释了变量的18%,CAT和PPO在PC3上有较高的载荷,其较好地区分了2d时不同处理间的差异。CAT、PPO在2d时靠近病害组、远离对照组,尤其是近表皮处,说明病害的发生加速了CAT、PPO比活力的升高,其中近表皮处更为显著。
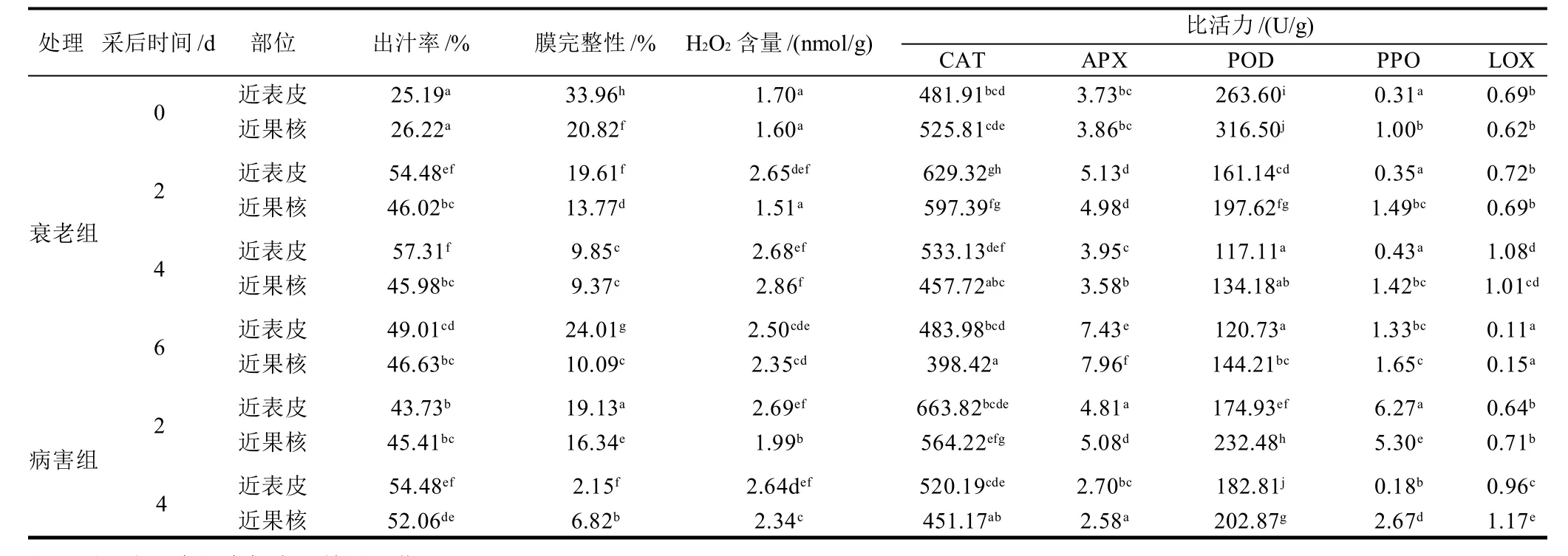
表1 油桃果实贮藏期间理化指标与活性氧代谢相关酶的变化Table 1 Changes of quality and enzyme activities related to active oxygen species metabolism in nectarine during postharvest storage


图1 油桃果实主成分的因子载荷和得分双标图Fig.1 PCA biplots of factor loadings and scores for nectarine
2.3 偏最小二乘回归分析

图2 基于主成分1与主成分2的PLSR回归模型的相关载荷图Fig.2 Correlation loading plot based on PLSR models for principal components 1 and 2
由主成分分析得到膜完整性和H2O2为各生理生化指标的关键指标,为了分析其他指标对膜完整性和H2O2的影响,本实验选取膜完整性、H2O2含量为Y变量,其他指标为X变量,建立PLSR模型,通过交叉验证法(cross-validation)得到显著性变量[16](图2)。由图2可知,该模型中62%的X变量解释了60%的Y变量。其中,H2O2含量与出汁率呈显著正相关,与膜完整性、POD呈显著负相关,由此可见H2O2在果实体内的变化主要受POD影响,并由品质指标岀汁率和膜完整性体现出来。膜完整性与岀汁率、H2O2、LOX负相关性显著,与POD、APX呈正相关,说明膜完整性的变化主要受H2O2和LOX影响,并由岀汁率体现出来。PPO与CAT靠近原点,与过氧化氢含量和膜完整性有微弱的相关性。
2.4 通径分析
由于H2O2为活性氧代谢的中心组分,也是联系果实的品质指标(岀汁率、膜完整性)和活性氧代谢相关酶(CAT、APX、POD、PPO、LOX)的桥梁,因而以H2O2为因变量(y)、其他指标为自变量(x)进行通径分析,结果如表2所示。结果表明,APX、POD、LOX对H2O2有显著的负直接作用,PPO对H2O2有显著的正直接作用。膜完整性、PPO都通过APX对H2O2有较大的负间接作用,CAT、POD、LOX都通过APX对H2O2有较大的正间接作用。膜完整性通过POD对H2O2有较大的负间接作用,岀汁率、APX都通过POD对H2O2有较大的正间接作用。各个因变量及他们之间的相互作用对H2O2的相关系数R为0.879150,决定系数R2为0.772904。可见,这些因变量对H2O2具有很强的决定作用。

表2 以H2O2 为因变量的通径分析结果Table 2 Path analysis results using H2O2 content as dependent variable
3 讨 论
本实验结果表明,虽然主成分分析法得出了各理化指标间的关键指标为H2O2、膜完整性、POD、岀汁率,但没能很好的反应出各指标间的相关性。而偏最小二乘分析显示品质指标膜完整性与岀汁率、LOX负相关性显著,与POD、APX呈正相关。膜完整性变化时,岀汁率、LOX、POD和APX的变化趋势在单因素方差分析中有体现,均与以上分析一致。Maalekuu等[17]证实辣椒果实体内的LOX可引起膜质的过氧化;Azevedo等[18]研究也表明木瓜果实在采后成熟过程中伴随着果实的软化,膜完整性急剧下降。
已有研究表明,接种褐腐菌的桃果实CAT、POD活性升高[19]。而甜樱桃褐腐病的发生受到抑制的主要原因是褐腐病菌刺激拮抗菌的生长并诱导果实ROS代谢相关酶活性升高[7]。偏最小二乘分析结果表明H2O2与膜完整性、POD呈显著负相关,与岀汁率呈显著正相关。通径分析印证了这一点,其结果显示膜完整性对H2O2有负间接作用(间接通径系数为-0.2898),POD有负直接作用(直接通径系数为-1.0452),岀汁率有正间接作用(间接通径系数为0.8248)。H2O2变化时,膜完整性、POD和岀汁率的变化趋势在单因素方差分析中有体现,均与以上分析一致。
研究表明,果蔬衰老和遭遇病原菌侵害时都会伴随着活性氧的大量增加[20]。APX、POD、CAT是关键的清除活性氧的酶类抗氧化剂[21]。而偏最小二乘分析只得出PPO和CAT与过氧化氢含量有微弱的相关性。通径分析则能得出PPO对H2O2有正直接作用(直接通径系数为0.2337),CAT对H2O2有正间接作用(间接通径系数为0.1189),APX(直接通径系数为-1.1102)、LOX(直接通径系数为-0.7381)对H2O2有显著的负直接作用,并通过各指标间的互作对其有一定的间接作用。但由于通径分析中,本实验选取的因变量对H2O2的总决定系数为0.772904;偏最小二乘回归分析中,只有62%的X变量解释了Y变量,且只被解释了60%。这些都说明还有影响自变量的因素未列入分析中,比如超氧化物歧化酶(SOD)等对H2O2的影响,超氧阴离子自由基、羟自由基、单线态氧等其他活性氧对膜完整性的影响,有待进一步研究。
[1] 冯立娟, 苑兆和, 尹燕雷, 等. 白肉甜油桃‘北极星’贮藏过程中果实品质的变化研究[J]. 山东林业科技, 2009, 39(1): 14-16.
[2] ZHOU Ting, SCHNEIDER K E, LI Xiuzhen. Development of biocontrol agents from food microbial isolates for controlling post-harvestpeach brown rot caused byMonilinia fructicola[J]. International Journal of Food Microbiology, 2008, 126(1/2): 180-185.
[3] 赵宇瑛, 杨静, 陈金凤, 等. 黄瓜果实不同部位的耐冷性差异[J]. 园艺学报, 2009, 36(7): 1060-1064.
[4] 邹英宁, 鲁蕾. 温州蜜柑果实不同部位抗氧化性能的比较[J]. 贵州农业科学, 2010, 38(10): 169-170.
[5] LU Shengming, SONG Jun, CAMPBELL-PALMERL. A modified chemiluminescence method for hydrogen peroxide determination in applefruit tissues[J]. Scientia Horticulturae, 2009, 120(3): 336-341.
[6] BAKAR M F A, MOHANMED M, RAHMAT A, et al. Phytochemicals and antioxidant activityof different parts of bambangan(Mangifera pajang)and tarap (Artocarpus odoratissimus)[J]. Food Chemistry, 2009, 113(2): 479-483.
[7] WANG Yousheng, TIAN Shiping. Interaction betweenCryptococus laurentii,Monilinia fructicolaand sweet cherry fruit at differenttemperatures[J]. Agricultural Sciences in China, 2008, 7(1): 48-57.
[8] 陈小燕, 王友升, 李丽萍, 等. 1-MCP对桃果实低温贮藏期间挥发性物质的影响: 主成分分析法[J]. 北京工商大学学报, 2010, 28(3): 48-54.
[9] ZHENG Hong, LU Hongfei. Use of kinetic, Weibull and PLSR models to predict the retention of ascorbic acid, total phenols and antioxidantactivity during storage of pasteurized pineapple juice[J]. LWTFood Science and Technology, 2011, 44(5): 1273-1281.
[10] 滕建文, 李欣, 夏宁, 等. 贮藏过程中菠萝浓缩汁非酶褐变原因解析[J]. 食品科学, 2008, 29(12): 701-704.
[11] WANG Yousheng, TIAN Shiping, XU Yong. Effects of high oxygen concentration on pro- and anti-oxidant enzymes in peach fruits during postharvest periods[J]. Food Chemistry, 2005, 91(1): 99-104.
[12] 王贵禧, 王友升, 梁丽松. 不同贮藏温度模式下大久保桃果实冷害及其品质劣变研究[J]. 林业科学研究, 2005, 18(2): 114-119.
[13] BRENNAN T, FRENKEL C. Involvement of hydrogen peroxide in the regulation of senescence in pear[J]. Plant Physiology, 1977, 59(3): 411-416.
[14] NAKANO Y, ASADA K. Purification of ascorbate peroxidase in spinach chloroplasts, its inactivation in ascorbate-depleted medium and reactivation by monodehydroascorbate radical[J]. Plant Cell Physiology, 1987,28(1): 131-134.
[15] WANG Yousheng, TIAN Shiping, XU Yong, et al. Changes in the activities of pro- and anti-oxidant enzymes in peach fruit inoculated withCryptococcus laurentiior Penicillium expansumat 0 or 20℃[J].Postharvest Biology and Technology, 2004, 34(1): 21-28.
[16] SHETTY N, GISLUMR. Quantification of fructan concentration in grasses using NIR spectroscopyand PLSR[J]. Field Crops Research, 2011, 120(1): 31-37.
[17] MAALEKUUK, ELKIND Y, LEIKIN-FRENKEL A, et al. The relationship between water loss, lipid content, membrane integrity and LOX activity in ripe pepper fruit after storage[J]. Postharvest Biology and Technology, 2006, 42(3): 248-255.
[18] AZEVEDO I G, OLIVEIRA J G, da SILVA M G, et al. P-type H+-ATPases activity, membrane integrity, and apoplastic pH during papaya fruit ripening[J]. Postharvest Biology and Technology, 2008, 48(2):242-247.
[19] XU Xiangbin, QIN Guozheng, TIAN Shiping. Effect of microbial biocontrol agents on alleviating oxidative damage of peach fruit subjected to fungal pathogen[J]. International Journal of Food Microbiology,2008, 126(1/2): 153-158.
[20] KAN Juan, WANG Hongmei, JIN Changhai. Changes of reactive oxygen species and related enzymes in mitochondrial respiration during storage of harvested peach fruits[J]. Agricultural Sciences in China, 2011,10(1): 149-158.
[21] GILL S S, TUTEJA N. Reactive oxygen species and antioxidant machinery in abiotic stress tolerance in crop plants[J]. Plant Physiology and Biochemistry, 2010, 48(12): 909-930.
Analysis of the Relationship between Quality and Active Oxygen Species Metabolism in Nectarine during Postharvest Ripening and Pathogenesis
YANG Hong-wei,CHEN Xiao-yan,ZHANG Ying,WANG You-sheng*,LI Li-ping
(Beijing Key Laboratory of Food Flavour Chemistry, Beijing Higher Institution Engineering Research Center of Food Additives and Ingredients, School of Food and Chemical Engineering, Beijing Technology and Business University, Beijing 100048, China)
The relationship between fruit quality and active oxygen species metabolism near the epidermis and core of nectarine during postharvest ripening and pathogensis caused by artificial infection withMonilinia fructicolawas analyzed. The results indicated that membrane integrity and peroxidase (POD) activities declined, juice rate, lipoxygenase (LOX) activities and H2O2 content increased, while the activities of catalase (CAT), ascorbate peroxidase (APX) and polyphenol oxidase(PPO)increased firstly and then decreased during postharvest ripening and pathogenesis. Partial least squares regression (PLSR)results identified that membrane integrity was significantly negatively correlated with juice rate, H2O2 content or LOX activity but significantly positively correlated with POD activity or APX activity. Pathway coefficient analysis results showed that the activities of APX, POD, LOX and PPO had a negative effect on the content of H2O2, and the order of the effects was APX>POD>LOX.
nectarine;senescence;diseases;principal component analysis;partial least squares regression;path coefficient analysis
TS201
A
1002-6630(2011)20-0244-05
2011-06-14
北京市属高等学校人才强教计划资助项目(PHR20110882);国家自然科学基金青年项目(30901009)
杨宏伟(1987—),女,硕士研究生,研究方向为食品生物技术。E-mail:yanghongwei200620190@126.com
*通信作者:王友升(1976—),男,副教授,博士,研究方向为食品生物技术。E-mail:wangys@th.btbu.edu.cn
