复合蛋白酶酶解油菜蜂花粉及其表征
2011-10-27张红城
高 鲲,张红城,董 捷*
(中国农业科学院蜜蜂研究所,北京 100093)
复合蛋白酶酶解油菜蜂花粉及其表征
高 鲲,张红城,董 捷*
(中国农业科学院蜜蜂研究所,北京 100093)
蜂花粉营养成分丰富,并多存在于花粉粒内部,花粉壁的存在限制了蜂花粉的开发和利用。结果表明:采用复合蛋白酶处理花粉,获得最佳破壁效果时的条件为:pH8、48℃、时间48h。并在此条件下利用比表面积、粒度分析、Zeta电位、扫描电镜、透射电镜对蜂花粉破壁进行表征评定,从不同角度反映酶法在改善花粉细胞通透性上起到的作用。
蜂花粉;复合蛋白酶;破壁;表征评定
蜂花粉是蜜蜂从蜜源植物花蕊内采集的花粉粒,经过蜜蜂向其内部加入了花蜜和分泌物,混合成不规则扁圆形、上面带有蜜蜂后肢嵌挟痕迹的团状物[1]。花粉中包括蛋白质、碳水化合物、不饱和脂肪酸、维生素、矿物成分等多种功能营养物质[2-4],因此有很高的营养价值,被人们称为“全能营养库”[5],延缓衰老、抗疲劳、美容、防治心脑血管疾病、增强胃肠功能等作用[6]。
蜂花粉的内容物被耐酸、耐碱、耐腐蚀的坚硬外壁以及内壁包裹着[7],外壁主要由孢粉素和纤维素构成,内壁主要含有纤维素和果胶[8]。花粉壁的存在阻碍了人体对蜂花粉内部营养成分吸收利用,因此需要对蜂花粉进行破壁处理,以提高人们食用花粉时对其营养成分的吸收利用率,另外,当蜂花粉被添加到化妆品、口服液、保健酒等高新产品中,由于皮肤没有消化吸收功能,液态产品又不能带有花粉壁,则必须对花粉进行合适的破壁处理。
现在使用的花粉破壁方法主要分为物理方法、化学方法、生化方法[9],并常用“破壁率”这一单一指标对破壁效果做出评价。目前,缺乏科学有效的评定蜂花粉破壁情况的表征方法。本实验采用处理条件温和的酶解方法,并首次采用比表面积、粒度分析、Zeta电位、扫描电镜、透射电镜等指标对花粉破壁情况进行科学全面的表征评定,完善蜂花粉破壁方法和破壁评价体系,有利于揭示破壁前后蜂花粉生理功能作用机制。
1 材料与方法
1.1 材料与试剂
花粉 中国农业科学院蜜蜂研究所;复合蛋白酶诺维信公司;蒸馏水;硫酸钾、硫酸铜、碳酸钠等均为分析纯。
1.2 仪器与设备
ASAP 2010比表面积分析仪 天津市达因仪器厂;QUANTA 200扫描电镜 美国FEI公司;H-T7650透射电镜 日本Hitachi公司;MASTERSIZER 2000激光粒度分析仪 英国马尔文公司;DelsaNano C Zate电位仪 美国贝克曼公司;LGJ-18S冷冻干燥机 北京松源华兴科技发展有限公司;HZQ-F160全温振荡培养箱 太合市实验设备厂;Kjeltec 2200半自动凯氏定氮仪 丹麦FOSS公司
1.3 方法
1.3.1 样品前处理[10]
将油菜蜂花粉研磨均匀,准确称取1.0g左右蜂花粉放入100mL三角瓶,然后向瓶中加入约20mL蒸馏水。试验中的每个水平做4个样,两个空白样品,两个加酶样品。
1.3.2 酶解
根据均匀设计表中设计的试验数据,调节各三角瓶中花粉液至相应pH值,分别为5.5、6、6.5、7、7.5、8,再加入0.1g左右的复合蛋白酶后移至摇床中,分别在45、50、55℃条件酶解24h或48h 。
1.3.3 均匀试验设计[11]
试验中的pH值、温度和时间等因素都对改善蜂花粉细胞通透性有影响,为了分析这3个因素以及各因素间的相互作用对酶解的影响,利用DPS软件设计了均匀试验设计表1。

表1 均匀试验设计因素水平表Table 1 Factors and their coded levels in uniform design
1.3.4 蛋白溶解指数的测定[12]
将处理好的花粉液以2500r/min离心20min,弃除上清液,收集沉淀,并放入真空干燥箱中干燥。准确称量0.1g左右干燥后的样品进行凯氏定氮,用于蛋白溶解指数测定。

1.3.5 比表面积测定
破壁后花粉粒的比表面积测定采用BET法[13]。将处理好的花粉液以2500r/min离心20min,弃除上清液,收集沉淀,放入真空冷冻干燥箱中干燥。准确称量一定量的样品加入到比表面积仪的称量管中,经ASAP 2010软件分析得出比表面积值。
1.3.6 粒度测定[14]
将5mL处理后的花粉液以2500r/min离心10min,去除上清液,用10mL蒸馏水溶解沉淀,重新离心去上清,再次溶解沉淀。将复溶的悬浊液加入激光粒度分析仪测定液中,利用低功率氦-氖激光器测定液体中花粉的粒度。
1.3.7 Zeta电位的测定[15]
经过处理后的花粉液以2500r/min离心10min,取上清液加入电位仪样品池,根据DelsaNano软件操作得出相应的Zeta电位值。
1.3.8 扫描电镜观察
处理后花粉液经2500r/min离心20min,取沉淀干燥成粉末状后,取少量均匀固定于样品台的胶带上,再放入离子测射装置镀金90s,将制备好的样品送入扫描电镜中抽真空,后将电镜调至适当倍数后观察。
1.3.9 透射电镜观察
将酶解后的花粉进行包埋处理,之后将包埋好的样品进行超薄切片,用眉毛笔把切片捞至铜网上,将铜网放至滤纸上干燥备用,干燥好后放入透射电镜的样品室观察。
2 结果与分析
2.1 酶法对蜂花粉蛋白溶解指数的影响

表2 均匀试验设计及结果Table 2 Uniform design and corresponding experimental results
如表2所示,利用DPS软件进行多元逐步回归方差分析,软件将根据输入的数据生成一个多元二次方程,方程如下:Y1=73.6967246-19.714835466X1+2.4019897367X2+1.0990100000X12-0.028048100001X22-0.012 2 9 0 6 5 0 1 2 9X32+0.0 2 7 3 8 9 8 0 6 4 4 9X1X2+0.026101666667X1X3+0.012287865741X2X3,其相关系数R2=0.8602,调整决定系数R2Adj=0.9639,F=4.9135,P=0.1089,方差分析结果表明,建立的回归方程具有统计学意义。
DPS软件同时生成最高指标时各因素的条件组合,即当酶解pH8、酶解温度49℃、酶解时间48h时能够得到最大的蛋白溶解指数,为65.4758%。蛋白溶解指数反应的是花粉经酶解后溶出的蛋白质与不加酶时比较,所得到的增加量,也就是说在最佳酶解条件下,溶出的内容物占花粉总内容物的比例。
从本试验可以看出,均匀设计适用于花粉破壁的研究,在考察影响花粉破壁的多因素多水平试验中,与以往的正交试验设计相比,均匀设计的试验点分散均匀,且试验次数减少,大大提高了试验的效率和准确度。
2.2 酶解对蜂花粉比表面积的影响
将试验得到的比表面积的数据添加至DPS软件的数据栏中,如表2所示,利用DPS软件进行二元逐步回归方差分析,软件将根据输入的数据生成一个二元方程如下:
Y2=-122.11058-18.280596953X1+7.356035932X2+0.6489000000X12-0.07625800000X22-0.006245024911X32+0.12175741935X1X2+0.03649629630X1X3+0.003590231481X2X3,其相关系数R2=0.9105,调整决定系数R2Adj=0.6107,F=1.8176,P=0.03379,方差分析结果表明,建立的回归方程具有统计学意义。
比表面积是指1g固体物质的总表面积,即物质内部的内表面积和外部的外表面积之和[12]。比表面积值越大,说明在相同体积条件下同种物质的总表面积越大,因此可以在一定程度上反应花粉粒的破壁情况和内容物的溶出情况,若蛋白酶实现了酶解作用,花粉壁上的蛋白物质会被降解,这样就会露出外壁的细微结构,萌发孔也会打开并露出部分内表面,同时内容物溶出,比表面积则会变大。DPS软件根据以上多元方程进行分析,结果表明获得最大比表积时的酶解pH8、酶解温度47℃、酶解时间48h,最大比表面积为12.6996m2/g。
2.3 最佳酶解条件的确定
比较蛋白溶解指数和比表面积的测定结果,两者获得最优解时的条件非常接近。综合两者的数据,得到最佳的破壁条件为酶解pH8、酶解温度48℃、酶解时间48h。
2.4 油菜蜂花粉在最佳酶解条件下的表征评定
2.4.1 比表面积
依照2.3节中获得的最佳酶解条件处理花粉,并做空白对照,得到空白样品的比表面积值为5.2013m2/g,经酶解处理样品的比表面积值为12.7688m2/g,油菜蜂花粉经处理后比表面积增加了145.49%,可见比表面积明显增加。说明在合适条件下经酶处理后,花粉液中的小粒径颗粒增多,一方面可能是因为花粉中的内容物溶出,增加了小粒径物质的数量,另一方面可能是因为花粉壁上的蛋白质被破坏,内壁外露,花粉粒的表面积相对增加,因此说明酶解后花粉实现了破壁,并促进了内部营养物质的溶出。
2.4.2 粒度分析

图1 蜂花粉的粒度分析Fig.1 Particle size distribution of rape bee pollen with and without protamex treatment
由图1可见,空白和加酶样品的粒度分布有明显的不同,同时分析软件给出的数据包括,空白样品50%颗粒粒径小于25.648μm,90%颗粒粒径小于51.837μm,花粉粒的平均粒径为31.138μm;加酶样品中50%颗粒的粒径小于23.039μm,90%颗粒粒径小于31.329μm,花粉粒的平均粒径为23.747μm。以上数据都说明加酶后样品中许多花粉粒的粒径明显减小,总体分布上向小粒径方向移动,该结果可能是由于经酶处理的花粉表面覆盖物被去除,细胞壁变薄,萌发孔打开所造成的,这样也必然利于花粉内容物的溶出。
利用激光粒度分析仪测定粒度,主要是从花粉壁破碎角度进行评定。与以往利用显微镜照片进行粒度分析的方法相比,采用此方法进行分析所得出的结果更加接近真实数据,且具有说明力,因为它所测定的对象是整个体系中的所有花粉粒,从而避免了因取样量有限带来的结果偏差。
2.4.3 Zeta电位
Zeta电位是反映悬浮物稳定性的重要指标,Zeta电位绝对值越大,说明体系中颗粒间排斥势垒越高,则粒子间越稳定。当液体中颗粒少时,相互间的斥力可视为零,颗粒会不停的做布朗运动,增加碰撞的可能性,体系不稳定;颗粒增多后,相互间会因距离减小而斥力增大,这就抵消了液体分子对其的部分作用力,体系变得稳定。从图2可知,空白样品Zeta电位绝对值为11.89mV,而加酶样品Zeta电位绝对值为24.49mV,酶解后的样品电位比空白样品高12.60mV,加酶样品液更稳定。这说明加酶蜂花粉细胞壁的通透性有所改善,内容物从花粉内部释放到外界,因溶液中内容物颗粒数量增多,且均匀分散,所以颗粒间距离会减小,又因为内容物颗粒表面带有相同的电荷,而产生高静电排斥,所以体系稳定。

图2 蜂花粉的Zeta电位Fig.2 Zeta potential of rape bee pollen with and without protamex treatment
Zeta电位大小反应了花粉内容物的溶出情况,是从溶液稳定性的角度进行表征评定。该方法从一个全新的视角用宏观的电位值来反应微观世界发生的物质变化,具有一定说明力。
2.4.4 扫描电镜
成熟蜂花粉的花粉壁可以明显地区分为两层,即外壁和内壁,外壁主要由孢粉素和纤维素构成,内壁主要由纤维素和果胶构成,并且油菜蜂花粉的壁上等距离分布着3个萌发孔,萌发孔处只有内壁而缺少外壁,它是花粉最易受环境影响的部位,因此要在此处破坏花粉壁的结构以达到破壁的目的。在通常情况下,花粉粒的外表面有覆盖物,它附着在花粉表面,当花粉释放后起着保护花粉免受损伤和侵染的作用,从另一角度来说也就限制了萌发孔的打开和内容物的溶出。从图3酶解前后油菜蜂花粉的对比照片可见,空白样品中的花粉粒基本成球形,萌发孔没有显露出来,并且花粉壁表面附着着大量的覆盖物,阻碍了其内部营养物质的溶出释放。而加酶处理后的花粉粒,其表面的覆盖物已完全去除,可以清晰的观察到花粉外壁光滑多孔的结构,而且花粉粒的3个萌发孔都已经打开并向外扩张,花粉粒基本成类扁球形,花粉的内容物则通过萌发孔处向外溶出。由此可以判定,酶解改善了蜂花粉细胞壁的通透性,并使其内容物溶出。
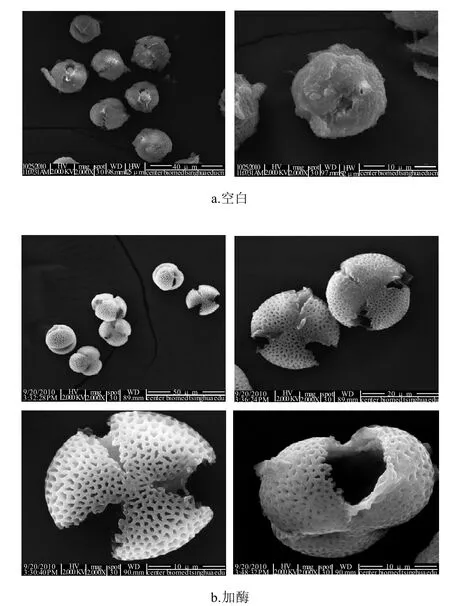
图3 蜂花粉的扫描电镜照片Fig.3 SEM micrograph of rape bee pollen with and without protamex treatment
2.4.5 透射电镜
从图4空白样品的超薄切片照片可清楚的看到蜂花粉内部结构,由外到内依次是外壁、内壁和内容物,外壁又分为外壁外层和外壁内层,外壁外层结构的空隙内充满着覆盖物,花粉壁上没有外壁只有内壁的部位称为萌发孔,内壁像一层弹性膜一样包裹着内容物。空白样品的花粉壁结构完整,花粉粒中充满了内容物,没有发生外溢。而经过酶解的样品,花粉的形态有了明显改变,花粉外壁不再连续完整,3个萌发孔处的内壁都有不同程度的外突,内部物质成团聚状外溢,有些花粉粒的内容物在此剖面上已完全溢出。因此,可以认为加酶处理能够明显改善花粉壁的通透性,且促使内溶物溶出。

图4 蜂花粉的透射电镜照片Fig.4 TEM micrograph of rape bee pollen with and without protamex treatment
本实验尝试利用全新的检测技术从不同角度对蜂花粉破壁、内容物溶出情况进行表征评定。比表面积、激光粒度分析和Zeta电位测定是利用物理指标对酶解蜂花粉进行评定,电镜的使用直观呈现了花粉酶解前后的形态改变,照片比光镜更清晰,也比单纯的数据结果更有说力。各表征评定结果相互吻合,共同验证了酶处理花粉,能够使其细胞壁通透性改善、内容物溶出这一假设。
3 结 论
3.1 利用复合蛋白酶酶解油菜蜂花粉得到的最佳酶解条件为pH8、温度48℃、时间48h,表征结果说明蛋白酶作用花粉效果显著,是一种理想的破壁方法。
3.2 在最佳酶解条件下测定的粒度结果显示,酶解后花粉粒径减小,总体在向小粒径方向移动,这表明花粉的细胞壁完整性被破坏。
3.3 Zeta电位结果反应了在最佳酶解条件下内容物的变化,说明酶解后的花粉壁通透性改善,溶解在溶液中的内容物明显增加。
3.4 扫描电镜和透射电镜的表征结果印证了粒度分析和Zeta电位的结论,直观的呈现了酶解前后花粉粒内外的变化,外部花粉壁不再完整,萌发孔打开,内部内容物溶出,含量减少。
综上所述,用复合蛋白酶酶解油菜蜂花粉,并首次应用比表面积、激光粒度、Zeta电位、电镜等新方法对其进行表征评定,揭示了花粉破壁的本质,各表征评定指标都能验证酶解促进花粉破壁、内容物溶出这一结论,它们共同建立起了科学可靠的花粉破壁表征评定体系。
[1] 吴素芳, 曹炜, 姚亚萍. 油菜蜂花粉提取物对羟基自由基介导2-脱氧核糖损伤的抑制作用[J]. 食品科学, 2006, 27(10): 544-548.
[2] 苏寿祁. 蜂花粉的化学组成[J]. 中国养蜂, 2005, 56(9): 42-43.
[3] AUCLAIR J L, JAMIESON C A. A quantitative analysis of amino acids in pollen collected by bees[J]. Science, 1948, 108: 357-361 .
[4] ROULSTON T H, GANE J H. Pollen nutritional content and digestibility for animals[J]. Plant Systematics and Evolution, 2000, 222(4):187-209.
[5] HESLOP-HARRION J. Pollen germination and pollen-tube growth[J].Plant Physiology, 1987, 107: 1-78.
[6] LINSKENS H F, JORDE W. Pollen and medicine 2 areview[J]. Economic Botany, 1997, 51(1): 78-87.
[7] ECHLIN P. Pollen[J]. Scientific American, 1968, 218: 80-90.
[8] 杨月琴, 胡凤祖, 卢挺. 青海油菜蜂花粉酶解破壁前后营养成分的比较[J]. 西北农业学报, 2007, 16(1): 100-102.
[9] 唐维, 张星海. 花粉破壁方法的研究进展[J]. 食品与发酵工业, 2003,29(12): 86-91.
[10] 任向楠, 张红城, 董捷, 等. 木瓜蛋白酶对油菜花粉细胞壁通透性改善的研究[J]. 食品科学, 2009, 30(23): 246-251.
[11] 金汝城, 周术涛. 均匀设计和正交设计在黄芪活性成份提取中的应用比较[J]. 生物数学学报, 2009, 24(3): 518-522.
[12] 刘桂宾, 张璐, 李元, 等. 豆粕蛋白溶解度测定方法的研究[J]. 检验检疫科学, 2007, 17(12): 36-39.
[13] 白峰, 马鸿文. 13X沸石分子筛的比表面积和孔分布[J]. 现代地质,2008, 22(5): 838-844.
[14] 周春华, 刘威, 张书香, 等. Fe3O4/P(NaUA-St-BA)核-壳纳米磁性复合粒子的合成与表征[J]. 高分子学报, 2005, 8(4): 606-610.
[15] 张立永, 贾树妍, 肖光辉, 等. 应用Zeta电位研究液态奶的稳定机制[J]. 中国乳品工业, 2007, 35(12): 38-41.
Protamex Hydrolysis and Cell Wall of Rape Bee Pollen
GAO Kun,ZHANG Hong-cheng,DONG Jie*
(Institute of Agicultural Research, Chinese Academy of Agricultural Sciences, Beijing 100093, China)
Bee pollen is rich in nutrients, most of which are present inside the cells. The development and exploitation of bee pollen is restricted by the existing cell wall. An investigation to cell wall disruption of rape bee pollen by means of protamex hydrolysis was carried out in this study. The optimal cell wall disruption conditions were found to be: pH 8, 48 ℃ and 48 h hydrolysis. Rape bee pollen with protamex treatment under these conditions was observed under SEM (scan electron microscope)and TEM (transmission electron microscope), and the specific surface area, particle size and Zeta potential were characterized.The results obtained collectively indicate the role of protamex hydrolysis in improving the permeability of rape bee pollen cells from different perspectives.
bee pollen;protamex;cell wall disruption;cell permeability
S896
A
1002-6630(2011)20-0099-05
2011-01-05
国家公益性行业(农业)科研专项(nyhyzx07-041);国家现代农业(蜂)产业技术体系项目(200808)
高鲲(1986—),女,硕士研究生,研究方向为蜂产品化学。E-mail:gaokunkun2008@163.com
*通信作者:董捷(1966—),女,研究员,硕士,研究方向为功能食品与生物活性物质。E-mail:jiedon@126.com
