葡萄籽中原花青素提取工艺
2011-10-27肖丽霞何志贵曾庆文胡博然
肖丽霞,何志贵,3,朱 勇,曾庆文,胡博然,*
(1.扬州大学食品科学与工程学院,江苏 扬州 225000;2.扬州大学生物科学与技术学院,江苏 扬州 225009;3.桂林旅游高等专学校,广西 桂林 541006)
葡萄籽中原花青素提取工艺
肖丽霞1,何志贵1,3,朱 勇2,曾庆文1,胡博然1,*
(1.扬州大学食品科学与工程学院,江苏 扬州 225000;2.扬州大学生物科学与技术学院,江苏 扬州 225009;3.桂林旅游高等专学校,广西 桂林 541006)
以发酵后葡萄籽为原料,研究微波、纤维素酶和超声波辅助提取葡萄籽中原花青素的工艺条件,对影响原花青素提取率的因素进行考察,通过正交试验确定葡萄籽中原花青素的最佳提取工艺。结果表明最佳方法为微波辅助提取,其最佳工艺条件:料液比1:25(g/mL)、乙醇体积分数80%、微波时间40s、微波功率115W,原花青素的提取率为10.70%。
葡萄籽;原花青素;微波;酶解;超声波
原花青素是从葡萄籽中提取出来的多酚类黄酮,主要是以儿茶素或表儿茶素为单体缩合而成的聚合物,还含有少量的儿茶素和表儿茶素、咖啡酸等有机酸,它们以复杂成分和协同方式起抗氧化作用,使其具有高度的生物利用度。原花青素具有多种药理活性,如抗氧化、清除自由基、护肝解毒、抗菌及抗癌等功能[1-6]。
随着我国葡萄酒业的发展,葡萄籽作为葡萄酒工业中的副产品也逐年增加。目前国内对葡萄籽的综合利用还比较低,只是简单地提取葡萄籽油或者是被用来当作饲料使用。将葡萄籽中的活性成分进行提取利用,能使葡萄籽得到充分利用,同时还能提高葡萄酒加工企业的经济效益[7-8]。
微波萃取是近年才发展起来的一门新技术,最大的特点是作用时间短,提取效率高,有效成功破坏小,节约能量等[9-11]。超声波被广泛应用于中草药有效成分的提取分离,由于这种技术具有快速、能耗低、提取率高的特点[12-14],受到越来越多的关注。高等植物细胞壁具有一定硬度和弹性的固体结构,主要由纤维素形成其网状框架,因此可以使用纤维素酶降解纤维素,使细胞壁等结构疏松瓦解,从而提高有效成分的提取率[15-16],具有条件温和、节约能源、提取率高、除杂等优点。
本实验采用微波、纤维素酶和超声波辅助提取3种方法对葡萄籽中原花青素的提取工艺进行研究,最终确定最适宜的提取方法及工艺条件,为葡萄籽中原花青素的提取和开发利用提供科学依据。
1 材料与方法
1.1 材料与试剂
葡萄籽由江苏太仓产地的酿酒葡萄赤霞珠经发酵后,过滤去皮获得。
儿茶素标准品 南京泽郎医药科技有限公司;纤维素酶 上海蓝季科技发展有限公司;香草醛 医药集团 上海化学试剂公司;浓硫酸 中国恒利试剂厂出品;无水乙醇 西陇化工股份有限公司。以上试剂均为分析纯。
1.2 仪器与设备
V-1600PC分光光度计 上海美谱达仪器有限公司;FW135型粉碎机 天津市泰斯特仪器有限公司;RE52-4型旋转蒸发仪 上海沪西分析仪器有限公司;DL-120B型超声波清洗器 上海三信仪器有限公司;TG16A-WS型离心机 卢湘仪离心机仪器有限公司。
1.3 方法
1.3.1 原料处理
将葡萄籽30℃烘干、粉碎,用石油醚浸泡48h,抽滤,烘干备用。
1.3.2 原花青素标准曲线绘制
采用硫酸-香草醛法[17]。精确称取儿茶素标准品配制成1.0mg/mL对照品标准溶液,分别取0、2、4、6、8mL定容到10mL,再各取0.5mL,依次加入2.5mL 30g/L的香草醛-甲醇溶液和2.5mL 30%浓硫酸-甲醇溶液,摇匀后于30℃水浴避光反应30min,然后测定A500nm,绘制标准曲线,回归方程为:y=0.5839x-0.0071(式中,y为吸光度,x为儿茶素质量浓度,R2=0.9990)。
1.3.3 葡萄籽中原花青素的提取及测定
准确称取葡萄籽粉1.0g,在一定条件下进行提取,合并滤液,减压浓缩,回收乙醇,定容后得原花青素提取液。吸取0.5mL原花青素提取液,按照标准曲线方法测定原花青素质量浓度,每样做平行3次,计算原花青素提取率。
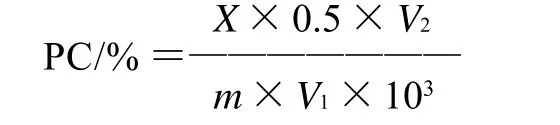
式中:PC为样品中原花青素提取率/%;X为根据标准曲线计算得的样品中原花青素质量浓度/(mg/mL);V1为取样体积/mL;V2为定容后样品总体积/mL;m为原料质量/g。
1.3.4 试验设计
研究微波、纤维素酶和超声波辅助3种方法提取葡萄籽中原花青素的工艺条件,对影响原花青素提取率的因素进行考察,通过单因素及正交试验确定葡萄籽中原花青素的最佳提取工艺。比较3种方法的优劣,确定最佳提取工艺。
2 结果与分析
2.1 微波辅助提取葡萄籽中原花青素试验
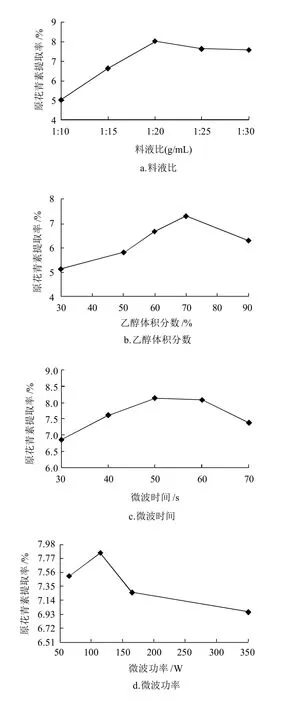

图1 各因素对微波辅助提取葡萄籽中原花青素的影响Fig.1 Effects of various microwave-assisted extraction parameters on extraction rate of proanthocyanidins
2.1.1 料液比对提取率的影响
如图1a所示,在其他条件一定的情况下,原花青素提取率随着提取液用量增加而增加,当料液比为1:20时,提取率达到8.02%,随着提取液用量的进一步加大,其提取率有所降低。因此,选择1:20为最佳料液比。
2.1.2 乙醇体积分数对提取率的影响
如图1b所示,当乙醇体积分数达到70%时,原花青素的提取率达到最高值7.3%。因为乙醇体积分数较低时,水的含量相应较高,则原花青素提取率会降低;而当乙醇体积分数过高时脂溶性物质容易溶出,从而降低原花青素的提取率。因此,选择70%为最佳乙醇体积分数。
2.1.3 微波时间对提取率的影响
如图1c所示,微波作用时间越长,原花青素提取率越高,微波超过50s后,提取率呈下降趋势,这是由于随着时间的增加,料液温度升高,使得热稳定性较差的原花青素被破坏。因此,选择50s作为最佳提取时间。
2.1.4 微波功率对提取率的影响
如图1d所示,随着微波功率的增加,提取物加热的速度加快,原花青素越容易被提取出来,当微波功率在115W时,提取率达到最大为7.85%。随着微波功率的进一步加大,提取率急剧降低,因为微波功率过大使得温度过高,原花青素损失越多。此外,在较高功率下乙醇溶液容易沸腾以至冲出三角瓶,影响试验结果。因此,选择115W为最佳提取功率。
2.1.5 提取次数对提取率的影响
葡萄籽经一次提取后,其中的有效成分不会立即提取完全,为考察原花青素经过多次提取后,原花青素的含量变化情况及工作需要,采用同样的步骤,对一定量的葡萄籽进行多次提取实验。如图1e所示,经过两次提取后,葡萄籽中的原花青素得率均在2%以上,3次提取时原花青素得率则较低,两次提取较为合理。
2.1.6 葡萄籽中原花青素微波提取正交试验
根据以上分析,在两次提取的情况下,对影响原花青素提取率主要因素料液比、乙醇体积分数、微波时间、微波功率进行L9(34)正交试验,研究这些因素对葡萄籽原花青素提取率的影响,因素水平见表1。

表1 微波辅助提取葡萄籽中原花青素正交试验因素水平表Table 1 Factors and their coded levels in orthogonal array design for optimizing microwave-assisted proanthocyanidins extraction

表2 微波辅助提取葡萄籽中原花青素正交试验结果与分析(n=3)Table 2 Orthogonal array design and corresponding experimental results for optimizing microwave-assisted proanthocyanidins extraction(n=3)
由表2可知,影响原花青素提取效果各因素为料液比>微波功率>微波时间>乙醇体积分数,料液比对提取率影响最大,乙醇体积分数对提取率影响最小;最佳提取条件组合为A3B3C1D2,即乙醇体积分数8 0%、料液比1:2 5、微波时间4 0 s、微波功率115W。在最佳条件下进行验证实验,得到原花青素提取率为10.70%,高于各试验组,说明正交试验优化结果可靠。
2.2 纤维素酶辅助提取葡萄籽中原花青素试验

图2 各因素对纤维素酶辅助提取原花青素的影响Fig.2 Effects of various cellulase hydrolysis-based extraction parameters on extraction rate of proanthocyanidins
2.2.1 酶添加量对提取率的影响
如图2a所示,酶添加量在300U/mg时,原花青素的提取率最高。酶添加量过低时,酶未被底物饱和;酶添加量较高时,可能由于溶液中的抑制剂与酶结合导致酶活降低。因此,选择300U/mg为最佳酶添加量。
2.2.2 酶解时间对提取率的影响
如图2b所示,酶和底物作用的时间对原花青素提取率的作用并不明显。开始作用时,随着时间的延长,提取率也相对升高,作用时间为1.5h时达到最高,之后随着时间的增加,提取率呈下降趋势。可能原因是:时间较短,酶与底物反应不完全,原花青素还没有完全溶出,时间较长,原花青素已大部分溶出,且随着在空气中暴露的时间增加,发生氧化损失,所以含量呈下降趋势。因此,选择1.5h为最佳提取时间。
2.2.3 pH值对提取率的影响
酶活性的发挥与它所处的pH值环境有关,过酸或过碱可以使酶的空间结构破坏,引起酶构象的改变,酶活性受到抑制或丧失。如图2c所示,pH4时,原花青素的提取率最高。综合考虑,选择最适pH4。
2.2.4 酶解温度对提取率的影响
如图2d所示,随着温度的升高,原花青素的提取率逐渐升高,50℃时达到最高,超过50℃后,随着温度的升高,原花青素的提取率降低,可见50℃是该反应条件下纤维素酶的最适温度,故选50℃为最佳提取温度。2.2.5 酶法辅助提取葡萄籽中原花青素正交试验
根据以上的分析,在两次提取的情况下,对影响原花青素提取率的主要因素酶添加量、酶解时间、pH值、酶解温度进行L9(34)正交试验,研究这些因素对葡萄籽原花青素提取率的影响,因素水平见表3。
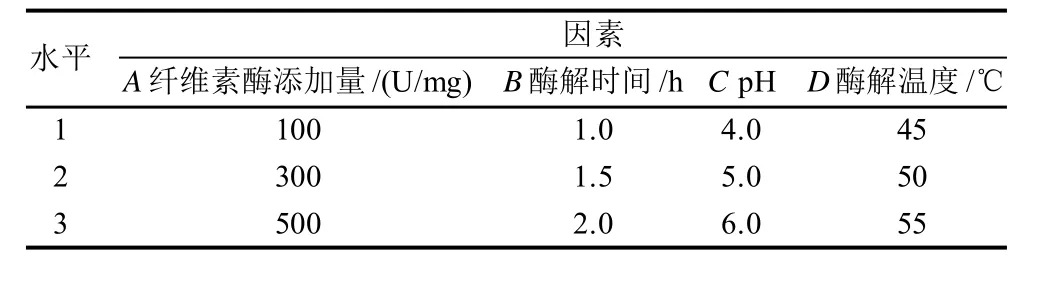
表3 纤维素酶辅助提取葡萄籽中原花青素正交试验因素水平表Table 3 Factors and their coded levels in orthogonal array design for optimizing cellulase hydrolysis-based proanthocyanidins extraction

表4 纤维素酶辅助提取葡萄籽中原花青素的正交试验结果与分析 (n=3)Table 4 Orthogonal array design and corresponding experimental results for optimizing cellulase hydrolysis-based proanthocyanidins extraction (n=3)
由表4可知:影响原花青素提取效果各因素为酶解温度>pH值>酶解时间>纤维素酶添加量;最佳组合为A1B1C1D1,即纤维素酶添加量100U/mg、酶解时间1.0h、pH4.0、酶解温度45℃。在最佳条件下进行验证实验,得到原花青素提取率8.75%,说明正交试验优化结果可靠。
2.3 超声波辅助提取葡萄籽中原花青素试验


图3 各因素对超声波辅助提取葡萄籽中原花青素的影响Fig.3 Effects of various ultrasonic-assisted extraction parameters on extraction rate of proanthocyanidins
2.3.1 乙醇体积分数对提取率的影响
如图3a所示,原花青素的提取率随着乙醇体积分数的增加而增加,乙醇体积分数达到60%时,原花青素的提取率最高达到2.61%,之后随着乙醇体积分数增加,原花青素的提取率下降。其原因可能是:当乙醇体积分数较高时,溶出的醇溶性杂质、色素、亲脂性强的成分增加,它们同原花青素竞争与乙醇-水分子结合,同时植物组织的通透性下降,都会导致原花青素的提取率降低。因此,确定60%为最佳乙醇体积分数。
2.3.2 料液比对提取率的影响
如图3b所示,随着提取液的增加,原花青素的提取率增大,但达到一定程度后,再增大料液比,提取率趋于稳定。这是因为溶剂用量达到一定程度后,葡萄籽中原花青素已经基本全部溶出,再增加溶剂的用量不仅造成不必要的浪费,而且还给后续加工增加麻烦。因此,提取液的用量不宜太大,故选择1:30作为最佳料液比。
2.3.3 超声温度对提取率的影响
原花青素的提取率与提取温度密切相关,一般来说,冷提杂质少;热提效率高,但是杂质也相对较多。确定一个适宜的温度不仅可以增加提取率,而且还有利于原花青素的纯化。如图3c所示,随着温度的升高,原花青素的提取率也随之增加,但当超过一定值后,随着温度的升高,提取率却有所下降。这是因为原花青素热稳定性较差,过高的温度不仅会使原花青素发生聚合氧化,而且会使提取的杂质含量增加。因此,选择45℃为最佳提取温度。
2.3.4 超声时间对提取率的影响
如图3d所示,随着超声波处理时间的延长,原花青素的提取率逐渐提高,但当超过25min时,原花青素的提取率有所下降。这主要是因为原花青素长时间受热部分结构被破坏,造成提取率下降。因此,选择25min作为最佳提取时间。
2.3.5 超声功率对提取率的影响
如图3e所示,超声波功率增加,原花青素的提取率也增加,在达到80W后,原花青素的提取率反而下降。功率增大有利于原花青素的提取,但是功率过大则会产生大量的热量使得原花青素的结构被破坏。
2.3.6 提取次数对提取率的影响
考虑到葡萄籽经一次提取,其中的有效成分不会提取完全,采用同样的步骤,对一定量的葡萄籽进行多次提取实验,由图3f可知:3次提取时,原花青素提取率很低,从工作量、生产成本等因素考虑,两次提取较为合理。2.3.7 葡萄籽中原花青素超声波提取正交试验

表5 超声波辅助提取葡萄籽中原花青素正交试验因素水平Table 5 Factors and their coded levels in orthogonal array design for optimizing ultraonic-assisted proanthocyanidins extraction

表6 超声波辅助提取原花青素的正交试验设计及结果(n=3)Table 6 Orthogonal array design and corresponding experimental results for optimizing ultrasonic-assisted proanthocyanidins extraction(n=3)
根据单因素试验结果,可以得出原花青素提取率的主要影响因素为乙醇体积分数、料液比、超声时间、超声功率。超声温度影响较小,不予考虑,选定温度45℃。在两次提取的情况下,以乙醇体积分数、料液比、超声时间、超声功率4因素进行正交试验,选择L9(34)正交表进行试验,因素水平见表5。
由表6可知:影响原花青素提取效果各因素为超声时间>料液比>超声波功率>乙醇体积分数;得出最佳提取条件组合为A1B3C3D2,即乙醇体积分数50%、料液比1:35、超声时间30min、超声波功率80W。在最佳条件下进行验证实验,原花青素提取率为5.57%,高于各试验组,说明正交试验优化结果可靠。
3 结 论
通过比较微波、纤维素酶和超声波辅助提取葡萄籽中原花青素的提取工艺,发现微波辅助提取优于其他两种方法。从提取时间来看,微波法能明显缩短提取时间,提取时间远小于其他两种方法,微波提取仅需40s,而其他两种方法都需时间较长;从原花青素提取率来看,微波法与纤维素酶法、超声波法相比,分别提高22.3%、92.1%。综合以上因素,葡萄籽中原花青素最佳方法为微波法,最优工艺为乙醇体积分数80%、料液比1:25、微波时间40s、微波功率115W,原花青素提取率为10.70%。
本研究为葡萄籽中原花青素的提取与开发利用提供了实验依据,为葡萄籽中原花青素的开发利用提供了参考。
[1] 温钢, 李立群, 隋新. 葡萄籽中低聚原花青素的提取研究[J]. 中国酿造, 2010(1): 111-113.
[2] YAHARA N, TOFANI I, MAKI K, et al. Mechanical assessment of effects of grape seed proanthocyanidins extract on tibial bone diaphysis in rats[J]. J Musculoskelet Neuronal Interact, 2005, 5(2): 162-169.
[3] 丰佃娟, 徐贵发. 葡萄籽提取物对人体抗氧化能力的影响[J]. 山东大学学报: 医学版, 2007, 45(10): 985-987.
[4] SHARMA S D, KATIYAR S K. Dietary grape-seed proanthocyanidin inhibition of ultraviolet B-induced immune suppression is associated with induction of IL-12[J]. Carcinogenesis, 2006, 27(1): 95-102.
[5] DA SILVA J M R, RIGAUD J, CHEYNIER V, et al. Procyanidin dimers and trimers from grape seeds[J]. Phytochemistry, 1991, 30(4): 1259-1264.
[6] LI Xiaoli, CAI Yongqing, QIN Hong, et al. Therapeutic effect and mechanism of proanthocyanidins from grape seeds in rats with TNBS-induced ulcerative colitis[J]. Canadian Journal of Physiology and Pharmacology, 2008, 86(12): 841-849.
[7] 吴春, 陆海燕, 李健. 葡萄籽原花青素的提取工艺[J]. 食品工业, 2004(3): 22-23.
[8] 王四维, 蒋蕴珍, 陈志华. 葡萄籽的综合开发与利用[J]. 粮油食品科技, 2008, 16(1): 39-41.
[9] JACOB J, CHIA L H L. Review thermal and non- thermal interaction of microwace radiat ion with materials[J]. Journal of Materials Science,1995(30): 5321-5327.
[10] 李凤英, 崔蕊静, 李春华. 采用微波辅助法提取葡萄籽中的原花青素[J]. 食品与发酵工业, 2005, 31(1): 39-42.
[11] 白光辉, 张辉, 王克亮, 等. 微波场作用下原花青素浸提工艺研究[J].应用化工, 2006, 35(9): 685-687.
[12] 李雅晶, 黄美珍, 胡福良. 均匀设计法优化超声波提取蜂胶精油工艺条件的研究[J]. 农产品加工, 2011(2): 60-61.
[13] 钟振声, 冯焱, 孙立杰. 超声波法从葡萄籽中提取原花青素[J]. 精细化工, 2005, 23(1): 41-43.
[14] 李瑞丽, 乔五忠, 王艳辉, 等. 葡萄籽原花青素的超声提取工艺研究[J]. 食品研究与开发, 2006, 27(2): 64-66.
[15] 吴春, 张艳. 纤维素酶法提取葡萄籽中原花青素的研究[J]. 食品科学, 2006, 27(10): 258-261.
[16] 汪志慧, 孙智达, 谢笔钧. 响应曲面法优化双酶法提取莲房原花青素[J]. 食品科学, 2011, 32(4): 64-68.
[17] 孙芸, 古文英. 硫酸–香草醛法测定葡萄籽中原花青素含量[J]. 食品与发酵工业, 2003, 29(9): 43-46.
Optimization of Proanthocyanidin Extraction from Grape Seed
XIAO Li-xia1,HE Zhi-gui1,3,ZHU Yong2,ZENG Qing-wen1,HU Bo-ran1,*
(1. College of Food Science and Engineering, Yangzhou University, Yangzhou 225127, China;2. College of Biological Science and Technology, Yangzhou University, Yangzhou 225127, China;3.Guilin Institute of Tourism, Guilin 541006, China)
The aim of this study was to optimize technical conditions for ultrasonic-assisted ethanol extraction, cellulase hydrolysis-based extraction and microwave-assisted ethanol extraction of proanthocyanidins from grape seed power using onefactor-at-a-time coupled with orthogonal array design method. Microwave-assisted extraction was found to be the best of the three methods, and the optimal process conditions were ethanol concentration of 80%, material-to-liquid ratio of 1:25 (g/mL),microwave treatment time of 40 s and microwave power of 115 W. Under these conditions, the extraction rate of proanthocyanidins was 10.70%.
grape seed;proanthocyanidins;microwave;cellulose;ultrasonic
R284.2
A
1002-6630(2011)20-0089-06
2011-05-31
海南省重点科技项目(070121;ZDXM20100005)
肖丽霞(1966—),女,副教授,博士,研究方向为农产品贮藏加工。E-mail:lxxiao@yzu.edu.cn
*通信作者:胡博然(19 64—),女,教授,博士,研究方向为葡萄酒、食品生物技术、食品安全。E-mail:huboran2001@yahoo.com.cn
