杨梅叶中总黄酮提取工艺及其抗氧化活性研究
2011-10-27林建原陶志华朱钐汕
林建原,陶志华,朱钐汕
(浙江万里学院生物与环境学院,浙江 宁波 315100)
杨梅叶中总黄酮提取工艺及其抗氧化活性研究
林建原,陶志华,朱钐汕
(浙江万里学院生物与环境学院,浙江 宁波 315100)
采用用正交试验优化杨梅叶中总黄酮的最佳提取工艺条件。以杨梅叶为原料,在乙醇体积分数65%、料液比1:30(g/mL)、提取时间1.5h、提取次数3次条件下,总黄酮提取率为3.34%。测定杨梅叶中总黄酮的体外抗氧化活性活性,结果表明:杨梅叶总黄酮对羟自由基、超氧阴离子自由基均有较强的清除作用,是一种天然有效的抗氧化剂。
杨梅叶;总黄酮;提取工艺;抗氧化活性
杨梅叶属杨梅科常绿乔木杨梅(Myrica rubraSieb. et Zucc.)的干燥叶片[1],其中含有的酚类化合物、萜类内酯和生物碱等具有较强的抑菌杀菌作用,有很高的药用价值。主要活性成分之一酚类化合物含有的黄酮类化合物具有清除体内活性氧自由基,防止生物膜脂质被超氧自由基和羟自由基氧化的功能,具有降血压、抗炎、抑菌、抗氧化活性等多种功效[2-4]。为有效利用杨梅叶中的黄酮类物质,本实验采用回流提取方法,通过正交试验确定杨梅叶总黄酮的最佳提取工艺条件[5],并对其抗氧化能力进行研究,为杨梅叶的开发利用提供科学依据。
1 材料与方法
1.1 材料与试剂
杨梅叶:采集于浙江宁波慈溪,60℃烘干,粉碎后过80目筛备用。
芦丁标准样品 中国药集团化学试剂有限公司;石油醚、乙醇、亚硝酸钠、硝酸铝、氢氧化钠、邻苯三酚、铁氰化钾、硫酸亚铁、三氯乙酸、碳酸氢钠、盐酸、三氨基甲烷、磷酸氢二钠、水杨酸、双氧水、三氯化铁等均为分析纯;实验用水均为双蒸水。
1.2 仪器与设备
BS224型电子天平 北京赛多利斯仪器系统有限公司;HH-2型数显恒温水浴锅 常州国华电器有限公司;S53型紫外-可见分光光度计 上海凌光技术有限公司;RE252型旋转蒸发仪 上海青浦沪西仪器厂。
1.3 方法
1.3.1 标准工作曲线的绘制
准确称取干燥至质量恒定的芦丁标准品20.00mg,置于100mL容量瓶中,加入甲醇溶解,定容,制得质量浓度0.2mg/mL的标准品储备液,分别准确吸取0.00、0.20、0.40、0.60、0.80、1.00mL于10.00mL具塞试管中,加入5%氯化铝3mL加甲醇定容,混匀,即得供试品溶液,同时做试剂为空白,在270nm波长处测定吸光度。以吸光度为纵坐标,质量浓度为横坐标,绘制标准曲线。用最小二乘法进行线性回归,得回归方程式:y=36.4x-0.0298,相关系数为0.9997,线性范围为0.004~0.02mg/mL。
1.3.2 黄酮化合物的提取工艺
原料→烘干→粉碎→石油醚除杂→去除滤液→乙醇回流→浓缩→蒸馏水溶解(pH4以下)→离心沉淀→总黄酮。
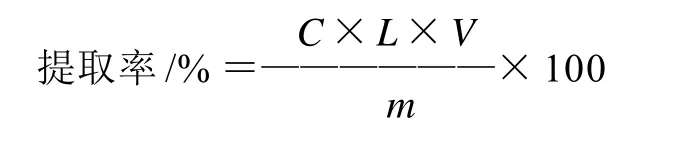
式中:C为由标准曲线计算得出的样品质量浓度/(mg/mL);V为样品溶液的体积/mL;L为样品的总稀释倍数;m为样品的质量/mg。
1.3.3 正交试验
固定水浴温度86℃条件下[5],对提取次数、处理时间、乙醇体积分数和料液比4个影响提取黄酮总含量的因素进行考察[6],对该因素进行单因素试验,比较各因素水平间提取率的差异。根据单因素试验结果,选择主要影响杨梅叶总黄酮提取效果的水平做正交试验,对结果进行极差分析,确定最佳提取工艺条件。
1.3.4 黄酮的还原力试验
取5支10mL容量瓶,分别加入不同质量浓度杨梅叶提取液,再加入2.50mL(pH6.6) 0.2mol/L磷酸缓冲液及2.50mL含1%铁氰化钾溶液,50℃水浴20min后急速冷却,加入含2.5mL 10%三氯乙酸水溶液,于3000r/min离心10min,取上清液5.00mL,加蒸馏水4.0mL及1.0mL含0.1%三氯化铁溶液,混匀,10min后在700nm处测定吸光度[7]。吸光度越大,则说明还原能力越强。
1.3.5清除超氧阴离子自由基(O2-·)作用试验
[8]进行。取5支10mL具塞试管,各加入2.00mL pH8.20的Tris-HCl溶液,分别加入2.50mL不同质量浓度杨梅叶提取的黄酮溶液,混匀,加入1.00mL 0.2mmo1/L邻苯三酚溶液,加水定容至刻度,以时间模式记录45min内每隔30s吸光度的变化,并计算提取物对超氧阴离子自由基的抑制率。
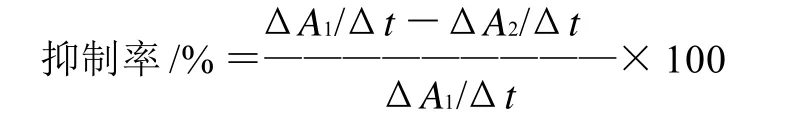
式中:ΔA1/Δt为邻苯三酚自氧化速率;ΔA2/Δt为加入提取物以后邻苯三酚自氧化速率。
1.3.6 清除羟自由基(·OH)作用试验

式中:E(·OH)为羟自由基的清除率/%;Ai为杨梅黄酮反应的吸光度;A0为空白吸光度;Aj为无水杨酸参加反应时杨梅黄酮的吸光度。
2 结果与分析
2.1 杨梅叶中黄酮的定性试验
取一定量样品溶液,滴加1%氢氧化钠溶液,溶液出现橘黄色。取样品溶液,滴加1%硼氢化钠溶液,溶液变为蓝紫色。取样品溶液,点于滤纸上,滴加1%三氯化铝乙醇溶液,吹干,在可见光下呈灰黄色。取样品溶液,滴加1%三氯化铁溶液,溶液产生墨绿色沉淀。取乙醇提取液1mL于试管中,加镁粉,再加入浓盐酸数滴(1次加入),在泡沫处呈紫红色。综合颜色反应结果,杨梅叶提取物中含有黄酮类化合物,其中可能含黄酮醇、双氢黄酮[12-13]。
2.2 单因素及正交试验
2.2.1 乙醇体积分数对杨梅叶总黄酮提取率的影响

图1 乙醇体积分数对杨梅叶总黄酮提取率的影响Fig.1 Effect of ethanol concentration on extraction efficiency of total flavonoids from bayberry leaves
在5.000g样品中,按料液比1:30分别加入体积分数55%、65%、75%、85%、95%的乙醇,在水浴锅中86℃条件下回流提取1.5h(2次),真空抽滤,减压浓缩,用蒸馏水溶解(pH<4),离心,测其吸光度,分别计算出黄酮的得率为2.21%、2.67%、3.17%、2.7%、1.74%。由图1可知,黄酮得率开始随乙醇体积分数的增大而增加,当体积分数达到75%时,总黄酮得率最大;当乙醇体积分数再增加时,得率又开始下降,并且脂溶性的物质溶出增多,尤其是叶绿素几乎完全溶出,给提纯去杂带来较大的麻烦。从成本和提取率来考虑,乙醇体积分数最好控制在65%~85%为好。
2.2.2 料液比对杨梅叶总黄酮提取率的影响
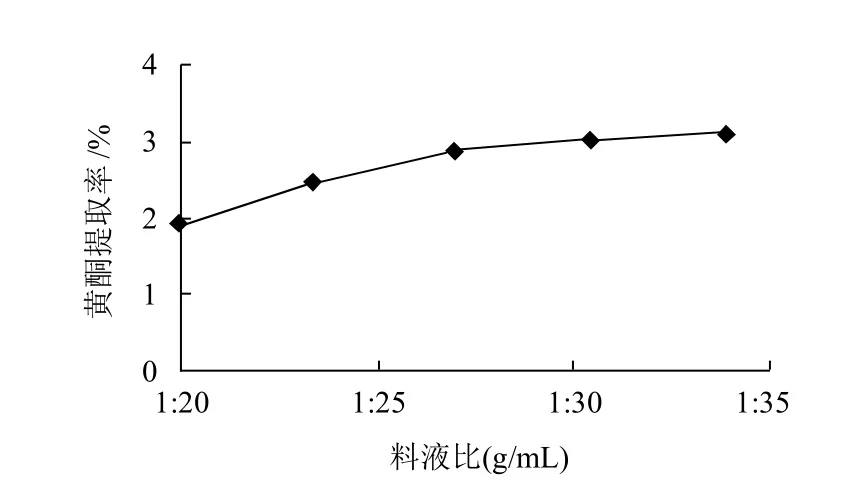
图2 料液比对杨梅叶总黄酮提取率的影响Fig.2 Effect of solid-to-liquid ratio on extraction efficiency of total flavonoids from bayberry leaves
分别按1:20、1:25、1:30、1:35的料液比加入75%的乙醇,其他条件同2.2.1节,结果见图2。由图2可知,随料液比减小,黄酮得率增加较快,当料液比小于1:35后,黄酮得率趋于恒定。从提取效果和减少溶剂用量等方面综合考虑,用量应不宜过大,故将料液比定在1:25~1:35。
正因如此,在2002年光大银行推出中国第一个理财产品之后,个人理财产品逐步成为了个人投资者主要的投资方式并得到了快速发展:2007年,只有不到50家银行发售理财产品,而2017年,这一数字已经扩大了10倍多,达到了572家;2007年个人理财产品种类只有1500种,而2017年,市场上存在25.77万种个人理财产品,十年间种类扩大了171.8倍;2007年,个人理财产品募集到的资金有9000亿元,而2017年募集到的资金扩大了进193倍,达到了173.59万亿元。
2.2.3 提取时间对杨梅叶总黄酮提取率的影响

图3 提取时间对杨梅叶总黄酮提取率的影响Fig.3 Effect of extraction time on extraction efficiency of total flavonoids from bayberry leaves
在料液比为1:30条件下,回流提取0.5、1、1.5、2.0、2.5h,其他条件同2.2.2节,结果见图3。由图3可知,黄酮收率随着回流作用时间的延长先增加后减少。当作用时间为0.5~2h时,黄酮的收率增加较快,当作用时间为2h时,黄酮收率最大,但此时与1.5h相比,仅略微增加;2 h后,随着作用时间的延长,黄酮的收率不但没增加反而下降,这可能是由于回流热效应,长时间的作用会破坏黄酮,在后处理过程中损失增大而影响黄酮的提取率,造成负面影响。从成本等各方面考虑,提取时间控制在1~2h为宜。
2.2.4 提取次数对杨梅叶总黄酮提取率的影响
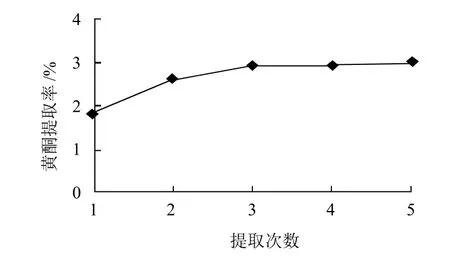
图4 提取次数对杨梅叶总黄酮提取率的影响Fig.4 Effect of number of repeated extractions on extraction efficiency of total flavonoids from bayberry leaves
在料液比为1:25条件下,在水浴锅中86℃回流1次、2次、3次、4次、5次,每次为1.5 h,其他条件同2.2.3节,结果见图4。由图4可知,黄酮收率随着提取次数增加而增加。当提取次数1~3次,黄酮的收率增加较快,随着次数的增多,黄酮的收率增加幅度很小。一方面其中的活性成分会受到破坏,杂质的溶出量增加,给后续操作带来不便,成本费用增加;另一方面也会造成溶剂的损失。从成本等各方面考虑,提取次数为2~3次时最佳。
2.2.5 正交试验设计及结果
在单因素试验的基础上,选择对杨梅叶总黄酮提取影响较大的乙醇体积分数、料液比、提取时间、提取次数4个因素进行正交试验,选择L9(34)正交表,绘制因素水平表,结果见表1。

表1 杨梅叶总黄酮提取正交试验设计及结果Table 1 Factors and their coded levels in orthogonal array design
以总黄酮提取率作为考察指标,分析试验结果可知,各因素影响程度大小依次为A(乙醇体积分数)>C(提取时间)>D(提取次数)>B(料液比)。回流提取总黄酮的最佳提取条件为A1B3C2D3,即乙醇体积分数65%、料液比1:30(g/mL)、提取时间1.5h、提取次数3次。
2.3 杨梅叶总黄酮样品稳定性考察试验
将同一杨梅叶总黄酮样品溶液平行配制9份,在室温条件下避免阳光直射,每隔30min测定1次吸光度。结果表明样品在4h内,吸光度基本保持不变。
2.4 黄酮还原力作用
以不加黄酮溶液的对照组为试剂空白,得到黄酮质量浓度(x)与吸光度(y)的线性回归方程为:y=0.111x+0.0347,相关系数为0.9985。
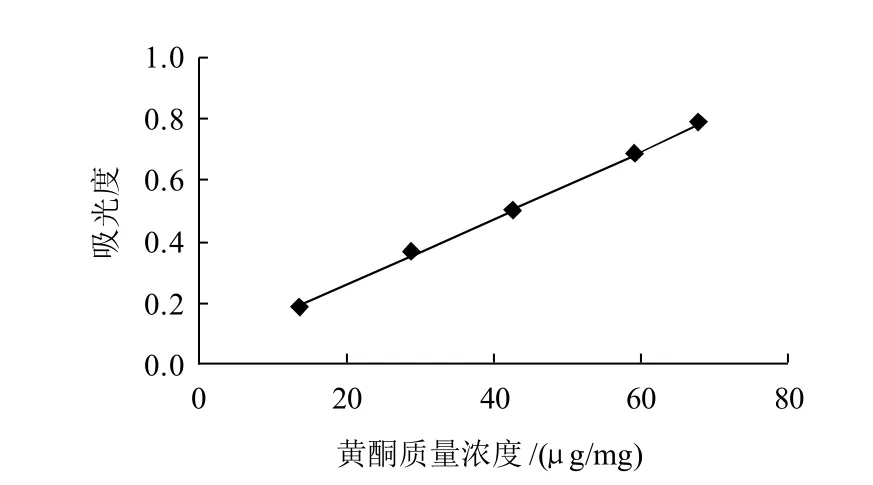
图5 黄酮的还原力Fig.5 Reducing power of total flavonoids from bayberry leaves
由图5可知,随着黄酮质量浓度的增大,还原力逐渐增强。当质量浓度为13.58μg/mL时,黄酮吸光度为0.192,当质量浓度为74.85μg/mL时,黄酮吸光度为0.877。证明,杨梅叶中黄酮是良好的电子供应者,具有较强的还原能力。
2.5 清除超氧阴离子自由基(O2-·)作用
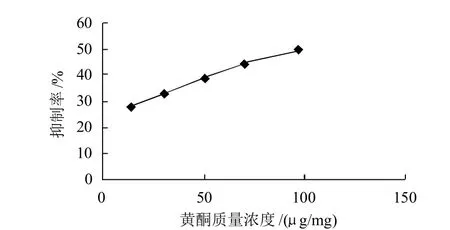
图6 黄酮对超氧阴离子自由基的清除作用Fig.6 Superoxide anion radical scavenging effect of total flavonoids from bayberry leaves
由图6可知,随着样品黄酮质量浓度的增加,对邻苯三酚自氧化速率的抑制作用越明显。当质量浓度为13.97μg/mL时,黄酮对超氧阴离子自由基的清除作用为27.71%。当质量浓度为96.91μg/mL时,对超氧阴离子自由基的清除作用为49.42%。证明杨梅叶有较强的清除超氧阴离子自由基活性。黄酮质量浓度(x)与抑制率(y)关系的回归方程为:y=-0.001x2+0.3786x+22.48,相关系数为0.9992。
2.6 清除羟自由基(·OH)的作用
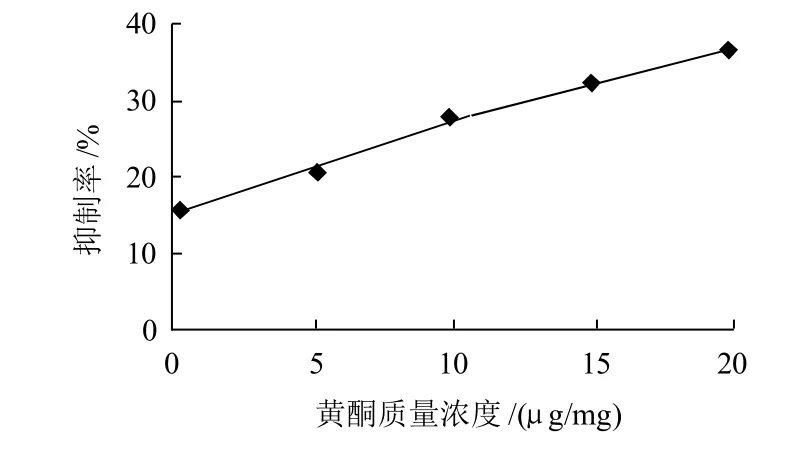
图7 黄酮对羟自由基的清除作用Fig.7 Hydroxyl radical scavenging effect of total flavonoids from bayberry leaves
由图7可知,对羟自由基的清除作用,黄酮质量浓度(x)与抑制率(y)关系的回归方程为:y=-0.0365x2+2.5927x+0.2905,相关系数为0.9950。
随着黄酮质量浓度增加,对羟自由基的清除作用逐渐加强。当黄酮质量浓度6.25μg/mL时,对羟自由基的清除率为15.6%。当质量浓度19.25μg/mL时,对羟自由基的清除率为36.4%。
3 结 论
3.1 回流法是一种有效提取杨梅叶总黄酮的方法,本实验所得最佳工艺条件为乙醇体积分数65%、料液比1:30(g/mL)、提取时间1.5h、提取3次,在该条件下,总黄酮提取率为3.34%。
3.2 抗氧化性试验表明,杨梅叶总黄酮具有较好的还原性以及清除羟自由基、清除超氧阴离子自由基的能力,而且在一定质量浓度范围内呈线性关系。
3.3 杨梅叶资源丰富,其有效成分和药理作用的研究已经引起广泛关注。本研究结果对于促进杨梅叶资源利用有一定的参考价值。
参考文献:
[1] 冀小君, 王淑君, 程侯莲, 等. 杨梅叶提取物中总黄酮的含量测定方法研究[J]. 山西中医, 2008, 24(2): 55-57.
[2] 邹耀洪. 杨梅果核中油脂抗氧化成分研究[J]. 林产化学与工业, 1995,12(2): 13-17.
[3] 夏其乐, 陈健初, 吴丹. 杨梅叶提取物抗氧化活性的研究[J]. 食品科学, 2004, 25(8): 80-82.
[4] 傅燕玲, 张英, 吴晓琴. 杨梅树叶、枝和树皮提取物抗氧化活性研究[J]. 食品工业科技, 2010(3): 196-199.
[5] 胡静丽, 陈健初. 杨梅叶黄酮类化合物最佳提取工艺研究[J]. 食品科学, 2003, 24(1): 96-99.
[6] 李志洲. 淡竹叶总黄酮最佳萃取工艺及其抗氧化性的研究[J]. 食品研究与开发, 2008, 29(11): 42-45.
[7] 汪海波, 刘大川, 佘珠花, 等. 大豆异黄酮类物质的提取、抗氧化性及稳定性研究[J]. 食品科学, 2004, 25(1): 111-114.
[8] ITO N, FUKUSHIMA S, HAGIWARA A, et al. Carcinogenicity of butylated hydroxyanisole in F344 rats[J]. J Natl Cancer Inst, 1983, 70(2): 343-352.
[9] 杜芳艳. 花生蔓总黄酮超声提取及其抗氧化性初步研究[J]. 西北农业学报, 2008, 17(1): 178-181.
[10] 吴琼英, 贾俊强. 柚皮黄酮的超声辅助提取及其抗氧化性研究[J]. 食品科学, 2009, 30(2): 29-33.
[11] 张兰杰, 候冬岩, 辛广, 等. D-氨基葡萄糖盐酸盐的制备及抗氧化特性的研究[J]. 食品科学, 2007, 28(4): 103-105.
[12] 中国科学院上海药物研究所植物化学研究室. 黄酮体化合物鉴定手册[M]. 北京: 科学出版社, 1981.
[13] 马卡姆 K R. 黄酮类化合物结构鉴定技术[M]. 北京: 科学出版社, 1999.
Extraction and Antioxidant Activity Evaluation of Total Flavonoids from Bayberry(Myrica rubraSieb. et Zucc.) Leaves
LIN Jian-yuan,TAO Zhi-hua,ZHU Shan-shan
(College of Biomedical and Environmental Science, Zhejiang Wanli University, Ningbo 315100, China)
An L9 (34) orthogonal array design was employed to optimize the extraction of total flavonoids from bayberry (Myrica rubraSieb. et Zucc.) leaves. Thein vitroantioxidant activity of total flavonoids extracted was evaluated by determining their scavenging capacity against hydroxyl radicals and superoxide anions. The optimum extraction conditions were determined as follows: 65% aqueous ethanol solution as extraction solvent at a material/liquid ratio of 1:30 (g/mL) for triple repeated extractions for 1.5 h each time and the extraction rate is 3.34%. Total flavonoids from bayberry leaves could strongly scavenge hydroxyl and superoxide anion free radicals, thus being a powerful natural antioxidant.
bayberry leaves;total flavonoids;extraction conditions;antioxidant activity
O657.39
A
1002-6630(2011)20-0026-04
2011-03-14
浙江省自然科学基金项目(Y2110865)
林建原(1965—),女,副教授,硕士,研究方向为天然产物的提取及分析。E-mail:linjianyuan@yahoo.com.cn
