氧诱导视网膜新生血管模型中基质细胞衍生因子1的表达及机制研究*
2011-10-24陈向武
袁 非, 陈向武
(复旦大学附属中山医院眼科, 上海 200032)
氧诱导视网膜新生血管模型中基质细胞衍生因子1的表达及机制研究*
袁 非△, 陈向武
(复旦大学附属中山医院眼科, 上海 200032)
目的观察基质细胞衍生因子1(SDF-1)在氧诱导视网膜新生血管(OIR)模型中的表达情况,并初步研究其在OIR模型中的促新生血管生长机制。方法30只C57BL/6J新生小鼠随机分为2组。其中15只小鼠置于氧浓度为75%的容器内饲养5 d,再转移至正常空气下饲养5 d,作为高氧诱导组;另15只小鼠一直在正常空气中饲养,作为正常对照组。免疫组织化学方法检测视网膜SDF-1、CD14蛋白的定位及含量,real-time PCR法检测视网膜SDF-1 mRNA的表达。结果与正常对照组相比,高氧诱导组突破视网膜内界膜的内皮细胞核数目明显增多(P<0.01),血管分支减少,大血管扩张、迂曲。两组小鼠视网膜神经上皮均可见SDF-1和CD14阳性染色,但高氧诱导组的SDF-1和CD14含量明显高于正常对照组(均P<0.01)。并且视网膜SDF-1与CD14的蛋白含量存在正相关(r=0.898,P<0.01)。视网膜SDF-1 mRNA表达在高氧诱导组也明显高于正常对照组(P<0.01)。结论OIR模型小鼠视网膜SDF-1表达增高,其促新生血管功能可能与CD14+细胞有关。
模型,氧诱导视网膜新生血管; 基质细胞衍生因子1; CD14
视网膜新生血管是多种疾病如早产儿视网膜病变(retinopathy of prematurity, ROP)、增殖性糖尿病视网膜病变(proliferating diabetic retinopathy, PDR)等发生的共同病理改变,其造成的渗出、出血和增生等一系列变化最终会导致视力丧失。基质细胞衍生因子1(stromal cell-derived factor 1,SDF-1)是一类具有趋化活性的细胞因子[1],在新生血管的生成过程中起重要作用[2-4],但具体机制尚未明了。大量资料显示循环中的CD14+细胞(主要包括内皮祖细胞[5-7]和单核/巨噬细胞)能促进新生血管的生长[8-11]。由于SDF-1是CD14+细胞的高效趋化因子[12, 13],因此我们推测SDF-1的促新生血管能力是通过趋化循环中CD14+细胞到达缺血部位而发挥作用。本研究旨在了解氧诱导视网膜新生血管模型(oxygen-induced retinopathy,OIR)中SDF-1的表达情况,并通过视网膜SDF-1表达与CD14含量的相关研究来初步探讨我们的推测。
材 料 和 方 法
1实验分组
由中国科学院上海实验动物中心提供[许可证号为SCXK(沪)2007-0005]7 d C57BL/6J清洁级新生小鼠共30只,随机将其分为2组:正常对照组(n=15)和高氧诱导组(n=15)。其中正常对照组小鼠于正常环境中饲养10 d至17 d。而高氧诱导组小鼠首先生活在密闭玻璃容器内(容器内氧浓度保持在75%±2%,气体流量为1.5 L/min)5 d后,转移到正常环境继续生活5 d至17 d。
2设备和试剂
2.1仪器设备 氧气分析仪(CY-12C)购自浙江省建德市梅城电化分析仪器厂。显微镜(Leica DM1RB)、高速冷冻离心机(Beckman GS-15R Centrifuge 和Eppendorf Centrifuge 5417R)、紫外线分光光度计 (UV-1601 Shimadau)、荧光定量PCR仪(ABI 7500型)由复旦大学附属中山医院中心实验室提供。
2.2试剂 ADP酶、4%多聚甲醛、Tris-马来酸缓冲液(0.05 mol/L和0.2 mol/L,pH 7.2)、硝酸铅、氯化镁、硫化铵,均由复旦大学上海医学院组胚实验室提供。氧气(纯度≥99.99%)与氮气(纯度≥99.8%),由复旦大学附属中山医院提供。碱石灰、75%乙醇、异丙醇、无水乙醇、氯仿,购自上海五四化学试剂有限公司。Trizol试剂购自Invitrogen。引物由上海生工合成。兔抗鼠SDF-1及兔抗鼠CD14 Ⅰ抗、羊抗兔Ⅱ抗、DAB均购自武汉博士德生物工程有限公司。
3视网膜铺片的制作及二磷酸腺苷酶(adenosinediphosphatase,ADP)酶染色
每组17 d龄小鼠各取3只(6眼),行乙醚吸入麻醉,解剖小鼠胸腔,充分暴露心脏,将灌注针头刺入左心室的同时用显微剪刀剪开右心房,先用生理盐水灌注约5分钟,然后灌注4%多聚甲醛溶液约5 min。再摘除小鼠眼球固定于4%多聚甲醛溶液中,4 ℃过夜。之后在小鼠眼球的角膜缘后约1 mm沿角膜缘环行剪开,去除角膜,取出晶状体,以视乳头为中心作4-5个放射状切开,尽可能清除巩膜、脉络膜和视网膜色素上皮层。将视网膜铺片用Tris-马来酸缓冲液(0.05 mol/L,pH7.2)冲洗数次后,于37 ℃反应液(浓度为0.2 mol/L,pH7.2的Tris-马来酸缓冲液中加入3 mmol/L硝酸铅。6 mmol/L氯化镁、1 g/L ADP)中反应15 min。再用Tris-马来酸缓冲液(0.05 mol/L,pH7.2)冲洗15 min×5次,然后10%硫化铵显色反应5 min。最后用Tris-马来酸缓冲液(0.05 mol/L,pH7.2)冲洗,甘油明胶封片。
4眼球石蜡切片制作
每组17 d龄小鼠各取6只(12眼),乙醚吸入麻醉,解剖胸腔,充分暴露心脏,将灌注针头刺入左心室的同时用显微剪刀剪开右心房,先用生理盐水灌注约5 min,然后灌注4%多聚甲醛溶液约5 min。摘除小鼠眼球固定于4%多聚甲醛溶液中,4 ℃过夜后,进行全层石蜡包埋,制作6 μm切片,方向平行于角膜至视乳头的矢状位平面,每张切片的眼环中角膜所占比例均不小于1/5且包括后极部视网膜。每个眼球制作10张切片,其中2张用于免疫组化染色(分别进行SDF-1和CD14免疫组化染色),8张用于HE染色。
5病理切片观察和视网膜新生血管计数方法
眼球石蜡切片进行常规HE染色和中性树胶封片后,2组各随机抽取30张制作和染色良好的眼球切片,在Leica DM1RB显微镜下观察并统计每张切片突破视网膜内界膜的血管内皮细胞核数,不包括玻璃体腔内其它与内界膜无联系的新生血管芽,比较2组差异。
6SDF-1、CD14视网膜免疫组织化学染色及图像分析
每个眼球2张石蜡切片,分别行SDF-1和CD14的免疫组化染色。常规进行SDF-1及CD14的免疫组化SABC法染色后,Leica DM1RB显微镜200倍下逐一拍摄切片并录入电脑后,用ImagePro Plus准确选取切片中视网膜部分(排除眼内外其它组织以免测量误差),即AOI(area of interest),测定其中积分吸光度值(integrated absorbance,IA)。计算单位视网膜面积的积分吸光度值,即IA/AOIIA。数据录入SPSS 16.0,采用t检验比较组间SDF-1(和CD14)的IA/AOIIA值差异,用Spearson法对SDF-1与CD14的IA/AOIIA值相关性进行分析。
7荧光实时定量PCR检测视网膜SDF-1mRNA含量
每组17 d龄小鼠各取6只(12眼)经颈脱臼处死后立即取出双眼眼球,迅速沿锯齿缘环行剪除眼前节,4 ℃生理盐水中剥离视网膜,以同一小鼠的2个眼球的视网膜组织作为1个标本,加入1 mL Trizol后组织匀浆。常规分离抽提RNA,紫外吸收法测定RNA纯度,随后逆转录合成cDNA。
运用Primer Premier 5.0设计引物,SDF-1引物序列如下:上游5’-GCCAACGTCAAGCATCTGAA-3’,下游5’-TGCACACTTGTTGTCTGTTGTTGTTCT-3’。反应为40个循环(95 ℃30 s;β-actin:60 ℃ 1 min;SDF-1:55 ℃ 30 s;72 ℃ 40 s)。
结果与计算:2-△Ct为目的基因的量通过内均一化处理之后相对于参照基因的值,由机器自动生成。但为了结果表示的需要,在2-△Ct值的基础上均扩大1×105倍。
8统计学处理
数据输入SPSS 16.0统计学软件进行分析。用t检验比较正常组和高氧组之间突破内界膜新生血管芽数目、SDF-1的平均吸光度值(IA/AOIIA)和mRNA表达量(即2-△Ct×105)、CD14的平均吸光度值之间差异。用Spearson相关分析法分析2组眼球切片SDF-1与CD14平均吸光度值的相关性。
结 果
1OIR模型的建立情况
1.1HE染色 随机抽取正常对照组和高氧诱导组各30张眼球HE染色切片于显微镜下观察。正常对照组见图1A,其神经纤维层较薄,外丛状层无血管,未见突破内界膜的血管内皮细胞 ;而高氧诱导组见图1B,其神经纤维层与内界膜附近有大量的新生血管,并且血管内皮细胞突破内界膜,在视网膜前形成新生血管,图片中黑色箭头为突破内界膜的血管内皮细胞,白色箭头为新生血管管腔。光镜下正常对照组突破内界膜的新生血管芽为0个,高氧诱导组685个。正常对照组突破内界膜的内皮细胞核数与高氧诱导组比较都有显著差异(P<0.01),表明OIR模型成功。
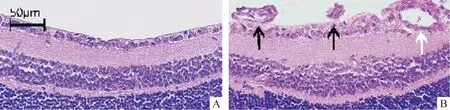
Figure 1. HE-stained sections of retina (×200). A:control group ; B:oxygen-induced group. Black arrows:the endotheliocyte nuclei of new vessels from retinal inner limiting membrane into the vitreous. White arrow: retinal neovascularization.
图1视网膜HE染色图
1.2视网膜铺片 正常对照组和高氧诱导组小鼠的视网膜铺片经过ADP酶染色后,置于光镜下观察视网膜血管形态,可见正常对照组视网膜血管发育完全成熟,自视盘向外周呈放射状均匀分布,未见血管闭塞,见图2A;高氧诱导组小鼠后极部视网膜见大片无灌注区,血管分支减少,大血管扩张、迂曲,中周部大量新生血管形成,见图2B,也表明OIR模型成功。
2视网膜神经上皮SDF-1、CD14定位及半定量图像分析
SDF-1免疫组化染色见2组视网膜切片均有棕黄色颗粒形成,主要分布于内层视网膜(以内颗粒层及神经节细胞层最为明显),部分血管周围细胞也可见明显阳性染色。CD14免疫组化染色表现同SDF-1。但需要注意的是CD14与SDF-1的阳性染色颗粒在视网膜上分布的层次相同。另外高氧诱导组SDF-1、CD14免疫组化染色的棕黄色颗粒较正常对照组颜色更深,分布范围更大,见图3。
通过半定量图像分析,正常对照组SDF-1的IA/AOIIA为0.0451±0.0109;高氧诱导组SDF-1的IA/AOIIA为0.0779±0.0145。正常组与高氧组之间比较,差异显著(P<0.01),见图4A。正常对照组CD14的IA/AOIIA为0.0454±0.0085;高氧诱导组CD14的IA/AOIIA为0.1021±0.0106。正常组和高氧组之间比较,差异显著(P<0.01),见图4B。用Spearson相关分析法,SDF-1与CD14蛋白的IA/AOI值呈正相关(r=0.898,P<0.01),见图4C。
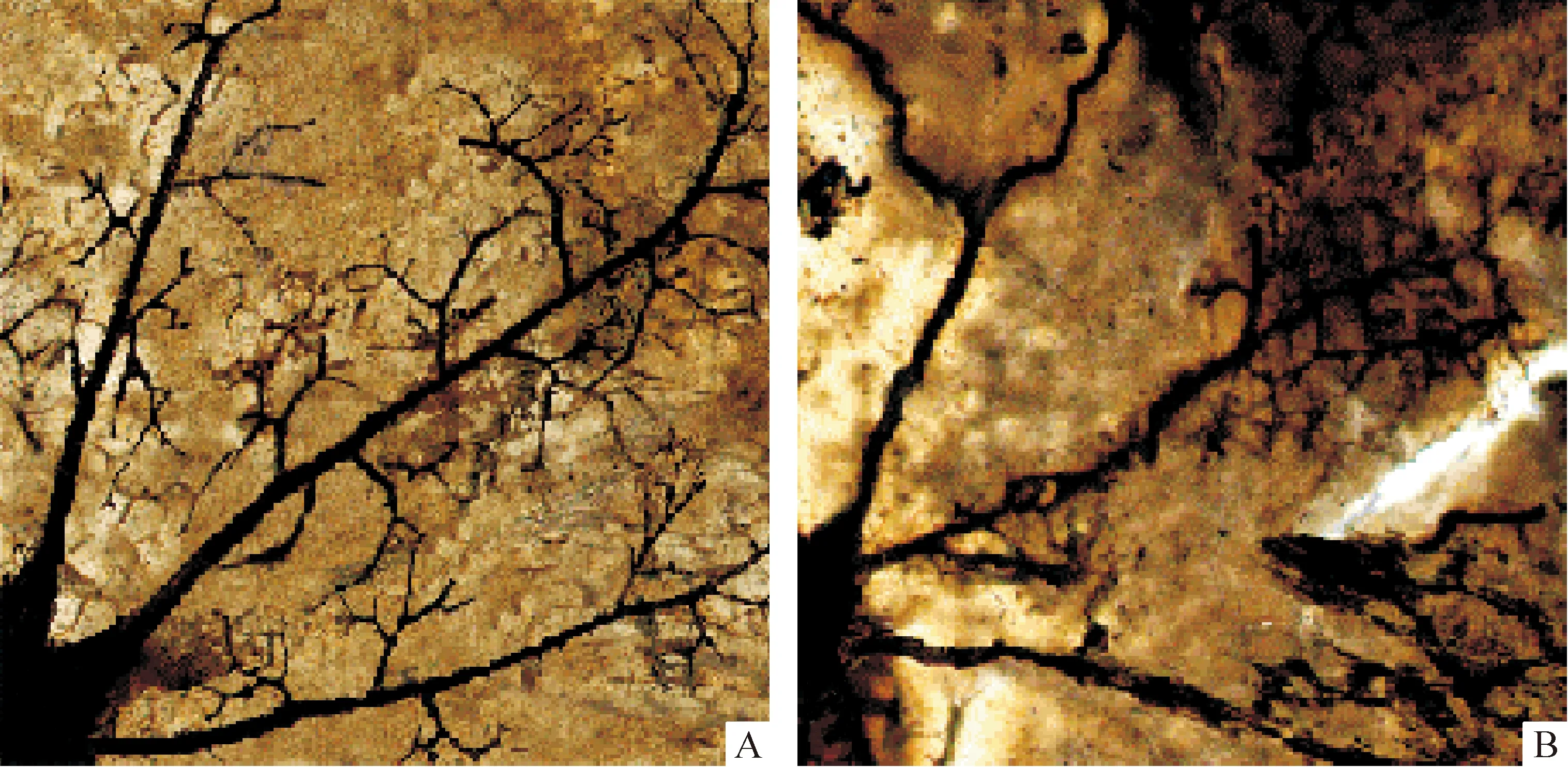
Figure 2. ADPase-stained sections of retina(×100). A:control group ; B:oxygen-induced group.
图2视网膜铺片图
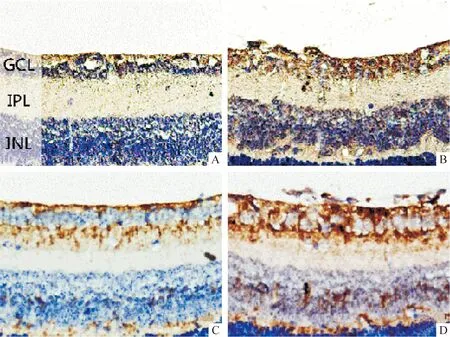
Figure 3. Immunohistochemistry detection of SDF-1 and CD14(×200). A: SDF-1 staining of control group; B: SDF-1 staining of oxygen-induced group; C: CD14 staining of control group; D: CD14 staining of oxygen-induced group. GCL:ganglion cell layer; IPL: inner plexiform layer; INL: inner nuclear layer.
图3SDF-1、CD14免疫组化染色图
3视网膜SDF-1mRNA的相对含量
将各个样品的目的基因和管家基因分别进行real-time PCR反应。高氧诱导组2-△Ct×105值为22.545±5.630;正常组为10.021±3.150,2组间差异显著(P<0.01),见图4D。
讨 论
本实验证实了OIR模型视网膜中SDF-1的表达增加。在SDF-1 mRNA水平,我们利用荧光实时定量的方法发现OIR模型小鼠视网膜中mRNA含量较正常小鼠增加。在SDF-1蛋白表达水平,我们利用免疫组化的方法,证实OIR模型视网膜SDF-1的表达以内层为主;且高氧渗导组SDF-1较正常对照组颜色更深、范围更广;同时结合数字图像分析系统,用单位视网膜面积内的阳性表达累积吸光度作比较,进行了半定量分析,我们可以证实该蛋白在OIR模型中视网膜组织表达明显增加。
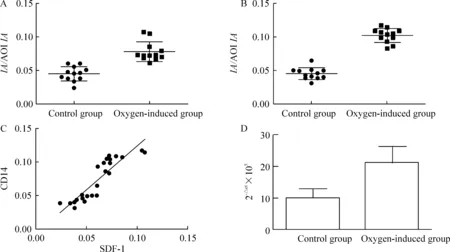
Figure 4. Graphs of the content and correlation of SDF-1 and CD14. A:scatter plot of SDF-1IA/AOIIA; B: scatter plot of CD14IA/AOIIA; C:scatter plot of collection between SDF-1 and CD14;D: scatter plot of SDF-1 mRNA expression.
图4SDF-1与CD14的含量及其相关图
近年SDF-1(CXCRL12)/CXCR4轴参与体内新生血管生成的作用逐渐受到重视。Butler等[14]在缺血缺氧视网膜动物模型中发现,动物玻璃体内注射SDF-1中和抗体后,即使有外源性血管内皮生长因子的存在,也无视网膜新生血管的发生。此外,体外视网膜内皮细胞培养的结果还提示它可上调黏附分子(VCAM-1)的表达,而下调密封蛋白(occluding)的表达[14]。VCAM-1可促进CD14+细胞的附壁、游走,occludin减少可加重血视网膜内屏障的损伤,这些都是促进新生血管的重要因素。既往的研究通过细胞离体培养或者测定增生性视网膜病变患者玻璃体、血清中SDF-1浓度等方法来间接提示SDF-1在视网膜新生血管中作用[15, 16],我们在实验中直接观察到OIR模型中视网膜内层SDF-1的表达明显增加,无疑进一步提示该因子在视网膜新生血管发展中的地位,但SDF-1是通过何种具体机制而促进视网膜新生血管的生长?这还需要更多工作。
结合大量研究资料[10,11,17, 18],我们推测SDF-1的促新生血管能力是通过趋化循环中CD14+细胞(如内皮祖细胞和单核/巨噬细胞)到达缺血部位而发挥作用。假如该推测正确,那么在SDF-1高表达部位应该有更多CD14+细胞的聚集。我们前面的研究已发现,OIR模型中视网膜SDF-1表达较正常视网膜明显增加,那么CD14+细胞聚集是否也随之增多?
我们的研究采用视网膜CD14免疫组化染色来反应CD14+细胞聚集程度,初步探讨其与SDF-1之间的关系。实验结果发现:(1)无论是在正常对照组,还是高氧诱导组视网膜中均有SDF-1和CD14的阳性染色,并且值得注意的是这2种蛋白的阳性染色在视网膜分布层次相同;(2)视网膜CD14与SDF-1的IA/AOIIA值存在正相关。假如我们的推测成立,那么受趋化的CD14+细胞所在位置应该与SDF-1表达部位相一致,并且SDF-1表达越高聚集的CD14+细胞越多。而上面两个结果都很好地吻合我们的推测。但是根据这些研究就判定我们前面的推测成立证据尚嫌不足,初步研究结果仅仅提示了这种存在的可能性。SDF-1与CD14+细胞的确切联系还需要进一步的研究。
我们利用免疫组化的半定量和荧光实时定量RT-PCR技术从两方面证实,OIR模型中视网膜SDF-1的表达水平较正常老鼠明显增加。对于其调控、应答机制的进一步研究,及其视网膜玻璃体浓度对比的动态变化研究,都有助于阐明视网膜新生血管性疾病的发病机制。
[1] 王 晔,邓宇斌,李 燕,等.绿色荧光蛋白标记的骨髓间充质干细胞在脑缺血大鼠体内迁移的实验研究[J].中国病理生理杂志,2009,25(3):519-524.
[2] Ceradini DJ, Kulkarni AR, Callaghan MJ, et al. Progenitor cell trafficking is regulated by hypoxic gradients through HIF-1 induction of SDF-1[J]. Nat Med, 2004,10(8):858-864.
[3] Zemani F, Silvestre JS, Fauvel-Lafeve F, et al.Exvivopriming of endothelial progenitor cells with SDF-1 before transplantation could increase their proangiogenic potential[J]. Arterioscler Thromb Vasc Biol, 2008,28(4):644-650.
[4] Yin Y, Zhao X, Fang Y, et al. SDF-1alpha involved in mobilization and recruitment of endothelial progenitor cells after arterial injury in mice[J]. Cardiovasc Pathol, 2010,19(4):218-227.
[5] Rehman J, Li J, Orschell CM, et al. Peripheral blood“endothelial progenitor cells” are derived from monocyte/macrophages and secrete angiogenic growth factors[J]. Circulation, 2003,107(8):1164-1169.
[6] Gulati R, Jevremovic D, Peterson TE, et al. Diverse origin and function of cells with endothelial phenotype obtained from adult human blood[J]. Circ Res, 2003,93(11):1023-1025.
[7] Romagnani P, Annunziato F, Liotta F, et al. CD14+CD34lowcells with stem cell phenotypic and functional features are the major source of circulating endothelial progenitors[J]. Circ Res, 2005,97(4):314-322.
[8] Anghelina M, Krishnan P, Moldovan L, et al. Monocytes/macrophages cooperate with progenitor cells during neovascularization and tissue repair: conversion of cell columns into fibrovascular bundles[J]. Am J Pathol, 2006,168(2):529-541.
[9] Anghelina M, Krishnan P, Moldovan L, et al. Monocytes and macrophages form branched cell columns in matrigel: implications for a role in neovascularization[J]. Stem Cells Dev, 2004,13(6):665-676.
[10]Suh W, Kim KL, Kim JM, et al. Transplantation of endothelial progenitor cells accelerates dermal wound healing with increased recruitment of monocytes/macrophages and neovascularization[J]. Stem Cells, 2005,23(10):1571-1578.
[11]Apte RS. Regulation of angiogenesis by macrophages[J]. Adv Exp Med Biol, 2010,664:15-19.
[12]Bleul CC, Fuhlbrigge RC, Casasnovas JM, et al. A highly efficacious lymphocyte chemoattractant, stromal cell-derived factor 1 (SDF-1)[J]. J Exp Med, 1996,184(3):1101-1109.
[13]Aiuti A, Webb IJ, Bleul C, et al. The chemokine SDF-1 is a chemoattractant for human CD34+hematopoietic progenitor cells and provides a new mechanism to explain the mobilization of CD34+progenitors to peripheral blood[J]. J Exp Med, 1997,185(1):111-120.
[14]Butler JM, Guthrie SM, Koc M, et al. SDF-1 is both necessary and sufficient to promote proliferative retinopathy[J]. J Clin Invest, 2005,115(1):86-93.
[15]Brooks HL Jr, Caballero S Jr, Newell CK, et al. Vitreous levels of vascular endothelial growth factor and stromal-derived factor 1 in patients with diabetic retinopathy and cystoid macular edema before and after intraocular injection of triamcinolone[J]. Arch Ophthalmol, 2004,122(12):1801-1807.
[16]Meleth AD, Agron E, Chan CC, et al. Serum inflammatory markers in diabetic retinopathy[J]. Invest Ophthalmol Vis Sci, 2005,46(11):4295-4301.
[17]De Falco E, Porcelli D, Torella AR, et al. SDF-1 involvement in endothelial phenotype and ischemia-induced recruitment of bone marrow progenitor cells[J]. Blood, 2004,104(12):3472-3482.
[18]Moldovan L, Moldovan NI. Role of monocytes and macrophages in angiogenesis[J]. EXS, 2005,94:127-146.
Expressionofstromalcell-derivedfactor1inretinaswithoxygen-inducedretinalneovascularization
YUAN Fei, CHEN Xiang-wu
(DepartmentofOphthalmology,ZhongshanHospital,FudanUniversity,Shanghai200032,China.E-mail:yuanfei07@yahoo.cn)
AIM: To observe the expression of stromal cell-derived factor 1(SDF-1) in oxygen-induced retinopathy (OIR) model.METHODSThirty C57BL/6J newborn mice were randomly divided into 2 groups: 15 mice in oxygen-induced group were exposed to 75% oxygen for 5 days and to room air for another 5 days to establish the model of OIR, and the other 15 mice were kept in room air as control group. The mRNA expression of SDF-1 was determined by real-time RT-PCR. Retinal proteins of SDF-1 and CD14 were determined by immunohistochemistry.RESULTSThe numbers of the endotheliocyte nuclei in new vessels extending from retina to vitrous were lower in control group than that in oxygen-induced group (P<0.01). Positive immunohistochemical staining for SDF-1 and CD14 was found in both group, and significant differences of SDF-1 and CD14 between oxygen-induced group and control group (bothP<0.01) were observed. A strong correlation of retinal content of CD14 with the expression of SDF-1 was found (r=0.898,P<0.01). The difference of SDF-1 mRNA expression between oxygen-induced group and control group (P<0.01) was significant.CONCLUSIONThe expression of SDF-1 is increased in the retinas of OIR mice. Involvement of CD14+cells is a possible mechanism of SDF-1 in promoting neovascularization.
Models, oxygen-induced retinal neovascularization; Stromal cell-derived factor 1; CD14
R363
A
10.3969/j.issn.1000-4718.2011.01.027
1000-4718(2011)01-0139-06
2010-09-19
2010-11-11
上海市科学技术委员会科研计划资助项目 (No.074119510)
△通讯作者 Tel:021-64041990; E-mail:15921292463@qq.com
