槲皮素抑制鱼藤酮诱导的PC12细胞凋亡*
2011-10-24朱丽红王传明梁嫣然陶恩祥
毕 伟, 朱丽红, 王传明, 梁嫣然, 陶恩祥△
(1中山大学孙逸仙纪念医院神经科,广东 广州 510120;2暨南大学医学院病理生理学系,广东 广州 510632)
槲皮素抑制鱼藤酮诱导的PC12细胞凋亡*
毕 伟1▲, 朱丽红2▲, 王传明1, 梁嫣然1, 陶恩祥1△
(1中山大学孙逸仙纪念医院神经科,广东 广州 510120;2暨南大学医学院病理生理学系,广东 广州 510632)
目的探讨槲皮素对鱼藤酮诱导的PC12细胞凋亡的影响及其作用机制。方法运用鱼藤酮诱导损伤PC12细胞,经300 μmol/L槲皮素预处理后,观察细胞形态学改变,流式细胞术检测细胞凋亡率,Western blotting检测Bax和Bcl-2蛋白的表达,JC-1染色检测细胞线粒体膜电位,比较各组的差异。结果与鱼藤酮组相比,槲皮素加鱼藤酮处理组细胞形态明显改善,凋亡率降至6.3%(P<0.01),Bcl-2表达增加(P<0.01),Bax表达降低(P<0.01),线粒体膜电位上升(P<0.01)。结论槲皮素对鱼藤酮诱导的PC12细胞凋亡具有抑制作用,上调Bcl-2和下调Bax蛋白的表达,维持线粒体膜电位可能是其作用的机制之一。
槲皮素; 鱼藤酮; 细胞凋亡; PC12细胞; 帕金森病
帕金森病(Parkinson disease,PD)是中老年最常见的神经系统变性疾病之一,在60岁以上人群中患病率高达1%,PD病理上表现为黑质多巴胺神经元变性、丢失,胶质增生,胞浆内出现特征性嗜酸性包涵体即路易体(Lewy body,LB)[1]。大量研究显示,雌激素在维持黑质纹状体DA系统的功能完整中发挥重要作用[2,3]。但是雌激素有增加女性患子宫内膜癌和乳腺癌的风险,因而限制了它的临床应用。槲皮素与己烯雌酚相似而具有雌性激素样作用,是植物类雌激素,且不会增加女性患子宫内膜癌和乳腺癌的风险[4,5]。那么该药能否代替雌激素对PD黑质神经元发挥保护作用尚缺乏研究。本研究采用鱼藤酮诱导PC12细胞凋亡模型,观察槲皮素对神经元凋亡的抑制作用,以及槲皮素抑制凋亡的可能细胞内分子机制。
材 料 和 方 法
1材料
大鼠嗜铬细胞瘤PC12细胞((已经由神经生长因子诱导分化)购自中国科学院细胞库。细胞培养基DMEM-F12为Hyclone产品,胎牛血清为TBD产品。槲皮素(纯度﹥98%)、鱼藤酮、胰酶、MTT、碘化丙啶(propidium iodide,PI)及核染料4’,6-二脒基-2-苯基吲哚(Dapi)为Sigma产品。Annexin V-FITC凋亡检测试剂盒为Beckman Coulter产品。B 细胞淋巴瘤/白血病-2蛋白(B-cell lymphoma/leukemia-2,Bcl-2)、Bcl-2 相关X蛋白(Bcl-2 associated X protein,Bax)Ⅰ 抗为Cell Signaling Technology产品。5,5’,6,6’-tetrachloro-1,1’,3,3’-tetraethylbenzim-idazolylcarbocyanine iodide (JC-1) 检测试剂盒为Molecular Probe产品。荧光倒置显微镜为Olympus产品,FACSCalibur流式细胞仪为Becton Dickinson产品。
2方法
2.1PC12细胞培养方法 大鼠嗜铬细胞瘤PC12细胞培养于含10%胎牛血清的DMEM-F12培养液中,置37 ℃、5%CO2培养箱内培养,取对数生长期细胞进行实验。
2.2实验分组和给药方法 设立4个组:空白对照组:鱼藤酮组(1.6 μmol/L)、单纯槲皮素处理组(300 μmol/L)、槲皮素加鱼藤酮处理组。
空白对照组:细胞培养基中不加入任何药物。鱼藤酮组:细胞培养基中加入鱼藤酮孵育24 h。单纯槲皮素处理组:细胞培养基中加入槲皮素孵育24 h。槲皮素加鱼藤酮处理组:细胞培养基中加入槲皮素预处理2 h后,加入鱼藤酮,二者共同孵育24 h。
2.3PC12细胞凋亡形态学的观察 将PC12细胞接种于6孔板内的盖玻片,待细胞贴壁生长24 h后,各实验组给以不同因素处理24 h。小心弃去上清,加入PBS清洗3次,加入新鲜配制的 4%多聚甲醛室温固定20 min,PBS清洗3次,加Dapi染液室温避光染色3 min(Dapi 1 mg/L),用封片液(20 mmol/L 柠檬酸,50 mmol/L磷酸氢二钠,50%甘油,pH 5.5)封片后荧光显微镜下观察并摄片。
2.4Annexin V/PI流式细胞分析法检测细胞凋亡 每组3孔合并后按文献方法进行[6]。用0.25%的胰酶消化细胞,悬浮于无血清DMEM-F12中,4 ℃、1 000 r/min 离心5 min,预冷PBS洗1次,重悬400目筛网过滤,计数。调整细胞密度为1×109cells/L,取100 μL细胞悬液加入5 μL Annexin V-FITC(20 mg/L)和2.5 μL PI(250 mg/L),轻轻混匀,避光冰上放置15 min,加入400 μL预冷1×binding buffer轻轻振荡,转至流式细胞仪检测管,30 min内完成检测。
2.5Western blotting 检测Bax、Bcl-2的表达 收集细胞,提取细胞总蛋白,用Bradford法测定含量,8%聚丙烯酰胺凝胶电泳分离并转膜,室温封闭2 h,Ⅰ抗4 ℃孵育(Bax、Bcl-2的抗体稀释浓度均为1∶1 000)过夜,Ⅱ抗室温孵育2 h,显影,凝胶成像仪照相并分析蛋白条带灰度值。
2.6JC-1染色检测细胞线粒体膜电位 经药物处理24 h后,6孔板每孔加200 μL JC-1(10 mg/L),37 ℃、5%CO2培养箱中孵育15 min。37℃ DMEM-F12清洗2次,再用37 ℃ PBS清洗1次,用不含EDTA的胰酶消化收集细胞。室温、1 500 r/min 离心2 min,样品缓冲液重悬细胞,上流式细胞仪检测。以发射波长590 nm红色荧光值与530 nm绿色荧光值百分比表示线粒体膜电位。
3统计学处理
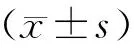
结 果
1细胞凋亡的形态学观察
经Dapi染色,空白对照组可见细胞核出现弥漫均匀的低强度荧光,见图 1A;1.6 μmol/L鱼藤酮作用PC12细胞24 h后,出现大量的细胞核呈浓染致密的固缩形态或是颗粒状荧光的凋亡细胞,见图1B;300 μmol/L槲皮素和鱼藤酮同时处理时,呈固缩状态的细胞核数明显减少,大部分细胞染色质呈均匀的低密度蓝光,见图 1C,提示槲皮素可明显减轻鱼藤酮诱导PC12细胞的凋亡作用。
2流式细胞仪检测细胞凋亡
正常活细胞Annexin V及PI均低染,分布于流式细胞分析图的左下区(LL);早期凋亡细胞Annexin V高染而PI低染,分布于图的右下区(RL);晚期凋亡或死亡细胞Annexin V及PI均高染,分布于图的右上区(RU),见图 2;将早期凋亡细胞百分数和晚期凋亡细胞百分数总和称为总凋亡率。结果显示,空白对照组及单纯槲皮素处理组仅有少量凋亡细胞,分别为3.6%±1.7%和4.6%±2.2%。鱼藤酮组可见较多的凋亡细胞24.7%±3.3%,较空白对照组明显增多(n=3,P<0.01)。槲皮素加鱼藤酮处理组可见散在的凋亡细胞6.3%±1.9%,较鱼藤酮组明显减少(n=3,P<0.01)。提示槲皮素可降低鱼藤酮诱导的PC12细胞凋亡。
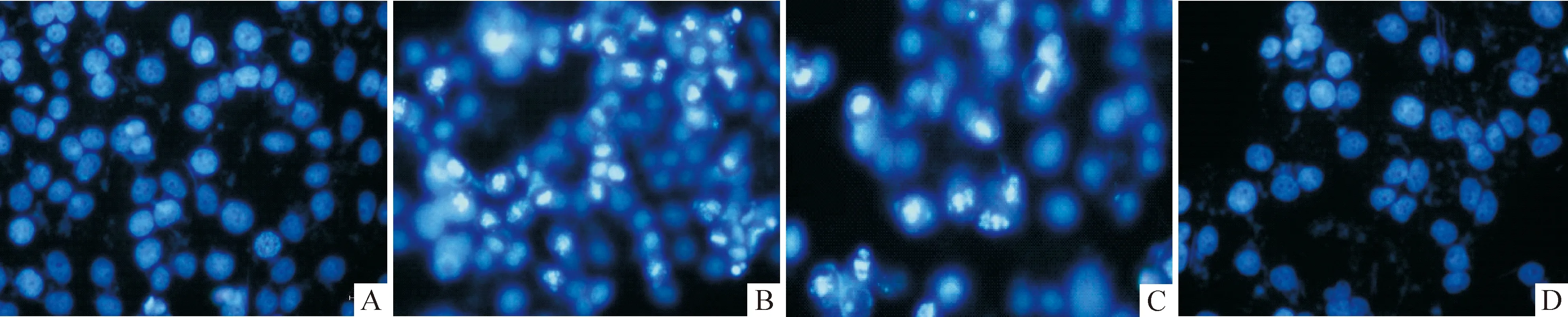
Figure 1. Effect of quercetin on apoptosis induced by rotenone in PC12 cells (×200). A: control; B: rotenone (1.6 μmol/L); C: rotenone (1.6 μmol/L)+ quercetin (300 μmol/L); D:quercetin (300 μmol/L).
图1槲皮素对鱼藤酮诱导PC12细胞凋亡形态的影响

Figure 2. FACS analysis of annexin V/PI in apoptotic cells. A: control; B: rotenone (1.6 μmol/L); C: rotenone (1.6 μmol/L)+ quercetin (300 μmol/L); D:quercetin (300 μmol/L).
图2AnnexinV/PI流式细胞仪检测细胞凋亡
3Westernblotting检测Bax、Bcl-2蛋白表达情况
图3所示,鱼藤酮诱导损伤后Bcl-2的表达下降,Bax的表达增加,与之相比,槲皮素加鱼藤酮处理组Bcl-2的表达明显增加,Bax的表达明显减少(P<0.01)。结果表明槲皮素对抗鱼藤酮诱导的凋亡与调节凋亡相关蛋白的表达有关。

图3Westernblotting检测Bax、Bcl-2蛋白表达
4线粒体膜电位的检测
线粒体亲脂性阳离子染料JC-1特异性地进入线粒体,分布和结合在线粒体基质上,线粒体膜电位的高低变化决定了JC-1的分布浓度。药物作用24 h后,检测PC12细胞胞内线粒体膜电位的改变。结果显示, 1.6 μmol/L鱼藤酮处理组可明显降低线粒体膜电位,红/绿荧光强度比值下降(P<0.01);槲皮素加鱼藤酮处理组红/绿荧光强度比值较鱼藤酮处理组明显增加(P<0.01),提示槲皮素可一定程度上逆转鱼藤酮诱导的线粒体膜电位减低。单纯槲皮素处理组红/绿荧光强度比值与空白对照组差异不显著(P>0.05),见图4。


图4槲皮素对PC12细胞线粒体膜电位的影响
讨 论
近年来大量研究发现,细胞凋亡可能在PD的黑质多巴胺能神经元死亡中起重要作用[7,8]。不同类型的环境毒素或(和)遗传变异可分别诱发氧化应激,α-突触核蛋白的异常折叠聚集及小胶质细胞激活等,每个因素都可能成为启动因子,并诱发其它因素的损害机制[9]。这种相互协同作用形成了不断加强的“正反馈”效应,使原本单一因素的损害作用在多巴胺神经元内被不断扩大。这可能是多巴胺神经元选择性和进行性丢失的关键因素,而细胞凋亡则是其主要形式[10]。
Bcl-2蛋白家族与PD细胞凋亡密切相关。目前研究发现神经细胞的抗凋亡基因bcl-2、bcl-xl的启动子区含有雌激素受体反应元件,雌激素可使Bcl-2表达的蛋白量升高,使1-甲基-4-苯基-1,2,3,6-四氢吡啶(MPTP)小鼠模型中脑黑质TH阳性神经元数目增加,凋亡细胞数目减少[11]。过表达Bcl-2可以通过拮抗Bax的激活、减少活性氧片段生成,从而阻止多巴胺诱导的凋亡[12]。罗蔓等[13]研究发现雌激素主要通过与Bcl-2家族蛋白的作用,上调Bcl-2蛋白与下调Bax蛋白的表达来实现其细胞保护作用。Ishikawa等[14,15]认为,对于多种类型的正常细胞来说,槲皮素都有阻止其细胞凋亡发生的效应。
槲皮素是一种天然黄酮类化合物,广泛分布于自然界各种植物的花、叶、果实之中,本实验应用Dapi染色法观察到,槲皮素可明显减少呈固缩状态的细胞核,大部分细胞染色质呈均匀的低密度蓝光。经Annexin V/PI流式细胞分析法,观察到槲皮素可以明显地抑制鱼藤酮诱导的PC12细胞凋亡。Western blotting检测Bax、Bcl-2蛋白经槲皮素作用后的表达情况,结果显示槲皮素通过下调Bax蛋白与上调Bcl-2蛋白的表达来实现其细胞保护作用。
凋亡信号从最初产生到细胞形态学变化及DNA片段化的产生需经历一定时间,而线粒体跨膜电位丢失是凋亡程序中一个极早期的事件。Bcl-2蛋白家族作用于线粒体渗透性转换(permeability transitionpore,PT)孔,通过改变线粒体膜的通透性来调节PD细胞凋亡。线粒体PT孔和线粒体内致凋亡的多种蛋白释放均受Bcl-2家族调控。因此,我们应用线粒体亲脂性阳离子染料JC-1观察药物作用24 h后,PC12细胞胞内线粒体膜电位的改变。结果提示,槲皮素可一定程度上逆转鱼藤酮诱导的线粒体膜电位下降。
本实验结果表明,槲皮素对PD具有保护作用,我们推测槲皮素可能通过与Bcl-2家族蛋白的作用,上调Bcl-2蛋白与下调Bax蛋白的表达来维持线粒体结构和功能的稳定性,发挥细胞凋亡主开关的作用。因此,若能进一步明确槲皮素对PD保护作用的机制,将有助于指导新型抗PD药物的开发。
[1] Nutt JG,Wooten GF.Diagnosis and initial management of Parkinson’s disease[J].N Engl J Med,2005,353(10):1021-1027.
[2] Rodriguez-Perez AI,Valenzuela R, Villar-Cheda B,et al. Estrogen and angiotensin interaction in the substantia nigra. Relevance to postmenopausal Parkinson’s disease[J].Exp Neurol,2010,224(2):517-526.
[3] 陈 伟,谢瑞满.雌激素和帕金森病[J].国际中华应用心理学杂志,2006,3(1):67-69.
[4] Saunders PR,Gordon EJ,Parides M,et al.The effect of estrogen replacement on early Parkinson’s disease[J].Neurology,1999,52(7):1417-1421.
[5] Jagtap S, Meganathan K, Wagh V, et al. Chemoprotective mechanism of the natural compounds, epigallocatechin-3-O-gallate, quercetin and curcumin against cancer and cardiovascular diseases[J]. Curr Med Chem,2009,16(12):1451-1462.
[6] 范常龙,栾 彦,陈 燕,等.氯唑沙腙对抗HepG2肿瘤细胞的作用研究[J].中国药理学通报,2007,23(9):1198-1202.
[7] Radad K,Gille G,Rausch WD,et al.Dopaminergic neurons are preferentially sensitive to long-term rotenone toxicity in primary cell culture[J].ToxicolInVitro,2008,22(1):68-74.
[8] Mather AA,Cox BJ,Enns MW,et al.Associations between body weight and personality disorders in a nationally representative sample[J].Psychosom Med,2008,70(9):1012-1019.
[9] 陶恩祥,张国华,徐 杰,等.利福平对鱼藤酮处理的大鼠多巴胺神经元的保护作用[J].中国病理生理杂志,2008,24(9):1751-1756.
[10]Burke RE,Kholodilov NG.Programmed cell death:does it play a role in Parkinson’s disease?[J].Ann Neurol,1998,44(3 Suppl 1):S126-S133.
[11]Subramanian M,Shaha C.Oestrogen modulates human macrophage apoptosis via differential signaling through oestrogen receptor-alpha and beta[J].J Cell Mol Med,2009,13(8B):2317-2329.
[12]Lud Cadet J,Harrington B,Ordonez S,et al.Bcl-2 overexpression attenuates dopamine-induced apoptosis in an immortalized neural cell line by suppressing the production of reactive oxygen species[J].Synapse,2000,35(3):228-233.
[13]罗 蔓,谢瑞满.雌激素减轻β淀粉样蛋白所致PC12细胞毒活性的机制[J].中国老年保健医学,2006,4(3):33-36.
[14]Ishikawa Y, Kitamura M.Bioflavonoid quercetin inhibits mitosis and apoptosis of glomerular cellsinvitroandinvivo[J].Biochem Biophys Res Commun, 2000,279(2):629-634.
[15]Ishikawa Y, Kitamura M.Anti-apoptotic effect of quercetin: intervention in the JNK- and ERK-mediated apoptotic pathways[J].Kidney Int,2000,58(3):1078-1087.
InhibitoryeffectofquercetinonapoptosisofPC12cellsinducedbyrotenone
BI Wei1, ZHU Li-hong2, WANG Chuan-ming1, LIANG Yan-ran1, TAO En-xiang1
(1DepartmentofNeurology,SunYat-senMemorialHospital,SunYat-senUniversity,Guangzhou510120,China;2DepartmentofPathophysiology,SchoolofMedicine,JinanUniversity,Guangzhou510632,China.E-mail:taoenxiang@yahoo.com.cn)
AIM: To observe the effects and mechanisms of quercetin on the apoptosis of PC12 cells induced by rotenone.METHODSPC12 cells were used in the study. Quercetin at the concentration of 300 μmol/L was added into the PC12 cells cultured in DMEM-F12 medium with 10% fetal calf serum. The morphological changes of the cells were observed under fluorescence microscope. The apoptotic rate was determined by flow cytometry assay. The protein levels of Bax and Bcl-2 were determined by Western blotting, and the mitochondrial membrane potential was measured by ratiometric probe JC-1.RESULTSIn the cells treated with rotenone+quercetin, the morphology of the cells was significantly improved, and the apoptotic rate was decreased to 6.7%, significantly lower than that in the cells treated with rotenone alone (P<0.01). The expression of Bcl-2 was up-regulated and Bax was down-regulated in rotenone+quercetin group (P<0.01), while the mitochondrial membrane potential was also increased (P<0.01) as compared to those in rotenone group.CONCLUSIONPretreatment of quercetin inhibits the development of apoptosis in PC12 cells induced by rotenone. One of the mechanisms may be correlated with up-regulating the expression of Bcl-2 and down-regulating the expression of Bax, thus maintaining mitochondrial membrane potential.
Quercetin; Rotenone; Apoptosis; PC12 cells; Parkinson disease
R363
A
10.3969/j.issn.1000-4718.2011.01.016
1000-4718(2011)01-0082-04
2010-07-22
2010-10-19
广东省自然科学基金资助项目(No.2005B33801003);教育部高等学校博士学科点专项科研基金资助项目(No.20070558257)
△ 通讯作者Tel:020-81332095; E-mail: taoenxiang@yahoo.com.cn
▲并列第1作者
