P2Y1受体介导Aβ25-35所致大鼠星形胶质细胞活化*
2011-10-24张博爱贾延劼付振强石进峰文全庆赵二义
常 利, 张博爱, 贾延劼, 付振强, 沈 雷, 石进峰, 文全庆, 赵二义
(郑州大学第一附属医院神经内科, 河南 郑州 450052)
P2Y1受体介导Aβ25-35所致大鼠星形胶质细胞活化*
常 利, 张博爱△, 贾延劼, 付振强, 沈 雷, 石进峰, 文全庆, 赵二义
(郑州大学第一附属医院神经内科, 河南 郑州 450052)
目的观察嘌呤受体P2Y1在Aβ25-35所致的大鼠星形胶质细胞活化中所起的作用。方法体外分离培养大鼠星形胶质细胞,按空白对照、Aβ25-35和P2Y1受体阻断剂MRS2179+Aβ25-35和MRS2179分组干预后,通过免疫细胞化学、免疫荧光法和Western blotting方法观察GFAP和P2Y1表达的变化。结果各组细胞数量无明显变化。与对照组相比,Aβ25-35组GFAP荧光强度明显增加;MRS2179+Aβ25-35和MRS2179组均降低,两组间无明显差异。Western blotting显示GFAP在各组间表达与免疫荧光法有相似趋势;与对照组相比,P2Y1表达在Aβ25-35组明显增多(P<0.05)和MRS2179+Aβ25-35和MRS2179组无明显变化(P>0.05)。结论Aβ25-35通过P2Y1受体活化激活星形胶质细胞。
受体,P2Y1; 淀粉样β蛋白; 星形细胞
阿尔茨海默病(Alzheimer disease,AD)是一种以进行性认知障碍和记忆力损害为主的中枢神经系统退行性疾病。星形胶质细胞(astrocyte,AC)是中枢神经系统的免疫吞噬细胞,在致炎因素作用下被激活成反应性AC。反应性AC既具有保护神经元的作用,也能分泌细胞毒因子、炎症因子、补体蛋白而损害神经元。尽管目前其发病机制还不清楚,但大多数学者认为β淀粉样蛋白(amyloid beta, Aβ)Aβ沉积激活AC引起的炎症反应、氧化应激是AD的重要病理机制。嘌呤型受体(purinergic receptor)在1978年首次被Burnstock发现,并分为P1、P2两种亚型。其中P2受体是一类核苷酸受体,分为P2X(离子通道受体)和P2Y(G蛋白偶联受体)。迄今已从人体组织细胞克隆出8种P2Y受体,广泛分布在脑部,执行不同的生理功能。有研究表明,星形胶质细胞表达P2Y1受体,且后者在星形胶质化进程中起重要作用[1]。AD的病理改变之一为老年斑的形成,老年斑的核心成分为 Aβ,在AD发病机制中起到重要作用[2],其主要毒性片段为25-35。Aβ25-35是Aβ中第25-35位氨基酸残基组成的序列,常用于体外神经毒实验的AD模型。早在2000年,Moore等发现在AD患者脑内神经原纤维缠结、神经斑(块)和神经纤维网线等处发现有大量P2Y1受体存在。本实验旨在研究Aβ25-35刺激下星形胶质细胞的变化,并探索P2Y1受体可能的作用。
材 料 和 方 法
1动物
新生24 h内的Wistar大鼠(SPF级),由河南省实验动物中心提供。
2主要试剂和仪器
DMEM(Dulbecco’s modified eagle medium)培养基、胎牛血清购自Gibco。胰蛋白酶、多聚赖氨酸和P2Y1受体阻断剂MRS2179(N6-methyl-2’-deoxyadenosine-3’,5’-bisphosphate )购自Sigma。兔抗大鼠多克隆胶质纤维酸性蛋白(GFAP)抗体和兔抗大鼠多克隆P2Y1抗体和兔抗大鼠β-肌动蛋白抗体(β-actin)购自Santa Cruz。Aβ25-35、辣根过氧化物标记羊抗兔IgG和BCA蛋白浓度测定试剂盒购自北京博奥森公司。预染marker和荧光(Cy3)标记羊抗兔IgG购自碧云天公司。硝酸纤维素(nitrocellulose filter membrane,NC)膜购自PALL。二氨基联苯胺(3,3’-diaminobenzidine, DAB)显色试剂盒购自北京中杉金桥公司。其它生化试剂均为进口分装或国产分析纯。CO2恒温培养箱(Thermo Forma),超净工作台(AIR TECH),倒置相差显微镜、倒置荧光显微镜(Olympus),电泳仪、半干式电转仪、酶标仪(Bio-Rad)。
3方法
3.1大鼠星形胶质细胞的分离、培养和纯化 参照Jagdeep等[3]的方法,略改动。取新生24 h内Wistar大鼠,用75%的乙醇消毒2次,无菌条件下断头取大脑皮层,并置于盛有冰冷PBS液的培养皿内。分离并剥除脑膜、血管等结缔组织后,用冰冷D-Hanks液洗3次,剪碎脑组织(在冰上操作)至1 mm×1 mm×1 mm大小。用0.25%胰蛋白酶溶液消化组织块,在37 ℃、5% CO2培养箱内消化10 min,用胎牛血清终止消化,用细口径吸管反复轻轻吹打成均匀一致的细胞悬液。将制成的细胞悬液1 000 r/min离心5 min后弃上清,共3次,加培养基(DMEM+10%胎牛血清)吹打成均匀的细胞悬液。按5×105/cm2接种于25 cm2培养瓶于37 ℃、5% CO2培养箱中培养,定期换液。约14 d后细胞可铺满瓶底。连续传3代以获取纯化的星形胶质细胞,具体方法参照文献[3]。
3.2实验分组 本研究分为以下4组:(1)空白对照组:加入普通培养基;(2)Aβ25-35组:根据预实验结果,加入5 μmol/L Aβ25-35的培养基;(3)MRS2179+Aβ25-35组:参考Sun等[4]法稍改动。先加入10 μmol/L MRS2179作用45 min,再加入5 μmol/L Aβ25-35; (4)MRS2179组:加入10 μmol/L MRS2179。以上各组均作用24 h。Aβ25-35提前放入37 ℃培养箱24 h凝聚以增强其毒性。
3.3星形胶质细胞的鉴定 将细胞接种于放有多聚赖氨酸处理载玻片的24孔培养板中,在37 ℃、5% CO2饱和湿度细胞培养箱中培养72 h,倒置显微镜观察细胞爬片情况,用4%多聚甲醛固定4 ℃过夜。第2 d取出载玻片,用PBS浸洗3 min×3次。参照免疫组化试剂盒说明书操作,其中GFAP工作效价为1∶100。细胞图像通过显微镜用×10或×20摄取,图像均采用300 dpi分辨率。每组独立的实验都会采集超过40个区域的细胞。而且,在明视野下所采集的每幅图像都尽量包含相同的细胞数目。采用双人双盲随机记数阳性细胞,计算阳性细胞百分比例。
3.4免疫荧光染色 经多聚甲醛固定后的各组细胞,采用免疫荧光染色。基本步骤:0.2% Triton X-100处理10 min,并用10%牛血清白蛋白封闭1 h。然后用GFAP抗体4 ℃孵育24 h。采用Cy3标记山羊抗兔IgG(1∶100)在室温下进行染色。倒置荧光显微镜采集图片。
3.5Western blotting 收集各组细胞,在预冷细胞裂解液[50 mmol/L Tris-HCl(pH 6.8),10 mmol/L EDTA, 2% SDS,5 mmol/L DTT,0.5 mmol/L PMSF]100 μL中裂解、变性、离心。以BSA作为标准,根据Bradford法对蛋白质进行定量分析。蛋白裂解液加入5×凝胶上样缓冲液进行SDS-丙烯酰胺凝胶电泳。电泳后,转移到NC膜上。以含5%脱脂牛奶的TBST室温封闭1 h,然后用相应的抗体(用含5%脱脂牛奶的TBST配制)4 ℃孵育过夜,TBST洗膜3次,每次15 min。再用相应的辣根过氧化物酶标记的IgG(用含5%脱脂牛奶的TBST配制)室温反应1 h,TBST洗膜3次,每次15 min。然后进行ECL反应,并曝光显影。对于相同的实验重复至少3次(n=3)。所得条带采用Quantity One 图像分析软件,分析底片上条带的吸光度值,以同一膜上靶蛋白灰度/β-actin灰度比值作为目的蛋白的相对表达灰度。
4统计学处理
结 果
1大鼠星形胶质细胞的分离和培养
倒置显微镜下,初接种的细胞呈球形,4-6 h后开始贴壁,伸出突起,成片状聚集生长。随着培养时间的延长,细胞体积逐渐增大,突起伸长。原代培养细胞在7-9 d内生长缓慢,之后生长速度显著增快,12-14 d即可铺满全瓶。原代星形胶质细胞可见原浆型与纤维性混合,胞体呈梭形、圆形或多边形,见图1,胞核位于一侧,单核或多核,胞浆丰富,原浆型星形胶质细胞胞体较大,突起多而短,纤维性星形胶质细胞胞体相对较小,但突起较长。传代3次以后,细胞形态趋于一致,以纤维性星形胶质细胞为主。
Figure 1. Primary cultured astrocytes(×100).
图1原代培养的星形胶质细胞2星形胶质细胞的鉴定
GFAP主要表达于胞浆和突起内,胞核显色淡,多呈空泡状,见图2。免疫组化染色阳性细胞统计在95%以上,达到实验要求。

Figure 2. GFAP-positive astrocytes(×200).
图2免疫组化GFAP阳性的星形胶质细胞
3Aβ25-35及P2Y1受体阻断剂(MRS2179)对星形胶质细胞GFAP表达的影响
3.1免疫荧光结果 倒置显微镜下,每个实验组采集20个区域的细胞,采用双人双盲随机记数细胞数。各组每个区域细胞数分别为70.30±2.66,70.20±3.29,69.80±2.35,69.80±2.40,P>0.05。各组细胞数量变化不明显,与对照组相比,Aβ25-35组细胞胞体肥大、突起增多, MRS2179+Aβ25-35组及MRS2179组细胞形态及数量无明显变化。与对照组相比,Aβ25-35组GFAP荧光强度明显增加,MRS2179+Aβ25-35及MRS2179组均减少,2组间无明显差异,见图3。
Figure 3. GFAP-positive astrocytes(Cy3,×100).Compared with the control group,the fluorescence intensity of GFAP significantly increased in Aβ25-35group, and was reduced in MRS2179+ Aβ25-35and MRS2179 groups by immunofluorescence.A:control; B:Aβ25-35;C:MRS2179+Aβ25-35;D:MRS2179.
图3GFAP阳性星形胶质细胞
3.2Western blotting结果 各组细胞干预24 h后提取蛋白,检测GFAP、P2Y1表达变化。与对照组相比,Aβ25-35组GFAP、P2Y1表达明显增多(P<0.05);MRS2179+Aβ25-35组及MRS2179组GFAP表达显著减少(P<0.05),2组间无明显差异(P>0.05),2组P2Y1表达与对照组无明显差异(P>0.05),见图4、5。
Figure 4. Western blotting assay for GFAP and P2Y1protein expression.
图4Westernblotting检测GFAP和P2Y1蛋白表达结果
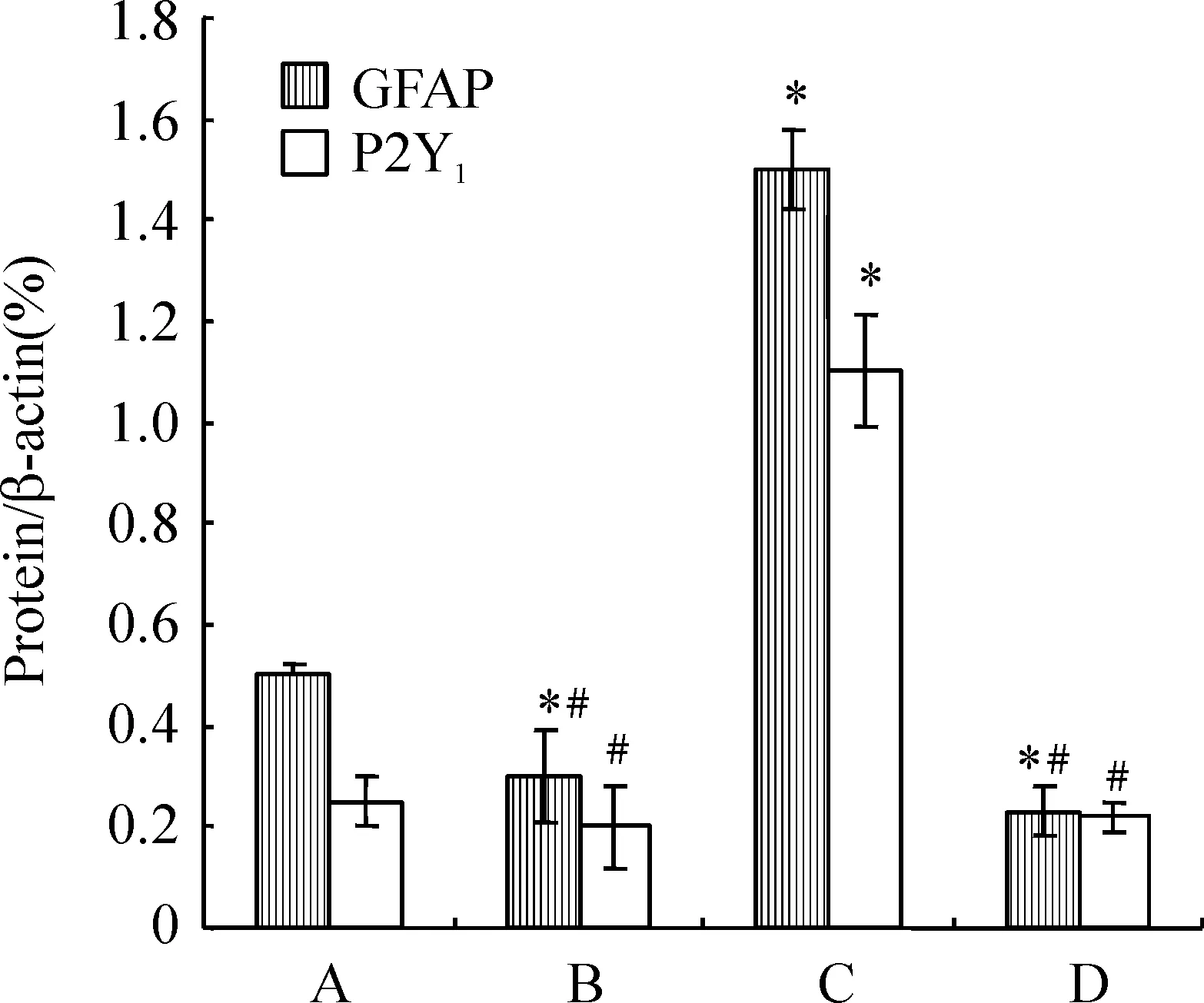
图5目的蛋白与内参照相对吸光度比值
讨 论
1Aβ与星形胶质化
近年来,星形胶质细胞在整个神经网络的功能日益受到重视。星形胶质细胞是具有多种效应和功能状态的细胞,正常情况下,星形胶质细胞处于静息状态,对外界环境刺激敏感、迅速做出反应性变化是其显著特点之一。当中枢神经系统遭遇炎症、缺血、损伤时,星形胶质细胞将会出现形态和功能的改变,称为“反应性星形胶质化”。最近,通过综合大量的实验结果,Sofroniew[5]给出以下定义,包括4个主要特点:(1)反应性星形胶质化是星形胶质细胞对CNS所有形式和严重性损伤和疾病做出的分子、细胞、功能方面的变化,包括极微小的病变;(2)这种变化涵盖了分子表达、细胞肥大、增殖和胶质瘢痕形成等一系列改变,依据损伤程度而定;(3)这种变化由胞内外特定的信号分子调节;(4)这种变化将通过获得或丧失某些功能改变星形胶质细胞的活性,从而给周围的神经或非神经细胞带来有益或有害的影响。研究表明,反应性星形胶质化时GFAP的表达水平是增加的,伴有星形胶质细胞谷氨酸盐转运蛋白表达下降,增加了局部神经元对兴奋性毒性的易损性[6]。上述研究表明星形胶质细胞对中枢神经系统损伤反应极其敏感,程度依损伤性质、程度而定。因此,探明星形胶质细胞活化时相关分子机制、信号通路显得尤为重要。
作为AD老年斑的主要成分,Aβ常用来制作体外神经毒模型。不过以往的研究多集中在神经元,胶质细胞研究得不多。在AD,人体和动物模型研究表明,衰老斑周围的星形胶质细胞在Aβ的沉积和清除方面可能起着决定性作用[7],且有研究Aβ42在星形胶质细胞内蓄积,且活化星形胶质细胞内的Aβ42的含量与AD局部病理的严重程度相关[8]。这提示Aβ有可能直接而非间接作用于星形胶质细胞,引起相应的病理生理改变。
本实验用Aβ25-35作用于星形胶质细胞,肉眼观察细胞数量无明显变化,免疫荧光可见GFAP表达明显增多,Western blotting GFAP表达有相似趋势,表明Aβ25-35可以激活星形胶质细胞,与报道相符。
有研究显示应用Aβ后体外培养的星形胶质细胞内钙升高,但却不致细胞死亡[9],这说明Aβ的沉积可能会催化星形胶质细胞胞内外信号转导。在体实验还发现,AD小鼠脑内星形胶质细胞网络静息钙水平明显升高[10]。在皮层或海马星形胶质细胞和神经元共培养中发现,Aβ作用于星形胶质细胞,通过增加星形胶质细胞[Ca2+]c,Aβ激活NOX(NADPH氧化酶),产生氧化性应激,导致神经元死亡[11]。另外有数据显示,Aβ通过降低GLAST(谷氨酸-天冬氨酸转运蛋白)和GLT-1(谷氨酸盐转运蛋白-1)的水平和活性,以非竞争性抑制的方式降低体外培养星形胶质细胞对谷氨酸盐的吸收。这种对谷氨酸盐转运功能的广泛抑制可能部分通过ERK、JNK、p38信号转导通路活性的改变来调节,这一过程被Aβ介导的氧化应激所触发[12]。
2P2Y1受体与星形胶质化
P2Y1受体表达于星形胶质细胞表面,参与调节星形胶质细胞钙信号传播[13],有报道称其还参与痛觉的产生和持续。研究表明,当中脑动脉闭塞、皮质及伏核穿刺损伤时,星形胶质细胞活化,P2Y1受体表达升高[1];且P2Y1受体在戳伤时表达增加,P2Y1受体激动剂ADP-βS可增加星形胶质细胞P2Y1受体和GFAP的表达,P2Y1受体阻断剂MRS2179和P2Y1受体抗体可抑制激动剂介导的增殖效应[1]。说明P2Y1受体与GFAP的表达可能有相关性。基于此,本实验拟探讨P2Y1受体在星形胶质细胞活化中的作用。
本实验中,与对照组相比,Aβ25-35组GFAP表达明显增多,说明Aβ25-35可使星形胶质细胞活化,但被MRS2179阻断后GFAP表达减少,说明GFAP的表达与P2Y1相关;Western blotting显示Aβ25-35组P2Y1表达增多,其余2组P2Y1表达与对照组相比无差异,证实Aβ25-35通过活化P2Y1受体进而激活星形胶质细胞。
电生理及分子生物学技术发现,ATP、ADP、ADP-βs激活星形胶质细胞P2Y1受体,后者可与G蛋白偶联,激活磷脂酶C,水解磷脂酰肌醇,生成IP3(1,4,5-三磷酸肌醇)和DAG(二酰基甘油),胞内IP3含量升高,与内质网膜上IP3受体结合,引起Ca2+从内质网钙库释放,细胞[Ca2+]i迅速升高,诱发胞内多种信号转导途径[14],另一方面促进ATP从胶质细胞释放,再激活邻近胶质细胞P2Y受体,引起钙波远距离扩散。且P2Y1受体C末端Thr339(苏氨酸)与蛋白激酶C(PKC)相互作用是钙波产生的重要环节之一。
P2Y1受体通路的活化可致星形胶质细胞谷氨酸盐释放,进而调节星形胶质细胞-神经元间相互作用和增加体外培养的背侧角神经元兴奋性[15]。另外,缺血情况下P2Y1受体通过JAK2/STAT3信号通路及下游区的Ras/ERK信号通路导致星形胶质细胞GFAP表达下降,从而干扰星形胶质化[4]。
综上所述,本研究提示,Aβ25-35可使星形胶质细胞P2Y1受体活化,进而激活星形胶质细胞,具体信号通路有待进一步研究。因此,进一步认识星形胶质细胞及P2Y1受体功能,特别是其特定信号转导途径以及开发高度特异性的受体亚型激动剂和拮抗剂,对我们研究神经系统疾病尤其是变性病的发生机制有重要意义,并可能为这类疾病的处理提供新的治疗思路。
[1] Franke H, Krugel U, Grosche I, et al.P2Y receptor expression on astrocytes in the nucleus accumbens of rats[J].Neuroscience,2004,127(2):431-441.
[2] 孙志坤,潘 静,杨红旗,等.PI3K/Akt途径在Aβ诱导细胞凋亡过程中的作用[J].中国病理生理杂志,2009,25(1):84-88.
[3] Jagdeep KS, Mossa G, Rafal I, et al. Astrocyte-secreted GDNF and glutathione antioxidant system protect neurons against 6OHDA cytotoxicity[J].Neurobiol Dis, 2009, 33(3):405-414.
[4] Sun JJ, Liu Y, Ye ZR. Effects of P2Y1receptor on glial fibrillary acidic protein and glial cell line-derived neurotrophic factor production of astrocytes under ischemic condition and the related signaling pathways[J]. Neurosci Bull, 2008, 24(4): 231-243.
[5] Sofroniew MV.Molecular dissection of reactive astrogliosis and glial scar formation[J]. Trends Neurosci, 2009, 32(12):638-647.
[6] Simpson JE, Ince PG, Lace G, et al. Astrocyte phenotype in relation to Alzheimer-type pathology in the ageing brain[J].Neurobiol Aging,2010,31(4):578-590.
[7] Maragakis NJ, Rothstein JD. Mechanisms of disease: astrocytes in neurodegenerative disease[J]. Nat Clin Pract Neurol, 2006,2(12):679-689.
[8] Robert GN, Jerzy W, Venkat V, et, al. Contribution of glial cells to the development of amyloid plaques in Alzheimer’s disease[J]. Neurobiol Aging,2004, 25(5):663-674.
[9] Abramov AY, Canevari L, Duchen MR.Changes in intracellular calcium and glutathione in astrocytes as the primary mechanism of amyloid neurotoxicity[J].J Neurosci, 2003,23(12):5088-5095.
[10]Kuchibhotla KV, Lattarulo CR, Hyman BT,et al.Synchronous hyperactivity and intercellular calcium waves in astrocytes in Alzheimer mice[J]. Science,2009, 323(5918):1211-1215.
[11]Abramov AY, Duchen MR. The role of an astrocytic NADPH oxidase in the neurotoxicity of amyloid beta peptides[J]. Philos Trans R Soc Lond B Biol Sci, 2005, 360(1464): 2309-2314.
[12]Matos M, Augusto E, Oliveira CR, et al. Amyloid-beta peptide decreases glutamate uptake in cultured astrocytes: Involvement of oxidative stress and mitogen-activated protein kinase cascades[J]. Neuroscience, 2008, 156(4): 898-910.
[13]曾俊伟,阮怀珍. 神经系统P2Y受体功能研究进展[J]. 神经解剖学杂志,2008,24(1):101-104.
[14]曾俊伟,刘晓红,阮怀珍.ATP通过P2Y1受体引发脊髓背角星形胶质细胞[Ca2+]i升高和GFAP表达上调[J].免疫学杂志,2008,24(2):150-154.
[15]Zeng JW, Liu XH, Zhao YD, et al. Role of P2Y1receptor in astroglia-to-neuron signaling at dorsal spinal cord[J]. J Neurosci Res, 2009, 87(12):2667-2676.
RoleofP2Y1receptorinactivationofastrocytesinducedbyAβ25-35
CHANG Li, ZHANG Bo-ai, JIA Yan-jie, FU Zhen-qiang, SHEN Lei, SHI Jin-feng, WEN Quan-qing, ZHAO Er-yi
(DepartmentofNeurology,TheFirstAffiliatedHospital,ZhengzhouUniversity,Zhengzhou450052,China.E-mail:zhangboaidoctor@163.com)
AIM: To study the role of P2Y1receptor in the activation of astrocytes induced by Aβ25-35.METHODSAstrocytes were isolated and cultured from newborn Wistar rats and divided into control group, Aβ25-35group, MRS2179(P2Y1receptor inhibitor)+Aβ25-35group and MRS2179 group by treating the cells with the corresponding reagents. The expression levels of GFAP and P2Y1were determined by the methods of immunohistochemistry, immunofluorescence and Western blotting.RESULTSNo significant change of the astrocyte numbers in all groups was observed. Compared with the control cells, the fluorescence intensity of GFAP significantly increased in Aβ25-35group and decreased in both MRS2179+Aβ25-35group and MRS2179 group. The expression level of GFAP determined by Western blotting and immunofluorescence showed the similar trend of change in each group. Compared with control group, the expression of P2Y1in Aβ25-35group was significantly increased (P<0.05), and no significant change between MRS2179+Aβ25-35group and MRS2179 group was found (P>0.05).CONCLUSIONAβ25-35activates astrocytes by activation of P2Y1receptor.
Receptors, P2Y1; Amyloid beta-protein; Astrocytes
R741.02
A
10.3969/j.issn.1000-4718.2011.01.013
1000-4718(2011)01-0067-05
2010-06-04
2010-11-23
国家自然科学基金资助项目(No.30770758)
△通讯作者 Tel:0371-66295112; E-mail:zhangboaidoctor@163.com
