5-羟基癸酸盐对慢性低氧大鼠肺动脉Kv1.5通道表达的影响*
2011-10-24张丽萍李云雷陈成水
李 秋, 张丽萍, 舒 鹰, 李云雷, 陈成水
(温州医学院附属第一医院呼吸内科, 浙江 温州 325000)
5-羟基癸酸盐对慢性低氧大鼠肺动脉Kv1.5通道表达的影响*
李 秋, 张丽萍, 舒 鹰, 李云雷, 陈成水△
(温州医学院附属第一医院呼吸内科, 浙江 温州 325000)
目的以大鼠为研究对象,研究线粒体ATP敏感性钾通道(mitoKATP)的抑制剂5-羟基癸酸盐(5-HD)对慢性低氧肺动脉高压大鼠的影响及其潜在机制。方法24只SD雄性大鼠随机分成对照组、低氧组、低氧+5-羟基癸酸盐干预组,每组8只。将低氧组和5-HD干预组大鼠放入常压低氧舱内[O2(10.0%±0.3%)]以建立低氧肺动脉高压模型。 4周后测定平均肺动脉压(mPAP)及右心室与左心室及室间隔的重量比[RV/(LV+S)],并采用RT-PCR及Western blotting技术,分析各组肺动脉Kv1.5 mRNA及蛋白表达。结果(1) 慢性低氧组大鼠的mPAP及RV/(LV+S)显著高于正常对照组(P<0.05),5-HD干预组mPAP及RV/(LV+S)显著低于低氧组,均P<0.05。(2) 低氧组Kv1.5通道mRNA及蛋白表达显著低于正常组,5-HD组Kv1.5通道表达显著高于低氧组, 均P<0.05。结论mitoKATP通道的抑制剂5-HD通过降低mPAP及RV/(LV+S),在慢性低氧肺动脉高压中起保护作用。mitoKATP通道的抑制及Kv1.5通道表达的上调可能与该保护作用有关。
5-羟基癸酸盐; Kv1.5通道; 线粒体ATP敏感性钾通道; 大鼠
低氧刺激后,肺循环发生低氧性肺血管收缩反应(hypoxic pulmonary vasoconstriction,HPV),是肺血管独有的生理现象。虽然这将有利于血液进入灌注好的肺血管、维持通气血流比平衡。但是,持续HPV会导致肺泡长期缺氧,从而引起肺血管重构、肺动脉高压最终因右心衰致死亡率增加。近年来线粒体ATP 敏感性钾通道(mitochondrial ATP-sensitive K channe1,mitoKATP)在低氧肺动脉高压中的作用已被逐渐认识。研究表明mitoKATP参与并影响了低氧肺动脉高压的发生与发展[1]。另有实验证明该通道参与许多与氧相关的生物过程,如mitoKATP开放剂在缺血缺氧性心肌病的预处理中对心肌细胞起保护作用[2,3]并在缺血性脑病预处理中起到相同的作用[4]。
低氧情况下钾通道电流下降,膜去极化。持续膜去极化开放电压依赖性钙通道,细胞内[Ca2+]升高,肺血管收缩,肺动脉平滑肌细胞(pulmonary artery smooth muscle cells,PASMCs)增生、重构,形成肺动脉高压。近来研究表明在肺动脉高压中,电压门控钾通道(voltage-gate K+,Kv)功能的失调,尤其是Kv1.5的表达及功能失调,是肺动脉高压的基本特征[5-9]。已有实验证明mitoKATP的特异性抑制剂5-羟基癸酸盐(5-hydroxydecanoate,5-HD)能促进24 h低氧条件下培养的人肺动脉平滑肌细胞凋亡,减少增殖,且在低氧条件下上调Kv1.5通道的电流及蛋白的表达[1]。众所周知生物体内具有相互作用的细胞因子及复杂体液系统,然而既往研究仅限于环境比较单一的体外。且mitoKATP通道的特异性抑制剂5-HD是否能够逆转慢性低氧性肺动脉高压(chronic hypoxic pulmonary artery hypertension ,CHPAH)大鼠及其结构重建呢?其机制又是如何?并无相关报道。本文拟在在体水平研究mitoKATP的抑制剂5-HD对CHPAH大鼠血流动力学的影响及其机制。
材 料 和 方 法
1材料
1.1实验动物 雄性SD大鼠24只,体重200-300 g,清洁级,由温州医学院实验动物中心提供。
1.2试剂 5-HD购自Sigma,用磷酸盐缓冲溶液(PBS)溶解至所需浓度。Trizol试剂购自Invitrogen。逆转录试剂盒(A3500)及PCR试剂(M7122)均购自Promega。多克隆羊抗大鼠Kv1.5抗体和多克隆兔抗大鼠β-actin 抗体均购自Santa Cruz。辣根酶标记兔抗山羊IgG (H+L)Ⅱ抗和山羊抗兔IgG(H+L)Ⅱ抗均购自北京中衫生物技术公司。BCA蛋白浓度测定试剂盒购自Pierce。提取蛋白RIPA强裂解液购自江苏碧云天生物技术研究所,其余均为市售分析纯。
2方法
2.1动物模型的制备 用随机数字表将动物随机分为正常组、缺氧组、缺氧组5-HD干预组,每组各8只。将缺氧组、缺氧+5-HD干预组置入开孔式常压低氧的舱内,测氧仪连续监测,充入N2使O2维持在(10.0±0.3)%,CO2维持在<3.0%,以无水氯化钙吸收水蒸气,钠石灰吸收CO2,每天低氧8 h,每周6 d,连续4周。缺氧+5-HD组在缺氧1周后,每天在低O2前予以皮下注射5-HD(5 mg/kg),低氧组则每天予相同体积PBS皮下注射,连续3周,正常组置同室正常氧浓度环境饲养。
2.2大鼠平均肺动脉压(mean pulmonary arterial pressure,mPAP)及右心室重量比[the ratio of right ventricle weight to left ventricle with septum weight,RV/(LV+S)]的测定 4周后,用5%水合氯醛(400 mg/kg)腹腔注射麻醉,仰卧固定,行颈正中切口,采用右心导管法[10]测定大鼠肺动脉压力。将聚乙烯塑料导管(OD 1.1 mm,ID 0.9 mm,温州医学院病理生理教研室提供)从右侧颈外静脉按顺序插入右房、右室和肺动脉和导管另一端与MEDLAB 数据记录分析系统相连,测mPAP。放血处死大鼠后,迅速取出大鼠心肺,剪去心脏中心房组织,沿心间隔边缘分离出右心室(right ventricle,RV)及左心室和室间隔(left ventricle+septum,LV+S),用滤纸吸干水分后称重RV及LV+S,计算右心室肥厚指数即RV/(LV+S)的重量比(%)。
2.3RT-PCR方法测定Kv1.5 mRNA的表达 低温下迅速分离肺组织中的肺动脉,右侧肺动脉用于RT-PCR,置于液氮中保存。取各组大鼠肺动脉先液氮研磨,以Trizol试剂按说明提取总RNA。取总RNA 10 μL,加入0.2 mL EP管,70 ℃10 min,离心15 s,置冰上。按逆转录试剂盒说明,以oligo为引物,AMV逆转录酶建立50 μL反应体系,42 ℃ 1 h,95 ℃ 5 min。取逆转录后的cDNA 5 μL为PCR模板,按PCR试剂盒说明建立25 μL反应体系。β-actin:正义链引物 5’-GTC CCT GTA TGC CTC TGG-3’,反义链引物 5’-GTC TTT ACG GAT GTC AACG-3’,退火温度54 ℃,产物457 bp;Kv1.5:正义链引物 5’-CCA GCG AGT CCT CAT AAA CA-3’,反义链引物 5’-CAC TAT GGC GAT GGC TCTT-3’退火温度56 ℃。反应条件:94 ℃ 5 min;94 ℃ 1 min,56 ℃ 45 s,72 ℃ 45 s,40个循环;72 ℃ 10 min,产物长度409 bp。此后,以1.5%琼脂糖凝胶电泳,电压80 V,时间1 h,再用凝胶成像系统检测目的条带,Gelpro32软件测定条带A值,以Kv1.5目的条带与β-actin目的条带的A值之比分别作为Kv1.5 mRNA的相对表达量。
2.4Western boltting方法测定Kv1.5蛋白的表达 低温下迅速分离肺组织中的肺动脉,左侧肺动脉置于液氮中保存。取各组大鼠肺动脉,用强RIPA裂解液(江苏碧云天生物技术公司),其中按体积比1∶100加入PMSF(江苏碧云天生物技术公司)裂解肺动脉,提取总蛋白,BCA法(Pierce)测定蛋白浓度。每组取等量75 μg蛋白,在10% SDS-聚丙烯酰胺凝胶上电泳分离细胞总蛋白。目的蛋白转移到PVDF膜上,5%脱脂奶粉(BD)室温封闭1 h后,Ⅰ抗(多克隆羊抗大鼠Kv1.5,Santa Cruz))孵育4 ℃过夜,Ⅰ抗稀释度为1∶200,再用Ⅱ抗(辣根酶标记兔抗山羊IgG,1∶5 000,北京中山生物技术公司)孵育室温2 h 30 min,最后用TBST缓冲液洗膜10 min 3次,用ECL(Pierce)显影。Gel-Pro 32软件测定条带A值,以Kv1.5目的条带与β-actin目的条带的A值之比作为Kv1.5 蛋白的相对表达量。
3统计学处理
结 果
1各组mPAP和RV/(LV+S)的比较
低氧组与正常对照组比较mPAP和RV/(LV+S)升高(均P<0.05), 表明肺动脉高压形成,右室肥大,肺动脉高压动物模型复制成功。低氧+5-HD组与低氧组比mPAP和RV/(LV+S)均显著下调(均P<0.05),表明5-HD能显著抑制低氧引起的肺动脉高压和右心室肥大,见表1。
表1各组mPAP、RV/(LV+S)的变化

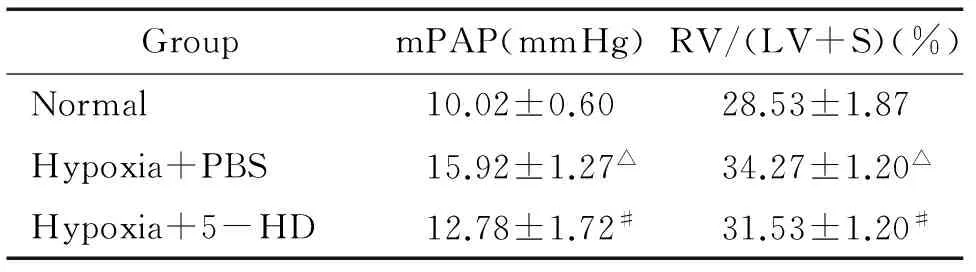
GroupmPAP(mmHg)RV/(LV+S)(%)Normal10.02±0.6028.53±1.87Hypoxia+PBS15.92±1.27△34.27±1.20△Hypoxia+5-HD12.78±1.72#31.53±1.20#
△P<0.05vsnormal ;#P<0.05vshypoxia+PBS.
2RT-PCR检测各组Kv1.5mRNA表达
Kv1.5通道产物条带为409 bp,β-actin产物条带为457 bp。 结果表明,慢性低氧可明显降低肺动脉Kv1.5 mRNA表达(P<0.05),5-HD干预后PAMSCs Kv1.5 mRNA表达较单纯低氧组增加(P<0.05),见图1。

Figure 1. Effect of hypoxia and 5-HD on Kv1.5 mRNA expression in pulmonary arteries. A: agarose gel electrophoresis of PCR products amplified with the primers indicated above, using pulmonary arteries in different groups.β-actin mRNA was used as a control; B: Bars show the relative expression levels of Kv1.5 (absorbance of Kv1.5 mRNA normalized against β-actin mRNA).*P<0.05vsnormal group;#P<0.05vshypoxia+PBS group.
图15-HD对各组大鼠肺动脉Kv1.5mRNA表达的影响
3Westernboltting法检测各组Kv1.5蛋白的表达
结果显示,慢性低氧组比正常组显著下调肺动脉Kv1.5蛋白的表达(P<0.05),低氧+5-HD组一定程度逆转了单纯低氧对Kv1.5蛋白的抑制,使Kv1.5蛋白的表达显著上调,两者差异显著(P<0.05), 见图2。
讨 论
低氧肺动脉高压是一种严重的疾病。肺血管的收缩和重建在肺血管阻力增高中起到主要作用。既往研究表明肺动脉平滑肌中存在Kv且其参与低氧肺血管收缩的过程[6]。另发现在肺动脉高压人群及慢性低氧诱导的肺动脉高压大鼠中,肺动脉平滑肌上的Kv通道下调[7-9],使得Kv通道成为一个极具潜力的治疗靶点,增加Kv的活性及表达将有助于低氧肺动脉高压的治疗。迄今为止,发现Kv通道有许多不同的亚型,各种亚型对低氧的敏感度有所不同。研究发现,慢性低氧下调肺动脉平滑肌细胞的Kv通道的表达,包括Kv1.1、Kv1.2、Kv1.4、Kv1.5、 Kv2.1、Kv4.3和Kv9.3[11]。在我们的研究中主要针对的是Kv1.5,因有大量的实验表明在低氧肺动脉高压中Kv1.5的表达下调及功能障碍,已成为肺动脉高压的基本特征之一[7-9],另大多人倾向Kv1.5可能是最主要的氧敏感亚型[8,12]。
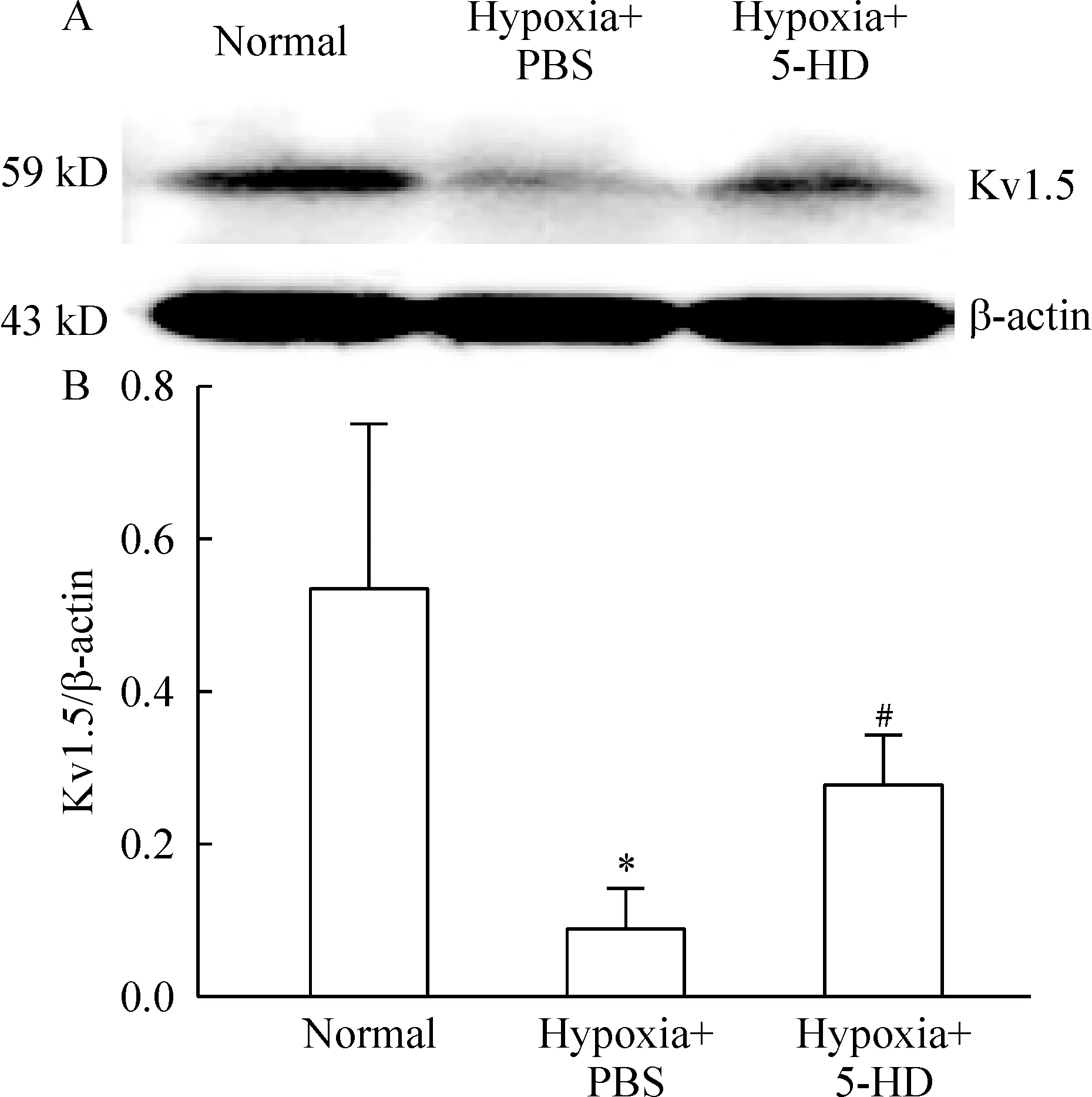
Figure 2. Effects of hypoxia and 5-HD on Kv1.5 protein expression in pulmonary arteries detected by Western blotting. A: Western blotting of pulmonary arteries from different groups. β-actin protein expression was used as a control; B: bars show the relative expression levels of Kv1.5 (absorbance of Kv1.5 normalized against β-actin expression).*P<0.05vsnormal group;#P<0.05vshypoxia+PBS group.
图25-HD对慢性低氧大鼠肺动脉Kv1.5蛋白表达的影响
线粒体是细胞内一种重要的细胞器,具有复杂的亚微结构和功能转换系统,通过氧化磷酸化为细胞生命活动提供能量。mitoKATP是1991在线粒体内膜的单通道记录中首次发现的[13]。后续的研究表明mitoKATP对低氧极为敏感,在生理状态下,细胞内生理浓度的ATP存在, mitoKATP基本处于关闭状态。在机体缺氧情况下, mitoKATP通道开放,K+内流,线粒体膜去极化,从而影响细胞氧自由基、半胱氨酸天冬氨酸蛋白酶、细胞色素C的生成和分配及多种蛋白激酶或转录因子的活性,抑制细胞凋亡,从而对缺血再灌注组织(如心肌、神经元等)发挥保护作用[14-16]。同时研究发现mitoKATP通道开放剂diazoxide抑制氧化应激诱导的线粒体凋亡通路的激活,而mitoKATP通道的抑制剂5-HD则逆转了diazoxide的抗凋亡的作用[17]。迄今为止,关于mitoKATP通道在低氧肺动脉重建的作用阐述并不多。
有研究表明,在离体人肺动脉平滑肌24 h缺氧下mitoKATP通道开放,线粒体膜电位发生去极化,从而引起Kv1.5通道mRNA及蛋白表达明显降低,增加其增殖,减少凋亡。而mitoKATP通道阻断剂5-HD 能够减弱缺氧引起的上述效应[3]。然而既往研究仅局限于体外,且短期缺氧条件下体外培养的细胞可能无法准确反映完整的动物体内慢性缺氧mitoKATP通道的作用,因低氧的持续时间及程度、各种细胞因子、循环因子及复杂的体液系统等都可能对其产生影响。
本实验成功建立低氧性肺动脉高压模型。低氧组的mPAP及RV/(LV+S)与正常对照组相比明显升高。另外,大鼠在低氧条件下,Kv1.5 mRNA及蛋白表达的下降与既往研究结果一致[5-9,11,12]。大鼠慢性缺氧1周后,每天5-HD(5 mg/kg/d)干预,连续3周,来评估其对低氧肺动脉高压的影响。结果显示 mitoKATP抑制剂5-HD逆转了CHPAH大鼠的mPAP及RV/(LV+S)的升高,且肺动脉中Kv1.5通道的mRNA及蛋白表达较单纯低氧组有所上调。据此,我们可推测低氧性肺动脉高压形成与mitoKATP通道密切相关。
关于Kv通道的表达调控所知甚少。慢性低氧时肺动脉上Kv1.5通道的下调机制并不明确,但相关研究表明其与转录因子的调控有关,如低氧诱导因子-1参与上调包括血管内皮因子、内皮素-1、一氧化氮合酶-2的基因等[18]。尽管我们的结果显示了mitoKATP抑制剂5-HD可上调Kv1.5通道的表达,但并不清楚其是否直接增加基因转录及蛋白表达。其可能由氧自由基增多,PKC激活、低氧诱导因子-1等介导。通过我们的实验至少可以推测5-HD干预后Kv1.5通道表达的改变可能是其逆转肺动脉高压的机制之一。同时我们发现5-HD虽然能通过抑制线粒体膜电位,降低肺动脉压力和上调Kv1.5表达,但其并不能够完全逆转。因此,我们推测mitoKATP通道并不是低氧的唯一作用靶点。
此外我们的实验表明Kv通道表达下调可能与低氧肺动脉高压形成的病因相关。大量研究表明,在低氧肺动脉高压中,肺动脉平滑肌中Kv1.5通道的表达下降[4-9,11,12]。但是关于Kv通道表达的改变是与疾病的病因相关或只是继发性改变仍不明确。我们的实验表明5-HD通过下调Kv1.5的表达逆转低氧肺动脉高压,支持Kv通道在该低氧肺动脉高压模型的致病机制中起到一定作用。
迄今为止,仍没有特异性Kv通道开放剂,5-HD能够在低氧时逆转低氧肺动脉高压大鼠Kv通道的表达,且研究表明在正常情况下,5-HD对离体培养人肺动脉平滑肌中Kv通道的功能及表达无影响[19]。因此我们认为通过mitoKATP通道来调控Kv通道在治疗肺动脉高压中极具潜力。
当然,本实验有一定的局限性,如未对Kv通道的功能方面进行研究。另外,本实验取材是肺动脉主干,所得出结论是否适用于肺小阻力血管。这些方面有待于今后进一步研究。
[1] 汪 涛,张珍祥,徐永健.MitoKATP-PKC通路对人体肺动脉平滑肌细胞电压门控钾通道的影响[J]. 华中科技大学学报(医学版), 2008,37(5):565-570.
[2] Wang S,Cone J,Liu Y.Dual roles of mitochondrial KATPchannels in diazoxide-mediated protection in isolated rabbit hearts [J].Am J Physiol Heart Circ Physiol,2001,280(1):H246-H255.
[3] Yamada M. Mitochondrial ATP-sensitive K+channels, protectors of the heart [J]. J Physiol, 2010, 588(2): 283-286.
[4] Bajgar R,Seetharaman S,Kowaltowski AJ,et al.Identification and properties of a novel intracellular (mitochondrial) ATP-sensitive potassium channel in brain [J]. J Biol Chem,2001,276(36): 33369-33374.
[5] Ko EA, Park WS, Firth AL, et al. Pathophysiology of voltage-gated K(+)channels in vascular smooth muscle cells: Modulation by protein kinases [J].Prog Biophys Mol Biol, 2010,103(1):95-101.
[6] Platoshyn O, Yu Y, Golovina VA, et al. Chronic hypoxia decreases KVchannel expression and function in pulmonary artery myocytes[J].Am J Physiol Lung Cell Mol Physiol,2001,280(4): L801-L812.
[7] Yuan XJ, Wang J, Juhaszova M, et al. Attenuated K+channel gene transcription in primary pulmonary hypertension[J].Lancet,1998,351(9104): 726-727.
[8] Pozeg ZI, Michelakis ED, McMurtry MS, et al.Invivogene transfer of the O2-sensitive potassium channel Kv 1.5 reduces pulmonary hypertension and restores hypoxic pulmonary vasoconstriction in chronically hypoxic rats[J].Circulation, 2003,107(15): 2037-2044.
[9] Remillard CV, Tigno DD, Platoshyn O, et al. Function of Kv1.5 channels and genetic variations of KCNA5 in patients with idiopathic pulmonary arterial hypertension[J].Am J Physiol Cell Physiol, 2007,292(5):C1837-C1853.
[10]孙 波,刘文利.右心导管测定大鼠肺动脉压的实验方法[J].中国医学科学院学报,1984,6(6):465-467.
[11]Wang J, Juhaszova M, Rubin LJ, et al. Hypoxia inhibits gene expression of voltage-gated K+channel alpha subunits in pulmonary artery smooth muscle cells[J].J Clin Invest, 1997, 100(9):2347-2353.
[12]Archer SL, London B, Hampl V, et al. Impairment of hypoxic pulmonary vasoconstriction in mice lacking the voltage-gated potassium channel Kv1.5[J].FASEB J,2001, 15(10):1801-1803.
[13]Inoue I, Nagase H, Kishi K, et al. ATP-sensitive K+channel in the mitochondrial inner membrane[J].Nature,1991,352(6332): 244-247.
[14]Xu M, Wang Y, Ayub A, et al. Mitochondrial KATPchannel activation reduces anoxic injury by restoring mitochondrial membrane potential [J].Am J Physiol Heart Circ Physiol, 2001, 281(3):H1295-H1303.
[15]Platoshyn O, Zhang S, McDaniel SS, et al. Cytochrome C activates K+channels before inducing apoptosis[J].Am J Physiol Cell Physiol,2002,283(4):C1298-C1305.
[16]郑鸣之,蒋建平,陈文良,等.二氮嗪对冷保存诱导的大鼠供心Smac/DIABLO蛋白表达的抑制作用[J].中国病理生理杂志,2009,25(9):1676-1680.
[17]Akao M, Teshima Y, Marban E. Antiapoptotic effect of nicorandil mediated by mitochondrial ATP-sensitive potassium channels in cultured cardiac myocytes[J].J Am Coll Cardiol, 2002,40(4):803-810.
[18]Semenza GL.HIF-1: mediator of physiological and pathophysiological responses to hypoxia[J]. J Appl Physiol, 2000, 88(4):1474-1480.
[19]Wang T, Zhang ZX, Xu YJ. Effect of mitochondrial KATPchannel on voltage-gated K+channel in 24 hour-hypoxic human pulmonary artery smooth muscle cells[J]. Chin Med J (Engl),2005,118(1):12-19.
Effectsof5-hydroxydecanoateonKv1.5expressioninpulmonaryarteriesofchronichypoxicrats
LI Qiu, ZHANG Li-ping, SHU Ying, LI Yun-lei, CHEN Cheng-shui
(DepartmentofRespiratoryMedicine,TheFirstAffiliatedHospital,WenzhouMedicalCollege,Wenzhou325000,China.E-mail:chenchengshui@gmail.com)
AIM: To investigate the effect of mitochondrial ATP-sensitive potassium channel(mitoKATP) inhibitor 5-hydroxydecanoate (5-HD) on chronic hypoxic pulmonary artery hypertension (CHPAH) in rats.METHODSTwenty-four male Sprague-Dawley rats were randomly divided into 3 groups:control group, hypoxia group and hypoxia+5-HD group. To establish an animal model of CHPAH, the rats in hypoxia group and hypoxia+5-HD group were placed into a hypoxic and normobaric chamber [O2(10.0±0.3)%] for 4 weeks (8 h a day, 6 days a week). The mean pulmonary arterial pressure (mPAP) and the ratio of right ventricle weight to left ventricle with septum weight [RV/(LV+S)] were measured. Western blotting and reverse transcription-polymerase chain reaction (RT-PCR) were performed to analyze the protein and mRNA levels of Kv1.5 in the pulmonary artery,respectively.RESULTSThe mPAP and RV/(LV+S) were much higher in hypoxia group than those in control group, while those in hypoxia+5-HD group were decreased as compared to hypoxia group. The protein and mRNA levels of Kv1.5 in hypoxic group were significantly lower than those in control group, and this decrease was partly reversed by 5-HD.CONCLUSION5-HD may exert a protective effect on CHPAH by decreasing mPAP and RV/ (LV+S). Inhibiting mitoKATPand stimulating Kv1.5 expression by 5-HD may contribute to the mechanism of this effect.
5-Hydroxydecanoate; Kv1.5 channel; Mitochondrial ATP-sensitive potassium channels; Rats
R363
A
10.3969/j.issn.1000-4718.2011.01.004
1000-4718(2011)01-0022-05
2010-07-08
2010-10-11
浙江省自然科学基金资助项目(No.Z2080988)
△通讯作者 Tel:0577-88069355; E-mail: chenchengshui@gmail.com
