甲醇合成催化反应机理及活性中心研究进展
2011-10-22白绍芬刘欣梅阎子峰
白绍芬,刘欣梅,阎子峰
(中国石油大学(华东)重质油加工国家重点实验室,CNPC催化重点实验室,山东 青岛 266555)
进展与述评
甲醇合成催化反应机理及活性中心研究进展
白绍芬,刘欣梅,阎子峰
(中国石油大学(华东)重质油加工国家重点实验室,CNPC催化重点实验室,山东 青岛 266555)
甲醇不仅是一种重要的有机化工原料,而且可以单独或与汽油混合作为汽车燃料,具有节能与环保的双重优势。甲醇合成反应研究尽管有四十多年的历史,但有关甲醇合成反应机理及催化剂活性中心类型等方面的问题仍存在争议。本文综述了近几年来在铜基催化剂上甲醇合成催化反应机理及催化剂活性中心的研究进展,以期提高人们对甲醇合成反应催化本质的认识,并为优良催化剂的开发提供一定借鉴。
甲醇合成;反应机理;活性中心;铜基催化剂
甲醇合成反应机理与活性中心的研究一直是甲醇合成反应过程的研究重点,其对高效催化剂的开发、实验现象本质特征的解释和反应结果的预测都具有重要意义。一个合理的甲醇合成反应历程能够为反应条件的优化以及催化剂制备过程等催化体系的改进提供理论依据,为工业化生产提供理论支撑。近年来,人们针对不同的催化体系提出了不同的甲醇合成反应机理,并对活性中心、中间物种、控速步骤以及直接碳源等做了大量研究工作,提出了许多较为合理的观点,但由于表征技术的局限性、反应本身的复杂性、反应中间物种难以捕捉以及反应机理受催化剂结构影响等原因,仍然没有一个统一的观点。关于甲醇合成的直接碳源,多数研究者认为CO和CO2共同作为直接碳源[1-9];但也有人认同单独的CO或CO2是直接碳源。不同的观点都根据各自的实验现象得以佐证。在甲醇合成反应的中间物种研究中,利用原位红外、动力学计算以及分子模拟等手段发现,中间物种主要有甲酸盐、碳酸盐、甲酰基以及甲氧基等[4,8,10]。而活性中心类型归纳起来有 Cu0、Cu+、Cu0-Cu+以及ZrO2等[11-14]。但截至目前对以上问题的研究还没有达成共识。
1 反应机理
甲醇合成催化反应机理一直是研究人员关注和争议的焦点。这是由于不同的反应原料(CO/H2或CO2/H2)、不同的催化剂、甚至相同的催化体系,催化剂结构不同,也可能导致反应机理不同。有关反应机理的研究,主要集中在甲醇合成反应的直接碳源、反应的中间物种、反应的控速步骤以及CO2(CO)在反应中的作用等问题。早期研究者多数以动力学和H2、CO吸附等间接的实验结果为基础进行反应机理的研究;而现在多数基于同位素标记、光谱测定以及动力学模拟计算等比较直接的证据,但仍不能得出统一明确的结论。本文按合成甲醇直接碳源的不同,将机理划分为以下3种:CO与CO2共同作为直接碳源机理、CO作为直接碳源机理以及CO2作为直接碳源机理。
1.1 一氧化碳和二氧化碳作为直接碳源
在CO和CO2加氢合成甲醇反应机理研究中,人们普遍认为甲酰基和甲酸基是反应过程的重要中间物种,CO吸附活化后直接生成甲酰基,而CO2吸附活化后生成甲酸基,并且CO和CO2可以通过表面氧或甲酸基等物种相互转化。也有不同的观点认为CO吸附活化后与表面羟基结合生成甲酸盐,而CO2则与表面氧结合生成碳酸根离子。
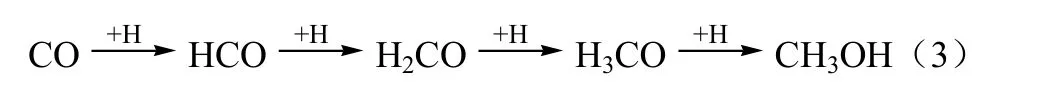
Fisher等[1]认为CO和CO2吸附活化后,首先分别生成甲醛和甲酸物种,再通过加氢和脱氧反应生成甲醇,中间物种甲酸盐可分解生成 CO。反应机理如图1所示。
Gao等[2]采用EPR、TPD及DRIFT等手段,比较了表面氧原子及氢原子对CO、CO2活化的影响,认为原料中加入CO2的作用是促进甲酰基加氢生成甲氧基,CO的加入消耗了O-,维持了催化剂表面Cu0-Cu+的数量,稳定了催化剂活性中心。他们分别推断出CO和CO2的活化机理以及它们的加氢路径。


图1 Cu/ZrO2上CO和CO2加氢合成甲醇反应机理图
Sanchez-Escribano等[3]采用红外光谱考察了Cu/ZnO/Al2O3催化剂上的CO/CO2加氢反应,提出如下可能发生的表面反应,见式(4)~式(9)。
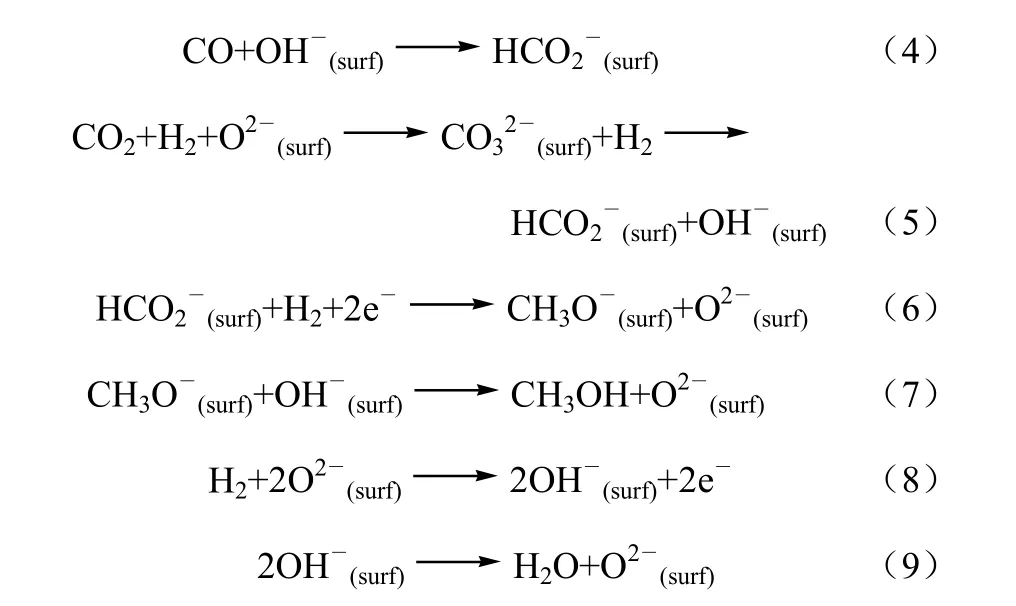
其中,反应式(4)、式(6)~式(8)组成CO加氢合成甲醇过程,式(5)~式(9)组成CO2加氢合成甲醇过程。他们认为表面甲酸盐和甲氧基物种是CO/CO2加氢反应的中间物种,甲氧基的加氢反应为控速步骤。
殷永泉等[4]采用原位红外表征手段,考察了Cu/ZnO/Al2O3催化剂上的CO/CO2加氢反应,推断出如下反应机理,见图2。
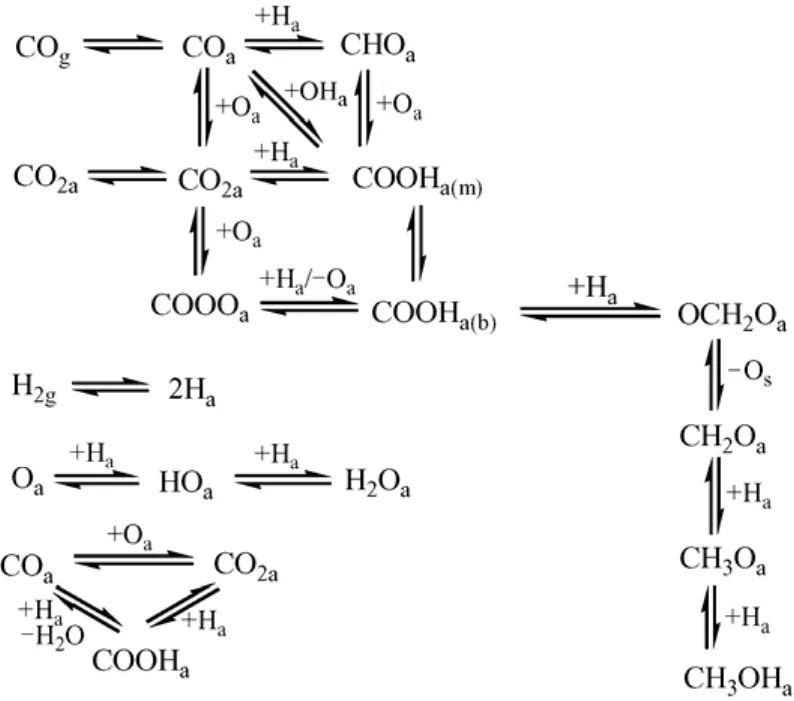
图2 Cu/ZnO/Al2O3上CO/CO2加氢合成甲醇反应机理图
他们认为CO/CO2的加氢反应可能从不同的物种开始。CO加氢时,CO首先吸附在催化剂上,然后通过加氢依次生成甲酰基、甲酸基、甲氧基和甲醇;还有一部分CO与表面氧结合生成CO2,或与表面羟基结合,直接生成甲酸盐。而CO2加氢时,CO2首先吸附于催化剂表面,然后加氢,依次生成碳酸盐、甲酸盐、甲氧基和甲醇。与 Sanchez-Escribano等提出的反应机理不同的是,他们认为反应过程中CO与CO2可通过水气变换反应相互转化。这种机理是目前提出的较为完善的甲醇合成反应机理。需要指出的是,表面氧在水气变换反应过程中起到关键作用;另外,在 Gao等[2]提出的反应机理中,表面氧还是 CO活化方式的重要影响因素。
此外,Zhang等[5]采用 DRIFT研究了低温下Cu/ZnO催化剂上,以醇类为助剂的CO/CO2加氢合成甲醇机理,反应机理见图3。
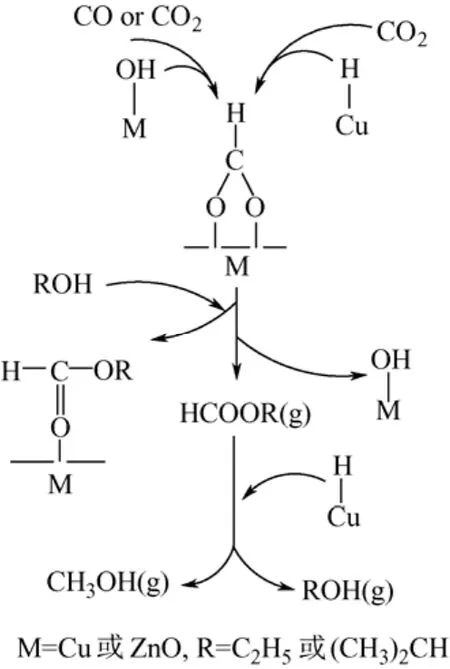
图3 Cu/ZnO上以醇类为助剂,CO/CO2/H2合成甲醇反应机理图
CO和CO2首先吸附活化生成甲酸基,然后在常压、443 K条件下,吸附的甲酸基与乙醇或异丙醇发生酯化反应生成烃基甲酸。生成的烃基甲酸在1.0 MPa、443 K下可被表面氢原子还原,最终得到甲醇和原有的醇助剂。此方法克服了 BNL方法原料中少量CO2或H2O导致催化剂活性大幅度下降的缺点,大大降低了甲醇合成反应的压力和温度,CO转化率高达50%~80%,是近年来甲醇合成反应的研究热点之一[6-7]。
Lim等[8]以Langmuir-Hinshelwood模型为基础,通过筛选建立了 Cu/ZnO/Al2O3/ZrO2催化剂上CO/CO2加氢合成甲醇的动力学模型。动力学参数评估结果表明,CO、CO2加氢及水气变换反应的控速步骤分别为甲氧基加氢、甲酸基加氢以及甲酸基形成反应;少量CO2的加入可抑制甲醇向二甲醚的转化,从而提高了甲醇合成反应的选择性;CO/CO2加氢反应活性受Cu0-Cu+数目的控制,ZrO2加入量的变化会改变 Cu0-Cu+的数目,从而对动力学参数造成影响。
Tang等[9]则根据蒙特卡洛基本定律,研究了Cu/ZrO2催化剂上CO2加氢合成甲醇的催化反应动力学。通过比较催化剂表面可能发生的各反应所需的活化能,推断出CO2加氢合成甲醇存在两条路径:一条是CO2首先通过水气变换反应的逆反应转化为CO,然后CO发生连续加氢反应生成CH3O,最后CH3O可与H2O或OH发生水解反应得到甲醇;另一条是传统的 CO2通过甲酸物种直接转化为CH3O,然后所得CH3O的转化与第一条路径相同。
1.2 一氧化碳作为直接碳源
CO加氢合成甲醇的机理,可分为以下两种观点。一种观点认为[15-16],CO首先在活性位上吸附活化,然后与吸附态的氢原子发生分步加氢反应,最终生成甲醇;而原料气中的CO2仅为补充碳源。这种机理不能解释原料中少量CO2的存在能够明显促进甲醇合成反应的现象。第二种观点认为[11,17-18],活化态的CO在加氢过程中同时与羟基、表面氧等物种发生反应,生成甲酸盐、甲氧基以及碳酸盐等中间物种,中间物种再通过脱氧及水解等反应生成甲醇。Michael等[17-18]认为甲氧基的加氢反应为甲醇合成反应的控速步骤,并提出了式(10)~式(12)所示反应机理。
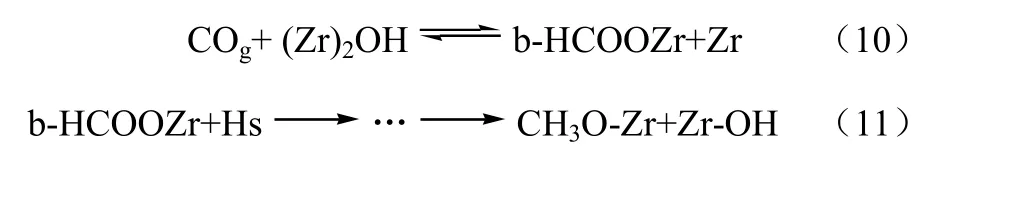

其中,(Zr)2OH表示与配位不饱和的Zr相连的羟基。CO吸附在cus-Zr4+的L酸中心上,Hs来源于Cu上解离吸附氢的溢流作用。
与Rhodes的观点不同,吴贵升等[19]认为ZrO2上甲酸盐加氢形成甲氧基的反应为甲醇合成反应的控速步骤。同时提出,由甲氧基转化为甲醇存在直接加氢和水解反应两种途径。他们认为,甲氧基直接加氢合成甲醇反应条件苛刻,而通过水解生成甲醇十分容易进行。加入适量CO2可促进水气变换的逆反应,生成的水有利于甲氧基的水解生成甲醇。这在一定程度解释了合成气中少量的CO2可显著提高工业甲醇合成催化剂活性的原因。除此之外,他们认为低温下,吸附在Cu活性中心上的CO向ZrO2溢流,与表面负氧离子(步骤Ⅰ)和表面羟基(步骤Ⅱ)反应,分别生成CO2--Zr和b-HCOO-Zr物种,反应机理如图4所示。
1.3 二氧化碳作为直接碳源
持此观点的人认为,原料气中的CO需首先经过水气变换反应转换为 CO2和 H2[20],然后生成的CO2再与H2反应生成甲醇。在此过程中,表面氧起到关键作用[2,10]。表面氧不但是水气变换反应的中间物种,而且可以抑制CO2的解离吸附。Chinchen等[21-22]利用原子示踪技术,对原料中的14CO 及14CO2进行跟踪,发现产物甲醇中14C含量与原料中14CO2/CO的变化相一致,并且未检测到含14C水气变换反应中间产物,由此推断Cu/ZnO/Al2O3催化剂上甲醇合成反应的直接碳源为CO2,而CO作为一种还原剂使活化的Cu表面得到再生。这种观点的局限性是无法解释当反应达到稳态时原料气中CO2基本无消耗的事实。
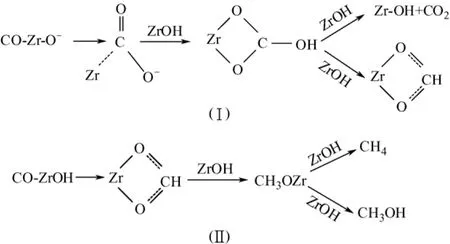
图4 Cu/ZrO2上CO加氢合成甲醇反应机理图
近年来,随着表征技术的进步以及仪器精密度的提高,人们针对不同载体的铜基催化体系,提出了许多更为合理的CO2加氢合成甲醇反应机理。在Cu/ZrO2催化 CO2加氢合成甲醇反应中,有人认为,CO2在加氢反应过程中首先与吸附在ZrO2表面的羟基反应生成碳酸氢盐,然后碳酸氢盐经过分步加氢反应,分别生成甲酸盐和甲氧基,最后生成甲醇。但由于存在水气变换反应的逆反应,使反应过程中同时存在 CO吸附活化物种,反应中间物种的归属问题变得较为复杂,不利于反应机理的提出。
Graeme等[20]研究了Cu/ZnO/SiO2催化剂上CO2加氢合成甲醇反应机理,认为CO2在反应中首先与吸附在Cu上的表面氧负离子反应生成碳酸根离子,碳酸根离子再通过加氢脱氧反应生成甲酸盐,其中甲酸盐加氢生成甲氧基的反应为反应的控速步骤,反应机理如图5所示。
这种机理的不足之处在于,仅提出了一条CO2加氢合成甲醇反应路径。现在,人们普遍认为甲醇合成反应存在多个平行反应,其中水气变换反应在甲醇合成中起到重要作用[23-24]。
孙琦等[25]针对 Cu/ZnO/Al2O3催化体系提出了以CO2加氢反应为控速步骤的甲醇合成反应机理,比以上两种机理更为完善的是,此反应机理包括了水气变换反应,并合理解释了反应尾气中CO2量相近的现象,反应机理图,见图6。他们认为CO2首先经过加氢反应(反应 1)生成甲醇,同时生成部分水,这些水又迅速与CO经水汽变换反应(反应2)转化为 CO2,而 CO2又成为下一步反应的反应物,从而构成一个循环。在这个反应体系中,反应2被认为是快速过程,在各种反应条件下均容易达到平衡,而反应1是控速步骤,故尾气中CO2的量总是相近的。

图5 Cu/ZnO/SiO2上CO2加氢合成甲醇反应机理图
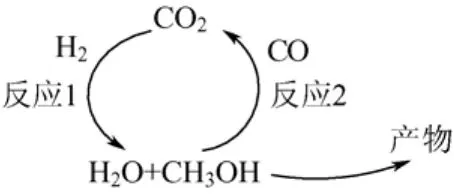
图6 Cu/ZnO/Al2O3上CO2加氢合成甲醇反应机理图
2 活性中心
研究甲醇合成反应的活性中心,对于设计和开发新型甲醇催化剂具有十分重要的意义。目前,对于甲醇合成过程中所使用的铜基催化剂的活性中心主要有以下4种观点。
2.1 Cu0活性中心
关于Cu0为甲醇合成反应活性中心的观点,最具代表性的是由Chinchen等[22]于20世纪80年代提出的,他们发现催化剂反应活性与其活性组分铜表面积成正比关系,否认Cu与ZnO间有强的相互作用。近年来,支持 Cu0为活性中心的实验结果大多是通过对还原或反应气氛中的催化剂进行原位检测,未发现Cu+和Cu2+存在,证明了Cu0为活性中心的观点[26]。表征手段包括:XPS、XAES、ESR、EXAFS、DRIFT等[27-30]。沈百荣等[29]采用EXAFS手段研究了第3组分对Cu/ZnO/MxOy催化剂结构和活性的影响以及还原后各组分的价态及配位数。结果表明,还原后的催化剂中CuO基本被还原成金属Cu,而 ZnO未被还原。另外,他们指出载体适当的弱酸、弱碱性以及活性组分Cu的高度分散有利于提高催化剂的催化活性。Ma等[11]利用DRIFT考察了CO在不同相态Cu/ZrO2上的吸附行为,发现负载在四方相 ZrO2上的 Cu为金属态,而负载在无定形和单斜相 ZrO2上的Cu为Cuδ+(0<δ<+1)。反应评价结果表明,以四方相ZrO2为载体的催化剂具有较高的活性,由此推断,Cu0是CO加氢合成甲醇反应的主要活性中心。
2.2 Cu+活性中心
在早期的研究中,Klier等[15,31]认为CO加氢合成甲醇催化剂失活的主要原因是Cu+被还原为Cu0,CO2的存在可使铜维持在正一价的状态,因而提高了甲醇合成反应的活性。陈鸿博等[32]根据原子价补偿原理,在Cu/ZnO/Al2O3催化剂中加入+3价金属离子氧化物,发现CO吸附量与能谱实验中所观察到的催化剂表层 Cu+的浓度以及催化反应活性呈平行对应关系。由此推断,催化剂活性表面存在的少量Cu+是甲醇合成的主要活性组分,同时它也是CO和H2的吸附活性位。
刘欣梅等[12]以介孔纳米 ZrO2为载体,采用分散共沉淀法和传统的共沉淀法分别制备了DP和CP系铜基甲醇合成催化剂。采用原位XPS考察了铜的还原态,发现DP系最终的还原态是Cu+,而CP系为金属铜,并且DP系的甲醇合成反应性能明显优于CP系。由此推断以CO2作为碳源合成甲醇反应的最佳活性位是Cu+。
2.3 Cu0-Cu+或Cuδ+(0<δ<1)活性中心
徐征等[33]应用XPS、XAES和紫外漫反射光谱法研究了Cu/ZnO催化剂上CO2加氢合成甲醇反应的活性中心,认为Cu/ZnO催化剂上的反应活性中心是存在于Cu/ZnO固溶体中的Cu-□-Zn-O(□为氧空位),活性中心 Cu价态为 Cu+和 Cu0。对于Cu/ZnO/ZrO2催化剂,活性中心Cu为Cu+和Cu0的混合物,并且可能更多地以Cu+的形式存在。而Liu等[34]通过XPS考察了Cu/ZrO2催化剂在还原状态下Cu的价态,发现原子态Cu0的特征峰消失,Cu/ZrO2催化剂的活性中心为Cuδ+(0≤δ<1)。Kulkami等[13]、Nakamura等[35]以及Dai等[36]同样采用XPS及AES对Cu/ZnO催化剂活性中心的价态进行了表征,认为催化剂表面的Cu+/Cu0比控制催化活性。Dai等[36]发现还原及反应状态下的 Cu/ZnO/Al2O3催化剂中的Cu为Cu0态,当暴露于CO2中时,Cu0被氧化为Cuδ+(0<δ<1)态。
3种主要观点都提出了各自合理的论据,但是,大多数观点认为,Cu+的活性优于Cu0,所以当两者同时存在时,Cu+可能是催化剂的主要活性中心。
2.4 ZrO2活性中心
较早提出此观点的是Fisher等[37],他们通过红外光谱等,研究了Cu/ZrO2/SiO2催化剂上的CO2加氢反应,发现CO、碳酸盐以及甲氧基等中间物种的加氢反应都发生在Zr表面,由此提出甲醇合成反应主要在 ZrO2上进行的观点。吴贵升等[19]则认为CO加氢反应主要在ZrO2表面进行,铜组分通过溢流作用向ZrO2提供CO及H2物种,进一步提高加氢反应速率。Michael等[17]发现,CO的吸附量取决于ZrO2表面的阴离子空穴数,阴离子空穴是由Zr4+阳离子形成的氧空穴。Silver等[38]认为氧空穴为甲醇合成反应的活性中心,因此催化剂活性随氧空穴数目的增加而升高。Michael等[17]则认为ZrO2上的阴离子空穴有利于H2的解离吸附,这些空穴不但本身可以作为L酸中心,而且可以提高相邻的Zr-OH的B酸酸性,从而改善了Zr对于CO的吸附性能,有利于甲醇合成反应重要中间物种HCOO-Zr的形成。Pokrovski等[14]向Cu/ZrO2中添加不同的3价阳离子,通过TPR、TPD以及IR等不同的手段对催化剂进行表征,发现催化剂的活性中心是氧化物载体而非Cu,催化活性与 H2的吸附能力和表面桥式吸附的羟基浓度有关。Ce3+-O(H)-Zr4+物种浓度越高,B酸酸性越强,催化剂的活性越高。Tang等[9]通过蒙特卡洛动力学计算发现,(Zr)2-O-Cu为Cu/ZrO2催化剂上CO2加氢的活性中心,催化剂表面氧物种的键合能力是决定催化剂活性和稳定性的重要参数。结合以上研究推断,表面氧空穴与表面氧是影响甲醇合成催化剂活性的重要因素,其作用机理有待进一步研究。
3 结 语
甲醇不仅是重要的化工产品和原料,也是最有希望的动力燃料替代品之一。人们对甲醇合成反应直接碳源、中间物种、控速步骤以及CO2(CO)在反应中的作用进行了大量研究,针对不同的催化体系提出了许多不同的观点,其中被普遍认同的是以CO和CO2混合物作为直接碳源,并可通过水汽变换反应相互转化的甲醇合成反应机理。由于反应机理可能受到反应条件、催化剂体系及结构等因素的影响,因此,在今后的研究中应综合考虑多种因素来优化制备条件和操作条件。另外,人们将乙醇、丙醇作为助剂引入反应体系[5-7],在1 MPa左右的低压下得到了甲醇,大大降低了反应压力及设备成本,开辟了低压合成甲醇的新途径。这种低温液相合成甲醇方法的机理,引起了人们的广泛重视,成为近年来甲醇合成过程的研究热点。活性中心的研究是反应机理研究的基础,为优化并维持催化剂的活性提供重要的理论依据。但截至目前,活性中心类型仍然存在争议,从而导致合成机理也仍未达成共识。为进一步优化甲醇合成反应过程,有关合成反应机理和活性中心类型等基础研究还必将是今后人们热切关注的问题。
[1]Fisher I A,Woo H C,Bell A T. Effects of zirconia promotion on the activity of Cu/SiO2for methanol synthesis from CO/H2and CO2/H2[J].Catalysis Letters,1997,44:11-17.
[2]Gao Lizen,Li Jitao,Peter C T Au. Mechanistic studies on CO/CO2hydrogenation to methanol over Cu-Zn-Al and Cu-Zn-Al-Li catalysts [J].Journal on Natural Gas Chemistry,2001,10(2):110-146.
[3]Sanchez-Escribano V,Vargas M A Larrubia,Finocchio E,et al. On the mechanisms and the selectivity determining steps in syngas conversion over supported metal catalysts:An IR study[J].Applied Catalysis,2007,136:68-74.
[4]殷永泉,肖天存,苏继新,等. CO和CO2在CuO/ZnO/Al2O3催化剂上加氢反应机理的原位红外研究[J]. 燃料化学学报,1999,27(6):565-571.
[5]Zhang Yi,Yang Ruiqin,Tsubaki Noritatsu. A new low-temperature methanol synthesis method:Mechanistic and kinetics study of catalytic process[J].Catalysis Today,2008,132:93-100.
[6]Xu Bolian,Yang Ruiqin,Meng Fanzhi. A new method of low temperature methanol synthesis[J].Catal. Surv. Asia,2009,13:147-163.
[7]Yang Ruiqin,Zhang Yi,Tsubaki Noritatsu. Dual catalysis mechanism of alcohol solvent and Cu catalyst for a new methanol synthesis method[J].Catalysis Communications,2005,6:275-279.
[8]Lim Hye Won,Park Myung June,Kang Suk Hwan. Modeling of the kinetics for methanol synthesis using Cu/ZnO/Al2O3/ZrO2catalyst:Infuence of carbon dioxide during hydrogenation[J].American Chemical Society,2009,48:10448-10455.
[9]Tang Qian Lin,Hong Qi Jun,Liu Zhi Pan. CO2fxation into methanol at Cu/ZrO2interface from frst principles kinetic Monte Carlo[J].Journal of Catalysis,2009,263:114-122.
[10]French S A,Sokol A A,To J,et al. Active sites for heterogeneous catalysis by functionalisation of internal and external surfaces[J].Catalysis Today,2004,93:535-540.
[11]Ma Zhong Yi,Yang Cheng,Wei Wei,et al. Catalytic performance of copper supported on zirconia polymorphs for CO hydrogenation[J].Journal of Molecular,2005,231(1-2):75-81.
[12]刘欣梅,阎子峰. 介孔纳米二氧化锆的微观结构及其应用[J]. 科学通报,2004,49(6):522-527.
[13]Kulkami G U,Rao C N R. EXAFS and XPS investigations of Cu/ZnO catalysts and their interaction with CO and methanol[J].Topics in Catalysis,2003,22(3-4):183-189.
[14]Pokrovski Konstantin A,Bell Alexis T. Effect of dopants on the activity of Cu/M0.3Zr0.7O2(M= Ce,Mn,and Pr)for CO hydrogenation to methanol[J].Journal of Catalysis,2006,244:43-51.
[15]Herman R G,Klier K,Simmons G W,et a1. Catalytic synthesis of methanol from CO/H2I phase composition,electronic properties and activities of the Cu/ZnO/M2O3catalysts[J].Journal of Catalysis,1979,56(1):407-429.
[16]Klier K,Chatikavanij V,Herman R G,et al. Catalytic synthesis of methanol from CO/H2:Ⅳ. The effects of carbon dioxide[J].Journalof Catalysis,1982,74(2):343-360.
[17]Michael D Rhodes,Bell Alexis T. The effects of zirconia morphology on methanol synthesis from CO and H2over Cu/ZrO2catalysts PartⅠ. Steady-state studies[J].Journal of Catalysis,2005,233:198-209.
[18]Michael D Rhodes,Konstantin A Pokrovski,Bell Alexis T. The effects of zirconia morphology on methanol synthesis from CO and H2over Cu/ZrO2catalysts Part Ⅱ. Transient-response infrared studies[J].Journal of Catalysis,2005,233:210-220.
[19]吴贵升,赵宁,陈小平,等. CO/H2在Cu/ZrO2催化剂表面吸附行为原位红外表征[J]. 燃料化学学报,2001,29(6):490-493.
[20]Graeme J Millar,Rochester C H. An in situ high pressure FT-IR study of CO2/H2interactions with model ZnO/SiO2,Cu/SiO2and Cu/ZnO/SiO2methanol synthesis catalysts[J].Catalysis Letters,1992(07):289-295.
[21]Chinchen G C,Denny P J,Parker D G,et al. Mechanism of methanol synthesis from CO2/CO/H2mixtures over copper/zinc oxide/alumina catalysts:Use of14C-labelled reactions[J].Applied Catalysis,1987,30(2):333-338.
[22]Chinchen G C,Waugh K C,Whan D A. The activity and state of the copper surface in methanol synthesis catalysts[J].Applied Catalysis,1986,25(1):101-107.
[23]毛利群,徐征,千载虎,等. CuO/ZnO/ZrO2催化剂上CO2加氢反应机理的研究[J]. 催化学报,1992,13(3):187-190.
[24]毛利群,徐征,千载虎. CuO/ZnO/ZrO2催化剂上CO2氢化反应的研究[J]. 河南师范大学学报,1993,21(3):23-26.
[25]孙琦,张玉龙,马艳,等. CO2/H2和(CO/CO2)+H2低压合成甲醇催化过程的本质[J]. 高等学校化学学报,1997,18:1131-1135.
[26]Fleisch T H,Mievill R L. Studies on the chemical state of Cu during methanol synthesis[J].Journal of Catalysis,1984,90(1):185-172.
[27]陈宝树,赵九生,等. 由XPS研究CO2在低压甲醇合成中的作用[J]. 分子催化,1989,8(4):253-259.
[28]许勇,王金安,汪仁. 二氧化碳加氢合成甲醇铜基催化剂表面组成的研究[J]. 燃料化学学报,1994,22(2):176-181.
[29]沈百荣,韩继红,孙琦,等. EXAFS研究合成甲醇催化剂 Cu/ ZnO/MxOy[J]. 高等学校化学学报,1997,18:2038-2040.
[30]丛昱,包信和,张涛,等. CO2加氢合成甲醇的超细Cu-ZnO-ZrO2催化剂的表征[J]. 催化学报,2000,21(4):314-318.
[31]Klier K. Methonal synthesis[J].Advances in Catalysis,1982,31:243-313.
[32]陈鸿博,蔡俊修,张鸿斌,等. 低压铜基甲醇合成催化剂活性表面的 XPS和TPD表征[J]. 厦门大学学报,1990,29(4):411-415.
[33]徐征,毛利群,千载虎. CO2加氢低压合成甲醇催化剂CuO/ZnO/ZrO2的光电子能谱研究[J]. 燃料化学学报,1992,20(8):270-276.
[34]Liu Jinyao,Shi Jiangliu,He Dehua,et al. Surface active structure of ultra-fne Cu/ZrO2catalysts used for the CO2+H2to methanol reaction[J].Applied Catalysis,2001,l218:113-119.
[35]Nakamura J,Chinjima T U,Kanai Y,et al. The role of ZnO in Cu-ZnO methanol synthesis catalysts[J].Catalysis Today,1996,28:223-230.
[36]Dai Wei Lin,Sun Qi,Deng Jing Fa,et al. XPS studies of Cu/Zn/Al2O3ultra-fine catalysta derived by a novel gel oxalateco-prescipitation for methanol synthesis by CO2+H2[J].Applied Surface Science,2001:172-179.
[37]Fisher Ian A,Bell Alexis T. In-situ infrared study of methanol synthesis from H2/CO2over Cu/SiO2and Cu/ZrO2/SiO2[J].Journal of Catalysis,1997:222-235.
[38]Silver Ronald G,Hou Cheinchang J,Ekerdt John G. The role of lattice anion vacancies in the activation of CO and as the catalytic site for methanol synthesis over zirconium dioxide and yttria-doped zirconium dioxide[J].Journal of Catalysis,1989,118:400-416.
Advance in research on reaction mechanism and active sites for methanol synthesis
BAI Shaofen,LIU Xinmei,YAN Zifeng
(State Key Laboratory for Heavy Oil Processing,Key Laboratory of Catalysis,CNPC,China University of Petroleum,Qingdao 266555,Shandong,China)
Methanol is an important organic chemical and fuel for transportation and mobile devices. When used as a fuel,it is a cleaner energy compared with most other energy sources. Although methanol synthesis has attracted worldwide research interest in the past 40 years,the synthesis mechanism and the nature of active sites are yet to be fully understood. The current state of the reaction mechanism and active sites of methanol synthesis over Cu-based catalyst are reviewed in this paper. It will provide reference to the development of high-quality catalysts.
methanol synthesis;mechanism;active sites;Cu-based catalysts
O 643.31
A
1000–6613(2011)07–1466–07
2010-12-17;修改稿日期:2011-01-14。
白绍芬(1986—),女,硕士研究生。联系人:刘欣梅,教授。E-mail lxmei@upc.edu.cn。
