互花米草对苏北滨海湿地表土有机碳更新的影响
2011-10-20张耀鸿张富存周晓冬谢晓金王小巍南京信息工程大学应用气象学院江苏南京210044
张耀鸿,张富存,周晓冬,谢晓金,王小巍,李 强,雷 俊 (南京信息工程大学应用气象学院,江苏 南京210044)
互花米草对苏北滨海湿地表土有机碳更新的影响
张耀鸿*,张富存,周晓冬,谢晓金,王小巍,李 强,雷 俊 (南京信息工程大学应用气象学院,江苏 南京210044)
自互花米草引入苏北滨海湿地后,逐渐替代本土植物盐蒿并形成单一植被的互花米草湿地.选择苏北地区盐蒿湿地及不同生长年限的互花米草湿地,采集其表层土壤样品,分别测定全土和分离的土壤粒径组分中总有机碳及 δ13C值,分析湿地土壤有机碳浓度及其同位素组成的变化.结果表明,互花米草引入盐蒿湿地后,表层土壤有机碳浓度显著增加(增量达 70%),且随着互花米草生长时间延长而明显增加.与盐蒿湿地相比,互花米草湿地土壤中大团聚体(>250μm)和微团聚体组分(53~250μm)有机碳浓度均显著增加,而粉粒组分(2~53μm)则无明显变化.互花米草湿地土壤原状土及各粒径组分的 δ13C值均明显高于盐蒿土壤,源于互花米草的新碳在各粒径组分中均有分布,但主要富集在大团聚体组分中,占该组分总碳的31%~43%,说明互花米草生长对土壤有机碳浓度增加主要反映在粗粒径组分中,而对粉、黏粒组分则影响较小.
δ13C值;互花米草;滨海湿地;有机碳更新
滨海湿地作为海陆过渡带,人类活动的影响较为剧烈,生态环境脆弱,自然灾害频繁,是全球变化的敏感区域[1].该生态系统中碳的生物地球化学过程已经日益成为陆地生态系统碳循环研究领域的热点问题之一.
江苏沿海滩涂湿地面积达到 6524km2,约占全国滩涂面积的1/4左右[2].为了达到海岸防护、保滩促淤的目的,我国于1982年人为把互花米草(Spartina alterniflora)从原产地美国引种到江苏沿海滩涂[3].互花米草具有光合能力强、环境适应性强等特点.与当地土著植物盐蒿相比,竞争力显著,其不断侵入当地土著植物盐蒿生长的区域并最终替代,形成单一的互花米草群落.这种植物种类的变更不仅改变了生态系统的结构、功能和物质转化过程[4],而且也改变了土壤有机碳库的大小和结构.高建华等[5]和 Cheng等[6]的测定结果表明,互花米草与土著植物相比,更有利于土壤有机碳的积累.
土壤是陆地生态系统重要的碳库,在全球碳循环过程中发挥着重要作用.土壤有机碳的转化过程和固持机制是土壤学研究的核心内容之一[7].对草地、草地开垦为农田和草地先开垦为农田再恢复为草地后土壤中有机碳含量的比较研究发现,有机碳含量以长期用作草地的土壤最高,而用作农田的土壤最低.草地土壤中有机碳含量高是因为土壤大团聚体中以及与粉沙结合的有机碳多[8].Liao等[9]进一步研究发现,土壤大团聚体是很不稳定的,因为形成大团聚体的结合剂主要是植物根系分泌物、真菌菌丝、多聚糖等土壤中的活性有机碳.土壤一旦受到扰动,该部分有机碳极易分解,使得这些将微团聚体结合在一起的有机碳消失,大团聚体就会分散成为微团聚体;相反,微团聚体则由淀积时间相对较长且抗分解能力强的有机物质组成[10-11].研究结果似乎表明土壤颗粒越小,其中的有机碳被固持得越牢固.但是,Christensen等[12]则发现,粉沙结合有机碳的可分解性明显低于黏粒结合的有机碳.因为部分与黏粒结合的有机碳包括C/N小的碳水化合物、脂肪和羰基物质[13].Galdo等[14]认为,粉沙和黏粒等细颗粒组分中的有机碳存留时间长不完全是因为以前直接进入该组分的有机碳一直长久地被保存了,而是其它较大颗粒组分中比较老的有机碳(或者分解的中间产物)不断转入到该部分所致.
本研究分析盐蒿湿地被互花米草替代后土壤粒径组分的有机碳分布变化,并利用13C同位素分析方法比较互花米草生长不同年份后,土壤粒径组分中不同来源有机碳的分布与动态,为阐明互花米草入侵我国湿地后土壤碳固定效应的机理提供理论依据.
1 材料与方法
采样点为江苏省大丰市王港口潮滩湿地(33°12′N,120°48′E).该地区潮汐为典型的正规半日潮,潮滩地势平坦,研究区域内表土母质相同.原生植被为盐蒿;人工引种互花米草后生长面积不断扩展,逐渐替代盐蒿并形成生长不同年份的互花米草湿地.利用TM卫星影像资料和GPS野外定位的方法,确定了形成成片互花米草湿地的各个时期.本试验选用互花米草 1995、1997和2001年替代盐蒿的区域作为采样点(分别表示为SA-14,SA-12和 SA-8),与一直生长盐蒿的区域(表示为Ref)进行比较.于2008年10月用土壤采样器分别从以上 4个区域采集表土(0~10cm)样品.每个区域设3个采样点,每个点采集3份样品,野外混匀后获得混合样.拣出植物根系后带回实验室.其中一部分样品风干磨细过100目筛,测定总有机碳含量和稳定性同位素 δ13C 值.另一部分原状土作土壤团聚体粒径组分的分离.
1.2 土壤团聚体粒径组分样品的制备
依据 Stemmer对团聚体颗粒组的分离方法[15],团聚体颗粒组的分级从粗到细依次为:>250μm,53~250μm,2~53μm和<2μm.将采集的原状土壤样品拣去植物碎片和根系,称取土样100.0g,置于盛有 250mL蒸馏水的烧杯中,浸泡12h后用超声波发生器低能量(170J/min)分散5min.然后用湿筛法分离出>250μm 和 53~250μm的团聚体组分,然后采用离心法分离出 2~53μm和<2μm 土壤粒径组分.将各土壤组分于 60℃烘干后称重.用部分干燥后的样品在玛瑙研钵中磨碎后过 100目筛(磨前再拣去可见有机碎屑),用于测定有机碳含量和δ13C值.
1.3 有机碳及同位素测定
原状土壤以及土壤组分的有机碳含量采用外湿热滴定法测定.有机碳的δ13C值用MAT253质谱仪测定.采用 PDB标准,测定误差≤0.1‰,δ13C (PDB)值由国际标准形式给出:
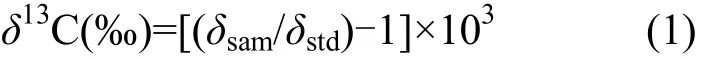
式中, R = (13C/12C), δsam为样品的相对丰度, δstd为标准样品的相对丰度.
1.4 不同来源有机碳的计算
互花米草入侵盐蒿湿地后,进入土壤的新有机物质相对富集13C,故可根据所测土壤样品的δ13C‰( PDB),依式(2)计算出源于盐蒿的土壤有机碳(SOC3)和源于互花米草的土壤有机碳(SOC4)各占的比例.
使用氯霉素快速检测试纸条及LC-MS/MS评价金标记BLI方法的可靠性,检测20份两个加标水平的牛乳样品中氯霉素残留,金标记BLI与所采用的对照方法的结果见表1,其灵敏度优于胶体免疫层析试纸条,检测结果与LC-MS/MS一致。
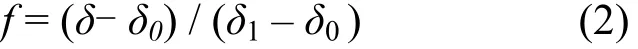
式中,δ为所测土壤样品的δ13C值;δ0为对比样品的δ13C值;δ1为C4植物的δ13C值; f为SOC4所占比例.
1.5 统计分析
试验数据采用Excel 2003进行计算与分析,用统计软件SPSS13.0进行显著性检验和相关性分析.
2 结果与讨论
2.1 总有机碳浓度及δ13C值
从表 1可以看出,互花米草湿地的总有机碳储量显著高于盐蒿湿地,并且随着生长时间的延长增加量达到70%.互花米草生长12a和14a的土壤有机碳含量没有差异,可能与生长年限相差较短有关.根据表 1可以计算出互花米草替代盐蒿后 0~10cm 表层土壤有机碳的年累积速率为0.142g/kg,固碳能力为 213kg/(hm2⋅a),远高于我国农田的平均固碳能力[151kg/(hm2⋅a)][16].土壤有机碳δ13C值的变化是光合途径不同的植物对地表净初级生产力相对贡献的综合结果[17],地面植物种类是制约土壤有机质δ13C 值变化的决定因素.因此,在地表植物种类长期稳定条件下,表层土壤有机质的δ13C值强烈受到植物δ13C值的影响[18].不同来源的土壤有机质也具有明显的 δ13C值差异(长期生长 C3植物条件下,介于-24‰~-29‰,而生长 C4植物则介于-9‰~-15‰)[19].因此本试验中 4个试验点气候环境条件相同,可以通过分析米草入侵后湿地土壤的同位素组成变化来研究有机碳的更新特征.

表1 不同类型湿地土壤容重、有机碳浓度、C/N、δ13C值以及C4新碳的贡献率 (f 值)Table 1 Bulk density,SOC concentration,C/N ratios and δ13C values of different community and contribution (f value) of invasive Spartina alterniflora (C4plant) to the SOC in coastal wetlands
互花米草侵入盐蒿湿地后,由于互花米草植物本身重碳的影响,互花米草湿地表层土壤有机碳的δ13C值显著高于一直生长盐蒿的湿地土壤.根据式(2)可以计算出,互花米草湿地表层土壤中源于互花米草的新碳随着侵入后生长年份的增长而显著增加,达到10.8%~18.7%.说明互花米草入侵盐蒿湿地后,来自互花米草的新碳积累是总有机碳浓度增加的重要因素.盐蒿和互花米草湿地土壤的C/N存在显著差异,这是因为互花米草植株C/N值比土著植物盐蒿高,说明地表植被有机物性质是湿地土壤有机质 C/N值发生变化的重要因素.4个试验区表层土壤的容重为1.38~1.41g/cm3,表明沿海湿地植被演替对土壤容重没有影响.
2.2 土壤组分有机碳及δ13C值
土壤颗粒组分在土壤有机碳的稳定性上起重要作用,同时又影响土壤结构和有机碳的周转[20-21].有机碳被团聚体包裹后或者以颗粒形式存在于孔隙中,或者直接与组成微团聚体的矿物颗粒密切联系. 大团聚体(>250μm)孔隙度较大,其充足的空气和水分使得有机碳周转速率很快;而微团聚体(53~250μm)的孔隙度通常小于细菌尺寸,其有机碳的降解只能依靠胞外酶进行,因而周转速率低;砂、黏粒土壤组分(<53μm)中,有机碳受微生物活动影响很小,其周转速率最低[20].Carter[22]研究结果表明,不同土壤颗粒组分上的有机碳受到物理保护程度的顺序为:黏砂粒结合态>微团聚体结合态>大团聚体结合态>游离态.

表2 湿地土壤不同粒径组分的有机碳浓度、C/N以及δ13C值Table 2 Carbon concentration,C/N ratios and δ13C values in the particle-size fractions from different communities in the 0~10cm soil layer in Wanggang coastal wetlands
由表 2可见,互花米草湿地土壤的大、微团聚体组分的有机碳浓度均显著高于盐蒿湿地土壤,且随着互花米草生长时间的增加,有机碳浓度明显增大;而砂粒土壤组分有机碳含量则没有差异;黏粒组分中,有机碳浓度呈现出盐蒿湿地土壤高于互花米草湿地土壤.这说明互花米草替代盐蒿后,大、微团聚体组分有机碳浓度增大是总有机碳浓度增加的主要原因,在大团聚体中有机碳浓度增幅最为明显,达到173%~224%.Six等[20]研究证实,土地利用方式、植被变化等措施的影响首先在大团聚体级别上体现出来,而微团聚体内的有机碳则维持在较稳定的水平.盐蒿土壤各粒径组分C/N均小于互花米草土壤,而且随着土壤粒径增加这种差异趋势愈发明显,可能与表层土壤受植被有机物C/N影响有关.盐蒿湿地土壤有机碳 δ13C值受 C3植物有机碳的影响,介于-22.7‰~-24.0‰之间,明显低于互花米草湿地土壤.互花米草土壤的δ13C值随着入侵年限延长逐渐增加,且在不同粒径组分中以大团聚体有机碳的 δ13C 值为最大,达到-19.4‰,说明粗粒径组分有机碳的δ13C值受植物有机物的影响最大.
2.3 土壤有机碳分布
土壤各粒径组分对有机碳的固存起着重要作用.Schulten等[23]指出,土壤中植物的根系以及分泌物对新鲜的有机碳保护和粗团聚体颗粒的形成有重要作用.从图1看出,互花米草土壤各粒径组分的有机碳浓度随着互花米草生长时间延长而增加;与盐蒿土壤相比,互花米草湿地土壤>250μm 团聚体组分中,有机碳浓度提高了10~11.5倍.4个湿地的微团聚体有机碳浓度则没有显著差异,说明互花米草入侵盐蒿湿地后增加的有机碳主要积累到大团聚体中.
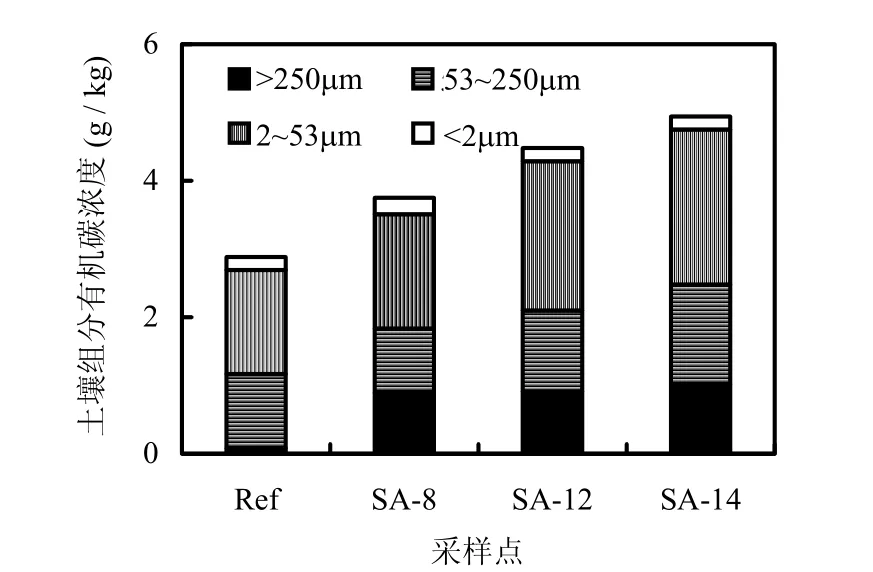
图1 有机碳在各土壤粒径组分中的分布Fig.1 Carbon content of the particle-size fractions of the 0~10cm soil layer
根据土壤粒径组分稳定性同位素的变化,按照式(2)可以计算出米草土壤组分中不同来源(盐蒿或互花米草)有机碳的百分比.各个土壤组分中均有来自盐蒿或互花米草的有机碳,且来自互花米草的有机碳在各个组分中均随着互花米草生长时间延长而增大.大团聚体、微团聚体、粉粒和黏粒中来自互花米草的有机碳分别占组分总碳的 30.6%~42.9%、12.2%~19.7%、9.4%~12.3%和 4.8%~6.6%,说明来源于互花米草的新碳主要集中在大团聚体组分中,黏粒和粉粒组分中少有积累.已有研究结果发现[24],草原和森林土壤中原先被物理保护的有机碳不稳定,新碳主要进入粗的团聚体中.本试验中,植被演替引起的土壤有机碳更新主要反映在大团聚体碳组分的变化,新碳主要是被粗团聚体所物理保护.说明滨海湿地土壤中被大团聚体组分物理保护的碳对于植被变化十分敏感,互花米草引入后对于提高沿海湿地有机碳汇潜力具有积极意义.

图2 土壤各粒径组分中源于盐蒿和互花米草的有机碳浓度以及百分比Fig.2 Concentrations and percents of Suaeda salsa- and Spartina alterniflora-derived SOC for each particle-size fraction from the 0~10cm layer across the chronosequence
3 结论
3.1 互花米草引入盐蒿湿地后,0~10cm 土壤表层的有机碳浓度明显增加,且随着生长时间延长而增加.估算出表土有机碳的积累量达 213kg/(hm2⋅a),与国内其他沿海地区的互花米草湿地有机碳含量增加趋势相同,说明互花米草入侵后生长促进了苏北滨海湿地土壤有机碳汇的增加.
3.2 互花米草替代盐蒿后,土壤不同粒径组分有机碳浓度发生了明显变化,大团聚体作为土壤中相对活跃的碳库,是受植被变化影响最显著的组分,互花米草生长后,这个土壤组分有机碳浓度显著提高,使得土壤中固碳过程与碳更新主要反映在大团聚体粒径组分上的变化.互花米草新碳主要积累在大团聚体中,随着土壤粒径减小新碳所占比例也相应减小.稳定性同位素的结果也支持了大团聚体是新碳固存的主要组分.这可能与互花米草入侵时间较短新碳还没充分向细粒径组分中转移、老化有关.
[1] Belhassen M. Spatial and temporal variability in nutrients and suspended material processing in the Fierd. Ars Bay [J]. Estuarine,Coastal and Shelf Science, 2001,52:457-469.
[2] 徐向红.江苏沿海滩涂后备土地资源的开发研究 [M]. 北京:海洋出版社, 2001,25:23-25.
[3] 钦 佩,仲崇信.米草的应用研究 [M]. 北京:海洋出版社, 1992,158.
[4] Windham L, Ehrenfeld J G. Net impact of a plant invasion on nitrogen-cycling processes within a brackish tital marsh [J].Ecological Application, 2003,13:883-897.
[5] 高建华,杨桂山,欧维新.互花米草引种对苏北潮滩湿地 TOC、TN和TP分布的影响 [J]. 地理研究, 2007,26:799-808.
[6] Cheng X L, Luo Y, Chen J Q, et al. Short-term C4plant Spartina alterniflora invasions change the soil carbon in C3plantdominated tidal wetlands on a growing estuarine Island [J]. Soil Biology and Biochemistry, 2006,38:3380-3386.
[7] 潘根兴,周 萍,李恋卿,等.固碳土壤学的核心科学问题与研究进展 [J]. 土壤学报, 2007,44:327-337.
[8] Allison S D, Jastrow J D. Activities of extracellular enzymes in physically isolated fractions of restored grassland soils [J]. Soil Biology and Biochemistry, 2006,38:3245-3256.
[9] Liao J D, Boutton T W, Jastrow J D. Organic matter turnover in soil physical fractions following woody plant invasion ofgrassland: evidence from natural13C and15N [J]. Soil Biology and Biochemistry, 2006,38:3197-3210.
[10] John B, Yamashita T, Ludwig B, et al. Storage of organic carbon in aggregate and density fractions of silty soils under different types of land use [J]. Geoderma, 2005,128:63-79.
[11] Six J, Jastrow J D. Organic matter turnover [C]// Encyclopedia of soil science, New York: Marcel Dekker, 2002:936-942.
[12] Christensen B T, Sorensen L H. The distribution of native and labeled carbon between soil particle size fractions isolated from long-term incubation experiments [J]. Journal of Soil Science,1985,36:219-229.
[13] Golchin A, Oades J M, Skjemstad J O, et al. Soil structure and carbon cycling [J]. Australian Journal of Soil Research,1994,32:1043-1068.
[14] Galdo D, Six J, Peressotti A, et al. Assessing the impact of land use change on soil C sequestration in agricultural soils by means of organic matter fractionation and stable C isotopes [J]. Global Change Biology, 2003,9:1204-1213.
[15] Stemmer M, Gerzabek M H, Kandeler E. Organic matter and enzyme activity in particle-size fractions of soils obtained after low-energy sonication [J]. Soil Biology and Biochemistry,1998,30:9-17.
[16] Xie Z B, Zhu J G, Liu G, et al. Soil organic carbon stocks in China and changes from 1980s to 2000s [J]. Global Change Biology, 2007,13:1989-2007.
[17] Boutton T W, Archer S R, Midwood A J, et al. δ13C values of soil organic carbon and their use in discriminating vegetation change in a subtropical savanna ecosystem [J]. Geoderma,1998,82:35-41.
[18] Lefroy R D B, Graeme J B, Strong W M. Changes in soil organic matter with cropping as measured by organic carbon fractions and 13C natural isotope abundance [J]. Plant and Soil, 1993,155/156:399-402.
[19] Pessenda L C R, Aravena R, Melfi A J, et al. The use of carbon isotopes (13C,14C) in soil to evaluate vegetation changes during the Holocene in central Brazil [J]. Radiocarbon, 1996,38:191-201.
[20] Six J, Elliott E T, Paustian K, et al. Aggregation and soil organic matter accumulation in cultivated and native grassland soils [J].Soil Science Society of America Journal, 1998,65:1367-1377.
[21] Hassink J. The capacity of soils to preserve organic C and N by their association with clay and silt particles [J]. Plant and Soil,1997,191:77-87.
[22] Carter M R. Soil quality for sustainable land management:organic matter and aggregation interactions that maintain soil function [J]. Agronomy Journal, 2002,94:38-47.
[23] Schulten H R, Leinweber P. New insights into organic mineral particles: Composition, properties and models of molecular structure [J]. Biology and Fertility of Soils, 2000,30:399-432.
[24] Liao J D, Boutton T W, Jastrow J D. Storage and dynamics of carbon and nitrogen in soil physical fractions following woody plant invasion of grassland [J]. Soil Biology and Biochemistry,2006,38:3184-3196.
Effects of plant invasion along a Spartina alterniflora chronosequence on organic carbon dynamics in coastal wetland in north Jiangsu.
Z HANG Yao-hong*, ZHANG Fu-cun, ZHOU Xiao-dong, XIE Xiao-jin, WANG Xiao-wei, LI Qiang, LEI Jun (College of Applied Meteorology, Nanjing University of Information Science and Technology, Nanjing 210044, China). China Environmental Science, 2011,31(2):271~276
Spartina alterniflora, an invasive grass, had rapidly replaced native plant Suaeda salsa since its intentional introduction to the coastal wetlands in Eastern China. Impacts of plant invasion along a Spartina alterniflora chronosequence on soil organic carbon (SOC) dynamics were investigated. The concentrations of SOC in bulk soil increased 70% from 2.89g/kg soil in remnant Suaeda salsa-vegetated soil to 4.90g/kg in 14-year Spartina alterniflora soil,and these values enhanced significantly along its chronosequence. The increase mainly resulted from a high quantity of organic residues incorporated in the soil. Compared with Suaeda salsa-vegetated soil, The SOC concentration increased significantly in coarse fraction (>250μm and 53~250μm) of Spartina alterniflora-vegetated soil, while there was no obvious difference in fine fraction (2~53μm). The δ13C values of SOC for either bulk soil or particle-size fractions were evidently higher in Spartina alterniflora-vegetated soil than in Suaeda salsa-vegetated soil. There was Spartina alterniflora-derived C in all particle-size fraction, however 31%~43% of the Spartina alterniflora-derived C distributed in the coarse fraction (>250μm). It was concluded in this study that Spartina alterniflora invasion significantly promoted SOC accumulation of surface soil in coastal wetland, and new C accumulation profoundly resulted in increasing SOC concentration of the coarse fraction (>250μm).
δ13C value;Spartina alterniflora;coastal wetland;organic carbon dynamics
X53
A
1000-6923(2011)02-0271-06
2010-06-02
江苏省高校自然科学研究计划项目(08KJB210001);土壤与农业可持续发展国家重点实验室开放课题(Y052010031)
∗ 责任作者, 副教授, yhzhang@nuist.edu.cn
张耀鸿(1977-),男,山西汾阳人,副教授,博士,主要从事陆地生态系统温室气体排放与全球变化研究.发表论文8篇.
