黄粉虫油对高脂血症小鼠血脂水平及抗氧化能力的影响
2011-10-18张建新张立佳王临宾林福壁
张建新,张立佳,王临宾,林福壁,朱 杰
(西北农林科技大学食品科学与工程学院,陕西 杨凌 712100)
黄粉虫油对高脂血症小鼠血脂水平及抗氧化能力的影响
张建新,张立佳,王临宾,林福壁,朱 杰
(西北农林科技大学食品科学与工程学院,陕西 杨凌 712100)
目的:探讨黄粉虫油对高脂血症小鼠血脂水平及抗氧化能力的影响。方法:以高脂饲料喂养雄性ICR小鼠,建立高脂血症模型,以不同剂量(5、10、20mL/(kg·d))的黄粉虫油对小鼠进行灌胃,观察各实验组小鼠血脂水平和肝脏抗氧化能力的变化情况。结果:黄粉虫油能显著降低高脂血症小鼠血清总胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白胆固醇(LDL-C)浓度,升高高密度脂蛋白胆固醇(HDL-C)的浓度,同时动脉粥样硬化指数(AI) 亦显著降低;黄粉虫油能降低小鼠肝脏丙二醛(MDA)含量,增加肝脏过氧化氢酶(CAT)、超氧化物歧化酶(SOD)及谷胱甘肽过氧化物酶(GSH-Px)的活性,提高肝脏总抗氧化(T-AOC)能力。结论:黄粉虫油具有调节血脂和增强抗氧化功能的作用。
黄粉虫油;高脂血症;血脂水平;抗氧化
研究表明,冠心病和动脉粥样硬化等多种心脑血管疾病都可由高脂血症所引发[1-2],同时高脂血症也是导致脂肪肝的重要因素之一。临床研究证实,通过膳食和药物干预可以有效地降低高脂血症发病的可能性,然而多数降脂药物带有毒副作用,长期服用会对人体健康产生危害,而采用天然食物来调节血脂是安全可行的[3]。因此,开发具有降血脂功效的保健食品具有十分重要的意义。黄粉虫(Tenebrio molitor.Linneeus)属节肢动物门、昆虫纲、拟步行科、粉甲属、又称面包虫[4]。黄粉虫油中含有丰富的不饱和脂肪酸[5-7],已有研究证明,不饱和脂肪酸有抗动脉粥样硬化和调整血脂的作用[8-10]。俞巍蔚等[11]研究发现,黄粉虫幼虫粉能够显著降低高血脂大鼠血清中总胆固醇(TC)、甘油三酯(TG)的浓度,李汉臣等[12]报道索提黄粉虫油及油渣能够延长小鼠的游泳时间,而黄粉虫油的降血脂作用和抗氧化功效的研究未见报道。前期研究通过体外抗氧化研究发现,黄粉虫油对DPPH自由基、·OH和O2·具有较好的清除作用。本实验利用实验性高脂血症小鼠模型,探讨黄粉虫油对血脂代谢及抗氧化能力的影响,旨在为黄粉虫油的功能利用提供科学依据。
1 材料与方法
1.1 材料、试剂与仪器
黄粉虫幼虫 陕西秦虫黄粉虫科技发展有限公司;清洁级雄性ICR小鼠50只[平均体质量(25±2)g] 第四军医大学实验动物中心;基础饲料 第四军医大学实验动物中心;高脂饲料:83.9%基础饲料、10%蛋黄粉、5%猪油、1%胆固醇和0.1%猪胆盐。
血清总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)测定试剂盒 温州东欧生物工程有限公司;组织总抗氧化能力(T-AOC)、超氧化物歧化酶活力(SOD)、谷胱甘肽过氧化物酶(GSH-Px)、过氧化氢酶(CAT)、丙二醛(MDA)、考马斯亮兰蛋白测定试剂盒 南京建成生物工程研究所。
FA2004分析天平 北京赛多利斯仪器系统有限公司;PM180R低速离心机 科大创新股份有限公司中佳分公司;HHS恒温水浴锅 江苏常熟医疗器械有限公司;XJA-2A型(致冷式)微型粉碎机 姜堰市银河仪器厂;XK96-B涡流混匀器 深圳市瑞鑫达科教仪器厂;UV-721紫外-可见分光光度计 日本岛津公司。
1.2 方法
1.2.1 黄粉虫油的制备[13]
黄粉虫幼虫60℃烘干粉碎后,采用水酶法在50℃条件下提取2h得到淡黄色透明黄粉虫油,提取率为78.51%,经GC-MS分析之后,不饱和脂肪酸含量为76.22%,油酸含量43.31%,亚油酸含量27.38%。
1.2.2 实验设计与分组
健康雄性ICR小鼠50只,平均体质量(25±2)g,基础饲料适应性喂养7d后,根据体质量随机分为5组:正常对照组(NC)、高脂模型组(HF)、黄粉虫油低剂量组(LD)、黄粉虫油中剂量组(MD)和黄粉虫油高剂量组(HD),每组10只。正常对照组进食基础饲料,其余4组进食高脂饲料。其中黄粉虫油低、中、高剂量组用黄粉虫油分别按5、10、20mL/(kg·d)剂量灌胃,正常对照组灌以20mL/(kg·d)剂量的蒸馏水,连续灌胃30d。实验组小鼠按组别同室分笼饲养,环境温度25℃左右,湿度60%左右,每隔2d更换1次垫料,给予充足的光照,自由饮水与进食。
1.2.3 指标测定
实验期间每周称量记录小鼠体质量,实验结束时,小鼠处死前12h禁食,称质量后摘眼球取血,4000r/min离心15min,分离血清,分装后于-20℃冷冻保存备用。小鼠取血后,颈椎脱臼处死并分离肝脏,经生理盐水洗去污血后用滤纸吸干,称质量后于-20℃保存备用。TG、TC、HDL-C、LDL-C、T-AOC、SOD、GSH-Px、CAT、MDA的测定均按照试剂盒说明书进行。按式(1)、(2)计算动脉粥样硬化指数(AI)[14]与肝脏指数。

1.3 统计分析
2 结果与分析
2.1 黄粉虫油对小鼠体质量和肝脏指数的影响

图1 黄粉虫油对小鼠体质量的影响(±s,n=10)Fig.1 Effect of Tenebrio molitor oil on body weight of mice (x± s,n=10)

图2 黄粉虫油对小鼠肝脏指数的影响(±s,n=10)Fig.2 Effect of Tenebrio molitor oil on liver index of mice (x± s,n=10)
实验期间,各组小鼠生长正常。由图1可知,灌胃黄粉虫油高、中、低剂量组小鼠体质量增长均低于高脂模型组小鼠,但无统计学差异(P>0.05)。由图2可知,黄粉虫油各剂量组小鼠肝脏指数亦均低于高脂模型组,低剂量组与高脂模型组无统计学差异,中剂量组和高剂量组显著低于高脂模型组(P<0.05或P<0.01)。由此表明,黄粉虫油对高脂血症小鼠的肝脏指数具有明显的降低作用,但对小鼠体质量的影响并不显著。
2.2 黄粉虫油对小鼠血脂水平的影响
由表1、2可知,高脂模型组小鼠血清TC、TG、LDL-C显著高于正常对照组(P<0.05或P<0.01),HDL-C显著降低(P<0.01),AI显著增高(P<0.01)增高,表明高脂血症小鼠模型诱导成功。
表1 黄粉虫油对小鼠血清TC、TG水平的影响(±s, n=10)Table 1 Effect of Tenebrio molitor oil on serum TC and TG levels of mice (±s, n=10)

表1 黄粉虫油对小鼠血清TC、TG水平的影响(±s, n=10)Table 1 Effect of Tenebrio molitor oil on serum TC and TG levels of mice (±s, n=10)
注:a.与高脂模型组比较,有显著性差异(P<0.05);b. 与高脂模型组比较,有极显著性差异(P<0.01)。下同。
组别 灌胃剂量/(mL/(kg·d)) TC浓度/(mmol/L)TG浓度/(mmol/L)正常对照组 0 1.83±0.52b 0.79±0.28a高脂模型组 0 3.68±0.56 1.20±0.38低剂量组 5 2.93±0.72a 0.82±0.14a中剂量组 10 2.80±0.79a 0.60±0.16b高剂量组 20 2.34±0.56b 0.55±0.11b
由表1 可知,3个黄粉虫油剂量组小鼠血清TC含量均显著低于高脂模型组(P<0.05或P<0.01),表明黄粉虫油有抑制高脂饲喂小鼠血清TC含量升高的效果,且高剂量组好于中、低剂量组;与高脂模型组比较,3个剂量组小鼠血清TG也有显著差异(P<0.05或P<0.01),表明黄粉虫油能够抑制高脂饲喂小鼠血清TC含量升高,且剂量越高效果越明显。
表2 黄粉虫油对小鼠血清HDL-C, LDL-C 及AI的影响(±s,n=10)Table 2 Effect of Tenebrio molitor oil on serum HDL-C, LDL-C and AI of mice (x-± s, n=10)

表2 黄粉虫油对小鼠血清HDL-C, LDL-C 及AI的影响(±s,n=10)Table 2 Effect of Tenebrio molitor oil on serum HDL-C, LDL-C and AI of mice (x-± s, n=10)
组别 灌胃剂量/ HDL-C浓度/ LDL-C浓度/ AI(mL/(kg·d)) (mmol/L) (mmol/L)正常对照组 0 1.65±0.12b 0.74±0.12b 0.43±0.10b高脂模型组 0 1.24±0.11 1.24±0.22 0.98±0.23低剂量组 5 1.37±0.08a 1.02±0.15a 0.75±0.13a中剂量组 10 1.45±0.14b 0.99±0.08a 0.68±0.06b高剂量组 20 1.59±0.12b 0.85±0.16b 0.53±0.11b
由表2可知,与高脂模型组比较,黄粉虫油高、中、低剂量组小鼠血清LDL-C显著降低(P<0.05或P<0.01),HDL-C显著升高(P<0.05或P<0.01),AI显著降低(P<0.05或P<0.01),表明黄粉虫油有显著降低血清LDL-C、AI和升高HDL-C的作用,且剂量越高效果越好。
2.3 黄粉虫油对小鼠肝脏抗氧化能力的影响
由表3可知,与正常对照组比较,高脂模型组小鼠肝脏T-AOC、CAT及GSH-Px活性显著降低(P<0.05或P<0.01)。黄粉虫油高、中、低剂量组小鼠肝脏CAT活性与高脂模型组均有显著差异(P<0.01);与高脂模型组比较,黄粉虫油中、高剂量组小鼠肝脏T-AOC、GSH-Px活性显著升高(P<0.05或P<0.01),低剂量组与高脂组差异不显著(P>0.05),表明黄粉虫油能够增加肝脏T-AOC、CAT及GSH-Px活性,提高肝脏抗氧化能力。
表3 黄粉虫油对小鼠肝脏T-AOC, CAT及GSH-Px活性的影响(±s, n=10)Table 3 Effect of Tenebrio molitor oil on the activities of T-AOC, CAT and GSH-Px in liver of mice (± s, n=10)
组别 灌胃剂量/T-AOC活力/ CAT活力/ GSH-Px活力/(mL/(kg·d)) (U/mg pro) (U/mg pro) (U/mg pro)正常对照组 0 1.34±0.13b 25.62±4.78b371.49±57.41a高脂模型组 0 1.00±0.14 17.95±4.72 314.39±31.91低剂量组 5 1.26±0.33 25.33±4.19b344.39±28.41中剂量组 10 1.31±0.29a 27.45±5.46b357.18±32.35a高剂量组 20 1.39±0.11b 32.70±6.27b368.87±47.25a
表4 黄粉虫油对小鼠肝脏SOD活性、MDA含量的影响(±s, n=10)Table 4 Effect of Tenebrio molitor oil on SOD activity and MDA content of mice (± s, n=10)
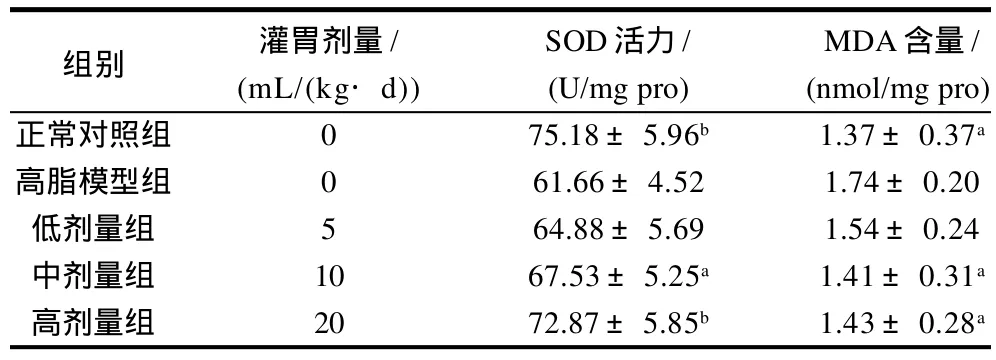
表4 黄粉虫油对小鼠肝脏SOD活性、MDA含量的影响(±s, n=10)Table 4 Effect of Tenebrio molitor oil on SOD activity and MDA content of mice (± s, n=10)
组别 灌胃剂量/ SOD活力/ MDA含量/(mL/(kg·d)) (U/mg pro) (nmol/mg pro)正常对照组 0 75.18±5.96b 1.37±0.37a高脂模型组 0 61.66±4.52 1.74±0.20低剂量组 5 64.88±5.69 1.54±0.24中剂量组 10 67.53±5.25a 1.41±0.31a高剂量组 20 72.87±5.85b 1.43±0.28a
由表4可知,高脂模型组小鼠肝脏SOD活性显著低于正常对照组(P<0.01),MDA含量显著升高(P<0.05)。与高脂组模型比较,黄粉虫油低剂量组小鼠肝脏SOD活性差异不显著(P>0.05),中、高剂量组小鼠肝脏SOD活性显著升高(P<0.05或P<0.01);黄粉虫油低剂量组小鼠肝脏MDA含量与高脂模型组无显著差异(P>0.05),中、高剂量组小鼠肝脏MDA含量显著低于高脂模型组(P<0.05),表明中等及以上剂量的黄粉虫油有显著升高肝脏SOD活性及降低MDA含量的作用。
3 讨 论
本实验通过饲喂高脂饲料诱导小鼠高脂血症模型研究黄粉虫油对小鼠血脂水平和抗氧化能力的影响。结果显示,黄粉虫油能够显著降低血清TC、TG、LDL-C含量,显著升高HDL-C含量,且存在明显的量效关系,表明黄粉虫油能够显著抑制高脂血症小鼠血脂的升高。黄粉虫油的主要成分是油酸、亚油酸等不饱和脂肪酸,能够起到调整血脂及预防动脉粥样硬化的作用。油酸具有比多不饱和脂肪酸更优的生理活性和更高的氧化稳定性,能够降低血清TG和TC水平;亚油酸是天然的生物活性物质,它能够促进胆固醇转化为盐类而排出体外,同样具有降低血清TG和总胆固醇TC的功效[14]。
研究表明,动脉粥样硬化的形成通常与脂质过氧化所造成的机体损伤有关。当机体抗氧化系统与氧化系统的平衡被破坏时,会形成大量的自由基,这些自由基会通过反应最终产生终产物MDA[15-16]。本研究结果显示,高脂模型组小鼠肝脏MDA含量显著增加,同时机体内几种重要的抗氧化酶类,如CAT、GSH-Px、SOD的活性显著下降,T-AOC降低,对机体内自由基的清除能力降低。由此推断,黄粉虫油可能是通过提高机体内几种重要的抗氧化酶的活性,清除体内的自由基,从而减少过多的自由基对机体所造成的损伤作用。
[1] CHISOLM G M, STEINBERG D. The oxidative modification hypothesis of atherogenesis: an overview[J]. Free Rdaic Biol Med, 2000, 31(2):1815-1826.
[2] 李克明. 流行病学进展: 第10卷[M]. 北京: 北京医科大学出版社,2002: 43-60.
[3] 严建刚, 张名位, 杨公明, 等. 芹菜提取物的降血脂与抗氧化作用的研究[J]. 中国食品学报, 2005, 5(3): 1-4.
[4] 陈耀溪. 仓库害虫[M]. 北京: 中国农业出版社,1989: 87.
[5] 代春华, 马海乐, 沈晓昆, 等. 黄粉虫幼虫及蛹中营养成分分析[J].食品工业科技, 2009, 30(4): 315-317.
[6] 黄琼, 周祖基, 周定刚, 等. 黄粉虫蛹的营养成分分析[J]. 四川动物,2006, 25(4): 809-812.
[7] 刘伟强, 罗来凌, 黄炳南. 黄粉虫幼虫营养成分分析[J]. 广州食品工业科技, 1999, 15(1): 56-57.
[8] 陈小夏, 何冰, 利红宇, 等. 月见草油对实验性高脂血症大鼠脂质代谢的影响[J]. 广东药学院学报, 1996, 12(2): 78-81.
[9] YAMAMOTO S, WANG Mingfu. Role of nucleosides and nucleo-tides in the immune system, gutreparation after injury, and brain function[J].Nutrition, 1997, 13(4): 372-374.
[10] 高洪源, 朱寿民. 蛋黄油对人体抗氧化作用的研究[J]. 杭州食品科技, 1995(3): 6-8; 11.
[11] 俞巍蔚, 李世敏, 刘冬, 等. 黄粉虫幼虫粉对高血脂大鼠血脂水平的影响[J]. 华南理工大学学报: 自然科学版, 2005, 3(1): 92-94.
[12] 李汉臣, 吉志新, 高素红, 等. 黄粉虫的营养保健作用初报[J]. 河北科技师范学院学报, 2007, 21(3): 17-21.
[13] 张立佳, 张建新, 王临宾. 水酶法提取黄粉虫油工艺优化[J]. 食品与发酵工业, 2010, 36(1): 166-170.
[14] 倪勇强, 庄建新. 蛋黄油的营养价值及其应用[J]. 全国食品添加剂通讯, 1991(3): 40-41.
[15] STOKE KY, COOPER D, TAILOR A , et al. Hypercholesterolesterolemia promotes imflammation and microvascular dysfunc-tion: Role of nitric oxide and superoxide[J]. Free Rdaic Biol Med, 2002, 33(8): 1026-1036.
[16] TANIYAMA Y, GRIENDLING K K. Reactive oxygen species in the vasculature: Molecular and cellular mechanisms[J]. Hypertension, 2003,42(6): 1075-1081.
Effect of Tenebrio molitor Oil on Blood Lipid and Antioxidant Function in Hyperlipidemic Mice
ZHANG Jian-xin,ZHANG Li-jia,WANG Lin-bin,LIN Fu-bi,ZHU Jie
(College of Food Science and Engineering, Northwest A&F University, Yangling 712100, China)
Objective: To explore the effect of Tenebrio molitor oil on blood lipid and antioxidant function in ICR male mice with hyperlipidemia. Methods: High fat diet was used to create a hyperlipidemic model. Fifty healthy male ICR mice were randomly divided into 5 groups of 10 each: normal control group (fed basal diet), high fat model group (fed high fat diet) and low-,middle- and high-dose Tenebrio molitor oil groups (fed high fat diet and administered intragastrically with Tenebrio molitor oil at doses of 5, 10 mL/(kg·d) and 20 mL/(kg·d), respectively). After 30 consecutive days of intragastric administration, all the mice were measured for their body weight, liver index, blood lipid levels and antioxidant function in liver. Results: Tenebrio molitor oil could reduce serum total cholesterol (TC), triglyceride (TG), and low-density lipoprotein cholesterol (LDL-C) levels as well as arteriosclerosis index (AI), and increase high-density lipoprotein cholesterol (HDL-C) level. It could also reduce the content of malondialdehyde (MDA) content, increase hepatic catalase (CAT), superoxide dismutase (SOD) and glutathione peroxidase (GSH-Px) activities, and improve liver total antioxidant capacity (T-AOC). Conclusion: Tenebrio molitor oil can regulate blood lipid and enhance antioxidant function.
Tenebrio molitor oil;hyperlipidemia;blood lipid;antioxidation
TS201.4
A
1002-6630(2011)05-0263-04
2010-07-05
张建新(1959—),男,教授,硕士,主要从事食品质量安全与标准化研究。E-mail:zhangjx59@foxmail.com
