山核桃壳棕色素的生物活性及其红外光谱分析
2011-10-18詹权胜
陈 晓,叶 明,*,陈 炜,杨 柳,方 勇,詹权胜
(1.合肥工业大学生物与食品工程学院,安徽 合肥 230009;2.安徽詹氏食品有限公司,安徽 宁国 242300)
山核桃壳棕色素的生物活性及其红外光谱分析
陈 晓1,叶 明1,*,陈 炜1,杨 柳1,方 勇2,詹权胜2
(1.合肥工业大学生物与食品工程学院,安徽 合肥 230009;2.安徽詹氏食品有限公司,安徽 宁国 242300)
用体积分数95%乙醇提取山核桃壳棕色素,经AB-8大孔树脂纯化后,对其生物活性及红外光谱进行研究。结果表明:质量浓度为3.0g/L时,山核桃壳棕色素的总抗氧化能力相当于126.65mmol/L α-生育酚;棕色素还原能力的EC50值(吸光度为0.5时的质量浓度)为0.286g/L;质量浓度为1.0g/L时,棕色素对·OH的清除率达到60.84%。抑菌实验表明:山核桃壳棕色素对酿酒酵母(Saccharomyces cerevisiae)、金黄色葡萄球菌(Staphylococcus aureus)、枯草芽孢杆菌(Bacillus subtilis)、大肠杆菌(Escherichia coli)、黑曲霉(Aspergillus niger)均有抑制作用,最低抑菌浓度分别为0.125、0.25、0.25、1.0、0.5g/L。红外光谱分析结果表明:该棕色素含有苯环和酚羟基结构。
山核桃壳;棕色素;生物活性;最低抑菌浓度
山核桃(Carya cathayensis)属胡桃科、胡桃属植物,分布于亚、欧、美等大洲[1-2],其中我国的山核桃主要产于浙皖交界的天目山区[3]。山核桃果仁风味独特,富含不饱和脂肪酸、蛋白质、矿质元素和维生素等,具有很高的营养价值和保健功能,而山核桃壳作为废弃物,目前大多被用作农户燃料和制备活性炭,利用度较低。
近年来学者们对山核桃壳、叶片等进行了研究,其中山核桃叶片和外果皮的提取物具有明显的抑菌作用[4-5],山核桃外蒲壳提取物对食用油脂具有明显的抗氧化作用[6],山核桃青果提取物对DPPH自由基和超氧阴离子自由基具有很强的清除作用,并对HL-60人类骨髓性白血病具有细胞毒性[2],然而对山核桃壳棕色素的生物活性及结构却关注甚少。本实验采用体积分数95%乙醇溶液对山核桃壳棕色素进行浸提,经大孔树脂纯化后对该棕色素的抗氧化活性、抑菌活性和红外光谱进行研究,为山核桃壳棕色素在食品与医药中的应用提供依据。
1 材料与方法
1.1 材料、供试菌株与试剂
山核桃壳由安徽省宁国市詹氏食品有限公司提供。
金黄色葡萄球菌(Staphylococcus aureus)、枯草芽孢杆菌(Bacillus subtilis)、大肠杆菌(Escherichia coli)、酿酒酵母(Saccharomyces cerevisiae)、黑曲霉(Aspergillus niger)由合肥工业大学微生物资源与应用研究室分离保藏。
AB-8大孔树脂 天津光复精细化工研究所。
1.2 山核桃棕色素的提取[7]
称取10g粉碎至60目的山核桃壳,加入50mL石油醚,25℃、180r/min振荡12h,以除去油脂、腊质等。重复两次,合并滤渣,干燥称质量。取一定量处理后的山核桃壳,用95%乙醇溶液,料液比为1:10,于80℃水浴回流4h。过滤,滤渣用等量溶剂同法再提取一次,合并滤液,旋转蒸发仪蒸至无醇味,定容至一定体积备用。
1.3 山核桃棕色素的纯化与鉴定
[8]方法进行单因素试验,最终选用AB-8大孔树脂对山核桃壳棕色素进行纯化(层析柱规格为16mm×60cm,湿法装柱,柱高40cm)。取50mL棕色素溶液进行动态吸附,控制流速为1mL/min,用60%乙醇进行洗脱,洗脱过程重复两次。收集洗脱液,旋转蒸发仪蒸至无醇味后得到山核桃棕色素纯品,用蒸馏水定容。取少量棕色素溶液,用SP-1901紫外-可见分光光度计在波长200~400nm范围内扫描。
1.4 山核桃壳棕色素的抗氧化活性
1.4.1 总抗氧化能力的测定
参考文献[9]方法并略作修改。0.3mL不同质量浓度样品溶液及3mL反应溶液(含0.6mol/L的硫酸、28mmol/L磷酸钠溶液及4mmol/L的钼酸铵溶液)放入具塞试管中,90℃水浴保温90min,冷却至室温后,于695nm波长处测吸光度(A)。空白管以0.3mL蒸馏水代替样品溶液。总抗氧化能力以当量α-生育酚表示,α-生育酚标准曲线为:A=0.011c+0.0049(R2=0.987),式中A为695nm波长处的吸光度,c为α-生育酚的当量浓度(mmol/L)。
1.4.2 还原能力的测定
参考文献[10]方法进行。
1.4.3 清除·OH能力的测定
参考文献[11]方法进行。
1.5 山核桃壳棕色素的抑菌活性
1.5.1 菌悬液的制备
上述供试菌种活化后,以无菌水制成含菌数约为1×105CFU/mL菌悬液。
1.5.2 抑菌活性
采用纸片扩散法[12]。分别取不同供试菌的菌悬液各0.1mL,均匀涂布在营养琼脂平板上,室温干燥5min,将经灭菌后的滤纸片平放于无菌平皿内每片滴加不同质量浓度棕色素溶液20μL,室温自然晾干,用无菌镊子取样片轻轻贴放于平板表面。金黄色葡萄球菌、枯草芽孢杆菌、大肠杆菌于37℃培养20h,黑曲霉和酵母菌于28℃培养48h后,观察并测量抑菌圈直径,以抑菌圈直径大小来衡量抑菌效果。无菌水作为对照。每个样品设3个平行样。
1.5.3 最低抑菌浓度(MIC)的测定
采用二倍稀释法测最低抑菌浓度[13]。将山核桃壳棕色素溶液加入液体培养基中,使各管色素溶液波长处质量浓度分别为1.0、0.5、0.25、0.125、0.0625g/L,然后将1×105CFU/mL大肠杆菌、金黄色葡萄球菌、枯草芽孢杆菌、黑曲霉和酿酒酵母接种于各试管中,培养箱内相应温度恒温培养 24h后,完全无菌生长的最高稀释度即为最低抑菌浓度。
1.6 山核桃壳棕色素的红外光谱测定
称取纯化的干燥棕色素2mg与400mg KBr混匀,在玛瑙钵体中研磨5~l0min,压片,在FT-IR6700傅里叶变换红外光谱仪上4000~400cm-1区间测定红外光谱。
2 结果与分析
2.1 山核桃壳棕色素的鉴定
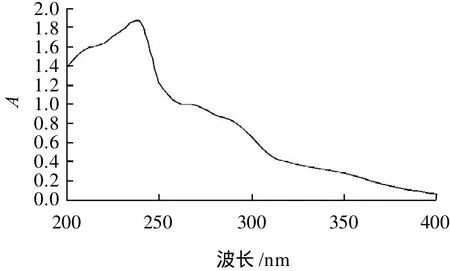
图1 山核桃壳棕色素的紫外吸收光谱Fig.1 UV absorption spectrum of brown pigment from hickory shell
由图1可知,山核桃壳棕色素在紫外区吸光度随波长的增大而增大,在波长240nm处吸光度达到最大值。
2.2 山核桃壳棕色素的抗氧化活性

图2 山核桃壳棕色素的总抗氧化性Fig.2 Dose-effect relationship of total antioxidant activity of brown pigment from hickory shell
2.2.1 山核桃壳棕色素的总抗氧化性α-生育酚是一种应用较为广泛的抗氧化剂,通过与其比较来反映山核桃壳棕色素的总抗氧化能力的大小。由图2可知,山核桃壳棕色素总抗氧化能力随质量浓度的增加而增大,并呈现出良好的量效关系:y=39.312x+8.4407(R2=0.9987)。质量浓度为3.0g/L时,山核桃壳棕色素的总抗氧化能力相当于126.65mmol/L α-生育酚。
2.2.2 山核桃壳棕色素的还原能力

图3 山核桃壳棕色素的还原能力Fig.3 Reducing power of brown pigment from hickory shell at various concentrations
由图3可知,山核桃壳棕色素的还原能力随着质量浓度增加而呈上升趋势,并且具有良好的量效关系:y=0.3288x+0.4059(R2=0.969)。质量浓度为1.0g/L时,山核桃壳棕色素的还原能力超过0.1g/L VC的还原能力;该棕色素的EC50值(吸光度为0.5时的质量浓度)为0.286g/L。2.2.3 山核桃壳棕色素对·OH的清除作用

图4 山核桃壳棕色素清除·OH效果Fig.4 Hydroxyl free radical scavenging rates of brown pigment from hickory shell at various concentrations
由图4可知,山核桃壳棕色素对·OH具有很强的清除能力,并随着质量浓度的增加,清除率呈上升趋势。当质量浓度为1.0g/L时,山核桃壳棕色素对·OH的清除能力与0.3g/L VC 体系的清除能力相近,此时清除率为60.84%。
2.3 山核桃壳棕色素的抑菌活性
由表1可知,山核桃壳棕色素对金黄色葡萄球菌、枯草芽孢杆菌、大肠杆菌、酿酒酵母、黑曲霉均有抑制效果,随着质量浓度的增加,其抑菌效果呈上升趋势。当质量浓度达到5g/L时,山核桃壳棕色素对5种菌的抑菌圈直径分别为(15.09±0.03)、(18.87±0.03)、(9.10±0.03)、(24.89±0.03)、(13.07±0.02)mm。山核桃壳棕色素对酿酒酵母抑制作用最大,其次为枯草芽孢杆菌,对大肠杆菌抑制作用稍弱。

表1 山核桃壳棕色素的抑菌作用Table 1 Antimicrobial ring diameters of brown pigment from hickory shell at various concentrations against five microorganisms
2.4 山核桃壳棕色素的最低抑菌浓度

表2 山核桃壳棕色素的最低抑菌浓度Table 2 MICs of brown pigment from hickory shell against five microorganisms
由表2可知,山核桃壳棕色素对金黄色葡萄球菌、枯草芽孢杆菌、大肠杆菌、酿酒酵母和黑曲霉5种菌的最低抑菌浓度分别为0.25、0.25、1.0、0.125、0.5g/L。表明山核桃壳棕色素抗菌谱较广。
2.5 山核桃壳棕色素的红外光谱分析

图5 山核桃壳棕色素的红外光谱Fig.5 IR spectrum of brown pigment from hickory shell
由图5可见,山核桃壳棕色素的主要吸收波峰在3427.03、1613.62、1516.75、1450.05、1282.16、1117.73、653.96cm-1处。在1613.62cm-1处有芳环骨架振动引起的较强吸收峰; 1117.73cm-1和1282.16cm-1显示C-O伸缩振动和C-O-H面内弯曲振动;在890~620cm-1范围内的吸收带很弱,表明芳环被取代,形成共轭体系,芳氢相对含量较少;3427.03cm-1处存在强的共振吸收峰,是由O-H的伸缩振动产生的。
3 结 论
通过总抗氧化能力,还原力以及清除羟自由基能力评价山核桃壳棕色素的抗氧化活性,结果表明:山核桃壳棕色素具有较强的抗氧化能力,对供试的金黄色葡萄球菌、枯草芽孢杆菌、大肠杆菌、酿酒酵母、黑曲霉均有不同程度的抑制作用。红外光谱结果表明:山核桃壳棕色素含有苯环和酚羟基结构,其中酚羟基具有很强的提供质子的能力,能与更多的自由基结合[14-15],这在一定程度上也说明了山核桃壳棕色素清除自由基活性与其结构的相关性。
参考文献:
[1] 黎章矩. 山核桃栽培与加工[M]. 北京: 中国农业科学出版社, 2003.
[2] LIU Lijuan , LI Wei, SASAKI T, et al. Juglanone, a novel a-tetralonyl derivative with potent antioxidant activity from Juglans mandshurica[J]. Journal of Natural Medicines, 2010, 64 (4): 496-499.
[3] 郭传友, 黄坚钦, 方炎明. 山核桃研究综述及展望[J]. 经济林研究,2004, 22(1): 61-63.
[4] 殷舒, 毛胜凤, 杨琼霞, 等. 山核桃叶片提取物的抑菌作用[J]. 浙江林学院学报, 2007, 24(5): 604-607.
[5] 苏秀, 马良进, 陈安良, 等. 山核桃外果皮提取物抑菌活性的初步研究[J]. 浙江林学院学报, 2008, 25(3): 355-358.
[6] 陈向明, 王华苓, 马芹芬. 山核桃外蒲壳提取物对食用油脂的抗氧化性研究[J]. 中国粮油学报, 2007, 22(6): 109-112.
[7] 吴楠, 王微, 夏莹莹, 等. 红松针叶乙醇提取物与水提物的抗菌活性研究[J]. 食品科学, 2008, 29(11): 80-83.
[8] 李维莉, 马银海, 刘增康, 等. 核桃壳棕色素的提取及性质研究[J].食品科学, 2008, 29(12): 339-341.
[9] BOUGATEF A, HAJJI M, BALTI R, et al. Antioxidant and free radicalscavenging activities of smooth hound(Mustelus mustelus) muscle protein hydrolysates obtained by gastrointestinal proteases[J]. Food Chemistry, 2009, 114: 1198-1205.
[11] 叶明, 陈晓, 朱立, 等. 暗盘孢属YM421黑色素稳定性及其抗氧化活性[J]. 菌物学报, 2010, 29(2): 254-260.
[12] ESPINEL-INGROFF A, WHITE T, PFALLER M A. Manual of clinical microbiology[M]. Washington DC: American Society for Microbiology,1999: 1640-1652.
[13] BULET P, COCIANCICH S, DIMARCQ J L, et al. Isolation froma coleopteran insect of a novel inducible antibacterial peptide and of new members of the insect defensin family[J]. The Journal of Biological Chemistry, 1991, 266(36): 24520-24525.
[14] HUSAIN S R, CILLARD J, CILLARD P. Hydroxyl radical scavenging activity of flavonoids[J]. Phytochemistry, 1987, 26(9): 2489-2491.
[15] 陈琪, 王伯初, 唐春红, 等. 黄酮类化合物抗氧化性与其构效的关系[J]. 重庆大学学报, 2003, 26(11): 48-51.
Antioxidant and Antimicrobial Activities and Infrared Spectroscopic Analysis of Brown Pigment from Hickory Shell
CHEN Xiao1,YE Ming1,*,CHEN Wei1,YANG Liu1,FANG Yong2,ZHAN Quan-sheng2
(1. School of Biotechnology and Food Engineering, Hefei University of Technology, Hefei 230009, China;2. Anhui Zhanshi Food Co. Ltd., Ningguo 242300, China)
Brown pigment extracted from hickory shell with 95% alcohol and purified on AB-8 macroporous resin column was subjected to evaluation of antioxidant and antimicrobial activities and infrared spectroscopic analysis. The results showed that the total antioxidant capacity of the brown pigment at a concentration of 3.0 g/L was equivalent to 126.65 mmol/L α-tocopherol.The EC50 value (the effective concentration at which the absorbance was 0.5) of reducing power for the pigment was 0.286 g/L.The scavenging rate against hydroxyl free radicals reached 60.84 % at 1.0 g/L. The MIC (minimum inhibitory concentration)values of antibacterial effects on Saccharomyces cerevisiae, Staphylococcus aureus, Bacillus subtilis, Escherichia coli and Aspergillus niger were 0.125, 0.25, 0.25, 1.0 g/L and 0.5 g/L, respectively. IR spectral analysis revealed the presence of benzene ring and phenolic hydroxyl in the pigment.
hickory shell;brown pigment;biological activities;minimum inhibitory concentration
TS264.4
A
1002-6630(2011)05-0115-04
2010-06-30
安徽省科技攻关计划重大项目(09010301022)
陈晓(1985—),女,硕士研究生,研究方向为食品资源综合利用。E-mail:chenxiao198525@126.com
*通信作者:叶明(1959—),男,教授,博士,研究方向为生物资源综合利用。E-mail:yeming123@sina.com
