枸杞果酒发酵过程中黄酮含量的变化
2011-10-18师俊玲王振平
许 亮,师俊玲,*,任 健,王振平
(1.西北农林科技大学食品科学与工程学院,陕西 杨凌 712100;2.宁夏大学 葡萄与葡萄酒教育部工程研究中心,宁夏 银川 750021)
枸杞果酒发酵过程中黄酮含量的变化
许 亮1,师俊玲1,*,任 健1,王振平2
(1.西北农林科技大学食品科学与工程学院,陕西 杨凌 712100;2.宁夏大学 葡萄与葡萄酒教育部工程研究中心,宁夏 银川 750021)
以宁夏枸杞为原料,选用两种酵母进行发酵,跟踪检测发酵过程中发酵醪中黄酮含量、pH值、酒精体积分数的变化。结果发现:发酵过程中黄酮含量持续增加至最大值后基本保持不变,酒精体积分数不断增大至最大值后基本保持不变,经过回归分析,两者之间呈现良好的相关关系,并得到了其回归模型;发酵醪的pH值在发酵前期表现为轻微下降,下降至一定值以后基本保持不变;不同的酵母菌种对发酵过程中各组分的变化趋势无影响,但各组分的变化速度不同。
宁夏枸杞;果酒;发酵;黄酮
枸杞(Lycium barbarum)是中国传统的、重要的药食两用同源植物[1-2],其中以宁夏枸杞(Lycium barbarum L.)最负盛名。枸杞除了具备丰富的维生素、矿物质等普通营养成分以外,还含有大量的生物活性成分[3],如具有清除自由基、抗氧化、抗突变、抗肿瘤、抗菌、抗病毒和调节免疫、防治血管硬化、降血糖等功能的黄酮类化合物[4-7]和具有降血脂、降血糖、抗脂肪肝、抗疲劳、抗衰老、清除自由基、抑制氧化脂质生成等作用的枸杞多糖[8-11]。这些生物活性成分是枸杞及其保健制品的灵魂,也是评价枸杞质量与品质的重要指标。泡酒饮用是传统的枸杞食用方式,但不适用于酒精过敏者,而且高度酒不利于人体健康。通过微生物发酵法生产枸杞果酒,有望能够较多地保留活性物质,而且产品的风味较好、营养物质全、酒精度较低,适用人群广[12-13]。目前,有关枸杞果酒的研究主要针对于产品风味和感官指标的提高[14-15],而有关发酵加工过程生物活性物质的变化方面的研究尚未见报道。基于此,本研究重点跟踪考察发酵过程中枸杞果酒中黄酮含量的变化规律,分析其与发酵醪的pH值和酒精体积分数间的关系,以期为产品酒中生物活性物质含量的提高提供参考。
1 材料与方法
1.1 材料与试剂
枸杞购自宁夏中宁商宝有限公司。
酵母Excellence SP(以下简称SP)、酵母Harmonivin(以下简称Har) 法国Lamothe-Abiet公司;芦丁(标准品) 中国药品生物制品检定所;苯酚 北京索莱宝科技有限公司;亚硫酸氢钠(NaHSO3)、氢氧化钠(NaOH)、亚硝酸钠(NaNO2)、硝酸铝(Al(NO3)3)等均为分析纯。
1.2 仪器与设备
UV-1700型紫外-可见分光光度计 日本岛津公司;电子恒温水浴锅 北京科伟永兴仪器有限公司;ZSD-1160培养箱 上海智城分析仪器制造有限公司;T-203电子天平 美国丹佛公司;pH-3C雷磁 上海精密科学仪器有限公司。
1.3 方法
1.3.1 枸杞果酒的发酵工艺流程
干枸杞→料液比1:10(m/V)室温浸泡30min→匀浆→调整成分(白砂糖、酒石酸、NaHSO3)→接种酵母→前发酵→分离倒罐→后发酵→澄清处理→过滤→除菌→成品
打浆:将浸泡后的枸杞用搅拌机(13000r/min)搅拌破碎30s成浆;调整成分:用白砂糖调整枸杞浆液的糖含量至20%,用酒石酸调整酸度至pH4,加入162.5mg/L NaHSO3抑制杂菌和防止氧化;发酵:按0.2g/L接种量分别接入酵母SP、Har,于20℃条件下静置发酵4~8d,至发酵液中残糖含量不再变化为发酵结束;检测:发酵过程中每8h或12h取样,4000r/min离心5min澄清处理后测定其中黄酮含量以及酒精体积分数的变化,同时记录发酵过程中pH值的变化。
1.3.2 黄酮含量测定
参照文献[16-17]所述方法,对黄酮含量进行测定。以芦丁标准品为对照品,以质量浓度为纵坐标,吸光度为横坐标绘制标准曲线,可得回归方程:ρ=6.0008A+0.0997,方程的R2=0.9995,式中A为吸光度,ρ为总黄酮质量浓度/(mg/100mL)。
测定样品中总黄酮含量时,取5.0mL总黄酮样品液,按照标准制作方法测吸光度,根据标准曲线所得回归方程计算样品中总黄酮含量。
1.3.3 酒精体积分数的测定
参照文献[18],采用酒精计法测定枸杞果酒样品的酒精体积分数。
2 结果与分析
2.1 发酵过程中pH值的变化
在整个发酵过程中,发酵液的pH值整体呈现下降趋势,下降至一定值后基本不变;接种Har酵母的发酵液pH值降低得较快,至第2天时已经基本达最低值,而接种SP酵母的发酵液pH值从第1.5天开始才有较明显下降,至3.5d时达最低值(图1)。根据酵母发酵理论,发酵过程中酵母细胞通过EMP途径降解葡萄糖,通过EMP途径,葡萄糖最终被降解为丙酮酸,在无氧条件下,丙酮酸在酵母细胞中被还原成为乙醇,乙醇不会影响到发酵液的pH值;发酵过程中,葡萄糖的降解还会通过HMP途径等其他方式进行,在这些途径中会产生乳酸、柠檬酸等一些有机酸[19],这会降低发酵液的pH值,因此发酵液的pH值会有所降低。
不同酵母菌种的代谢途径和代谢能力都有会所差异。本研究中Har酵母的产酸能力稍强于SP酵母,这说明Har酵母的HMP代谢产酸的能力稍强。

图1 枸杞果酒发酵过程中pH值的变化曲线Fig.1 pH change curve of Chinese wolfberry wine during fermentation process
2.2 发酵过程中的酒精体积分数变化

图2 枸杞果酒发酵过程中酒精体积分数变化曲线Fig.2 Alcohol content change curve of Chinese wolfberry wine during fermentation process
随着发酵过程的进行,酒醪的酒精体积分数不断增大,至第6天(SP)和第7天(Har)酵母达到最大值,此后基本不变;相对而言,接种SP酵母的酒精体积分数增大幅度较大,但两者的最终酒精体积分数基本相同(图2)。这与发酵酒的最终酒精体积分数取决于发酵液含糖量的理论相符。含糖量一定时,酒的最终酒精体积分数相同。但是,不同的酵母菌种代谢产生酒精的能力和速度会有一定差异。在本研究中,SP酵母的乙醇代谢速度较快。
结合2.1节的结果可以发现,SP酵母的产酸能力稍弱,产乙醇能力稍强;Har酵母的产酸能力较强,产乙醇能力稍弱。这说明,两种菌在葡萄糖的物质代谢流方面的分配强度不同。进而说明,两种菌内部的酶系活性不同。另一原因可能是Har酵母的产酸能力强造成的低pH值抑制了酵母的生长和酒精代谢[20-21]。
2.3 发酵过程中黄酮含量的变化
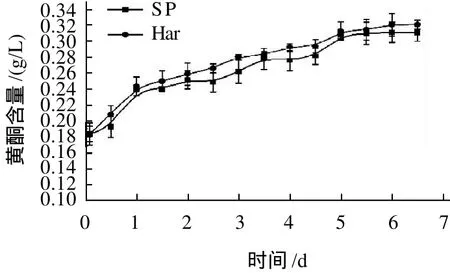
图3 枸杞果酒发酵过程中黄酮含量变化曲线Fig.3 Flavonoid content change curve of Chinese wolfberry wine during fermentation process
两种酵母发酵枸杞果酒的过程中,黄酮含量的变化趋势和幅度基本一致:在发酵初始阶段黄酮含量增加较快,之后增加速度变慢,最后基本保持不变。随着发酵过程的进行,酒液中的黄酮含量不断增加(图3),与发酵过程中酒精含量的增加趋势基本吻合。发酵过程中出现的黄酮含量变化趋势是因为随着发酵的进行,浸泡时间延长,黄酮的溶解量增加;同时,发酵液中酒精含量也在发酵过程中不断增加,也有利于黄酮的提取[22]。由于黄酮在本研究条件下的稳定性较高,当原料中黄酮全部溶入发酵液中以后,酒中黄酮含量也基本保持不变。
两种酵母发酵所得酒中黄酮含量和变化趋势差异不大,产酒精能力稍弱的Har酵母所得酒中黄酮含量反而稍高于产酒精能力强的SP酵母(图3)。这可能是因为Har酵母的产酸能力较强,有利于提高黄酮的溶出率和稳定性。
2.4 黄酮含量变化与酒醪酒精体积分数间的关系
黄酮以其具体分类(黄酮苷元、黄酮苷、二氢黄酮等)不同和分子排列不同,在水和乙醇等中的溶解性也不尽相同,根据枸杞中黄酮的提取研究可知,在较低的乙醇浓度范围内,黄酮的溶出率随乙醇浓度的增加而升高[22]。从发酵过程中酒精体积分数和黄酮含量变化趋势图可以看出,发酵过程中酒醪中黄酮含量和酒精体积分数的变化趋势基本相同,因此,推测两者之间有一定的相关性。对两者进行拟合和回归分析发现,黄酮含量与酒精体积分数呈现良好的二次相关,回归模型如下:

式中:X1、X2分别代表酵母SP、Har发酵的枸杞果酒的酒精体积分数/%;Y1、Y2分别代表酵母SP、Har发酵的枸杞果酒中黄酮含量/(g/L)。
对模型1、2进行方差分析发现(表1),两个模型在95%水平均达到显著(P值分别为0.0018、0.0008),同时模型R2均大于0.90(分别为0.9045、0.9001),说明仅有不到10%的变异不能由模型解释,两模型都具有较高的参考价值。相对而言,模型1的R2稍大一些,说明其适用性相对更好一点。

表1 回归模型的方差分析Table 1 Variance analysis of the developed regression model
综合可知,果酒的发酵是一个复杂的过程。发酵过程中,酵母菌的种类、原料成分与特性(如含糖量、pH值)、发酵条件(如温度、供氧量)等都会对发酵产生很大影响,从而引起发酵体系产生一定波动,进而影响发酵液中的酒精含量以及活性物质在酒精的溶出率和稳定性等。
本研究发现,不同酵母(SP、Har)的自身生长、代谢特性决定了其在发酵过程中的产酸和产酒精能力,并通过改变发酵液的环境(pH值)影响其自身酒精代谢的过程,同时由于枸杞黄酮在不同酒精体积分数和酸度条件下的溶解性与稳定性不同,而影响了酒中最终的黄酮含量。发酵果酒中黄酮含量变化与酒精体积分数变化间呈现显著的相关性。
3 结 论
本实验考察了不同酵母发酵枸杞果酒过程中的pH值、酒精体积分数和黄酮含量的变化。结果表明,酵母Har能较好的在发酵后的枸杞果酒中保留黄酮含量;不同酵母对黄酮含量变化的影响基本相同。发酵过程中,酒醪中的黄酮含量和酒精体积分数变化之间呈现很好的二次相关性,可用回归模型进行很好的描述。研究为提高枸杞果酒中黄酮含量提供了一定的参考,但在枸杞果酒发酵过程中黄酮的变化机制和具体原因方面尚需进行进一步研究。
[1] 苏宇静, 贺海明, 孙兆军. 中国枸杞资源及其在食品工业中的应用现状和开发前景[J]. 食品科学, 2002, 23(8): 292-294.
[2] 荣枫. 药用果树枸杞的研究[J]. 科技情报开发与经济, 2003(9): 168-169.
[3] 霍超, 徐桂花. 枸杞生理活功效和活性成分的研究进展[J]. 中国食物与营养, 2007(1): 50-53.
[4] 王长远, 吴洪奎, 于长青, 等. 黄酮类化合物研究进展[J]. 黑龙江八一农垦大学学报, 2007, 19(2): 75-78.
[5] HU Changqi, CHEN Ke, SHI Qian, et al. Anti-AID sagents, 10, acacetin 7-O-β-D-galactopyranoside, an anti-HIV principle from chrysanthemum morifolivm and a structure activity correlation with some related flavonoids[J]. J Nat Prod, 1994, 57(1): 42-51.
[6] QIAN Jianya, LIU Dong. HUANG Agen. The efficiency of flavonoids in polar extracts of Lycium chinese Mill fruit as free radical scavenger[J].Food Chemistry, 2004, 87(2): 283-288.
[7] WANG C C, CHANG S C, STEPHEN INBARAJ B, et al. Isolation of carotenoids, favonoids and polysaccharides from Lycium barbarum L.and evaluation of antioxidant activity[J]. Food Chemistry, 2010, 120(1): 184-192.
[8] 李卓能, 罗琼, 杨明亮, 等. 枸杞多糖对人前列腺癌细胞生长影响[J].中国公共卫生, 2006, 22(3): 311-312.
[9] 宋育林, 曾民德, 陆伦根, 等. 枸杞多糖对高脂饮食诱导的脂肪肝大鼠模型的影响[J]. 安徽医药, 2007(3): 202-204.
[10] LUO Qiong, LI Zhuoneng, YAN Jun, et al. Lycium barbarum polysaccharides induce apoptosis in human prostate cancer cells and inhibits prostate cancer growth in a xenograft mouse model of human prostate cancer[J]. Journal of Medicinal Food, 2009, 12(4): 695-703.
[11] CHEN Zhisong, SOO Meiyun, SRINIVASAN N, et al. Activation of macrophages by polysaccharide-protein complex from Lycium barbarum L.[J]. Phytotherapy Research, 2009, 23(8): 1116-1122.
[12] 杨天英. 枸杞酒酿造工艺初探[J]. 中国酿造, 2005(12): 51-53.
[13] 刘锐萍, 籍保平, 李博. 三种澄清剂对枸杞酒澄清效果及其对枸杞多糖含量影响的研究[J]. 食品科学, 2005, 26(2): 151-155.
[14] 安冬梅, 宋长冰, 王文娟. 影响枸杞酒品质的因素及其控制措施[J].中国酿造, 2006(7): 52-54.
[15] 张惠玲. 低温留糖发酵半甜型枸杞酒的研究[J]. 中国酿造, 2008(7):53-55.
[16] 张自萍, 黄文波. 枸杞总黄酮和多糖的超声提取及含量测定[J]. 农业科学研究, 2006(3): 22-24.
[17] 李红英, 彭励, 王林. 不同产地枸杞子中微量元素和黄酮含量的比较[J]. 微量元素与健康研究, 2007, 24(5): 14-16.
[18] 程丽娟, 薛泉宏. 微生物学实验指导[M]. 西安: 世界图书出版公司,2000: 352-354.
[19] 江汉湖. 食品微生物学[M]. 北京: 中国农业出版社, 2002: 144-149
[20] 金凤燮. 酿酒工艺与设备选用手册[M]. 北京: 化学工业出版社, 2003:329.
[21] BETTS G D, LINTON P, BETTERIDGE R J. Food spoilage yeasts:effects of pH, NaCl and temperature on growth[J]. Food Control, 1999,10(1): 27-33.
[22] 孔令明, 李芳, 苏兴成. 枸杞中类黄酮化合物的提取研究[J]. 食品研究与开发, 2008, 29(8): 45-48.
Change of Flavonoid Content in Chinese Wolfberry Wine during Fermentation
XU Liang1,SHI Jun-ling1,*,REN Jian1,WANG Zhen-ping2
(1. College of Food Science and Engineering, Northwest A&F University, Yangling 712100, China;
2. Engineering Research Center of Grape and Wine, Ministry of Education, Ningxia University, Yinchuan 750021, China)
Chinese wolfberry fruits were fermented separately by two types of yeasts to produce fruit wines. Changes in flavonoid content, pH and alcohol content were measured during the fermentation period. Results indicated that both the contents of flavonoid and alcohol revealed a gradual increase and then remained at a stable level during the fermentation process.A quadratic regression model for flavonoid content as a function of alcohol content was developed, revealing a good correlation between both parameters based on regression analysis. pH decreased slightly at first and then was kept at a stable level during the fermentation period. Neither flavonoid content nor pH presented significant change. However, different change rates of the three parameters were observed.
Lycium barbarum L.;wine;fermentation;flavonoids
TS262.7
A
1002-6630(2011)05-0100-04
2010-09-20
国家自然科学基金项目(20862014)
许亮(1989—),男,硕士研究生,研究方向为食品生物技术。E-mail:muzxl2007@gmail.com
*通信作者:师俊玲(1972—),女,教授,博士,研究方向为食品生物技术。E-mail:sjlshi2004@yahoo.com.cn
