冷藏条件下中国对虾肌肉蛋白质的生化特性
2011-10-18李学鹏励建荣朱军莉
李 姣,李学鹏,励建荣*,朱军莉
(浙江工商大学食品与生物工程学院,浙江省食品安全重点实验室,浙江 杭州 310035)
冷藏条件下中国对虾肌肉蛋白质的生化特性
李 姣,李学鹏,励建荣*,朱军莉
(浙江工商大学食品与生物工程学院,浙江省食品安全重点实验室,浙江 杭州 310035)
以肌肉基本营养成分、蛋白质组成、肌动球蛋白盐溶性、巯基含量、Ca2+-ATPase活性、疏水性及SDSPAGE分析等作为测定指标,考察中国对虾在冷藏时肌肉蛋白质的生化特性变化规律。结果表明,中国对虾肌肉是典型的高蛋白[(21.75±0.12)%]、低脂肪[(1.21±0.03)%]型食物;随着贮藏时间的延长,肌原纤维蛋白和肌基质蛋白的含量减少,肌浆蛋白含量先增加后减少,碱溶性蛋白含量逐渐增加;肌动球蛋白的盐溶性先上升后下降;巯基(-SH)数贮藏前期下降缓慢,第6天后显著下降;Ca2+-ATPase活性显著下降,且与贮藏时间呈显著线性相关(R0℃= -0.991,R4℃= -0.998),但0℃和4℃两组之间差异不显著。疏水性随贮藏时间延长显著增加,并呈显著线性关系(R0℃= 0.976,R4℃= 0.995),且0℃和4℃两组之间差别显著。SDS-PAGE结果显示,肌动蛋白、肌球蛋白重链、原肌球蛋白和分子质量为67kD的蛋白均发生了明显的降解。综合各指标的变化情况,表明随着冷藏时间的延长,蛋白质变性加剧,总体变性程度为0℃时小于4℃。Ca2+-ATPase活性和疏水性与贮藏时间呈显著线性关系,可以作为蛋白质变性程度的指示指标。
中国对虾;肌肉;蛋白质;生化特性
水产品营养丰富,深受人们喜爱。但由于水产品水分含量高,肌肉组织脆弱,内源性蛋白酶活跃,导致蛋白质降解、自溶作用速度快,肌肉在物理、化学、微生物等方面发生变化,最终导致腐败变质,影响食用品质和安全性。水产品的品质和加工适用性与其肌肉蛋白质的生化特性存在密切的关系。长期以来,国内外研究人员对水产品尤其是鱼类蛋白质在贮藏过程中的生化特性变化及其变性机理进行了大量系统深入的研究[1-4]。然而,关于对虾肌肉蛋白质的生化特性变化方面的报道仍较少。
中国对虾(Fenneropenaeus chinensis)又称东方对虾,属节肢动物门、甲壳纲、十足目、对虾科、对虾属,与墨西哥棕虾、圭亚那白虾齐名,并称世界三大名虾,是我国分布最广的对虾类。中国对虾是中国的特产,因营养丰富,滋味鲜美,且具保健功能,是我国重要的出口水产品,广受国际市场欢迎。由于对虾自身含高蛋白、高水分,肌肉组织较松软,组织蛋白酶活性较强,蛋白质降解较快,死后僵硬期短,自溶作用迅速,导致其新鲜度下降快,易腐败变质[5]。由于对虾保鲜技术和加工水平的相对滞后,严重制约了中国对虾产业的健康、快速发展。
无论从细胞水平还是从组织水平,蛋白质是对虾肌肉的主要组成成分。同时,虾肉的腐败变质多是由于蛋白质的降解引起的。因此,虾肉的鲜度等品质变化与蛋白质本身特性直接相关。研究贮藏过程中对虾肌肉蛋白质生化特性和变化规律,可以为对虾贮藏品质变化规律及保鲜与加工技术开发提供理论依据。鉴于此,本研究以虾肉基本营养成分、蛋白质组成、肌动球蛋白盐溶性、巯基含量、Ca2+-ATPase活性、疏水性及SDSPAGE为指标,考察中国对虾在0℃和4℃冷藏条件下的肌肉蛋白质生化特性变化规律。
1 材料与方法
1.1 材料与试剂
鲜活中国对虾(Fenneropenaeus chinensis) 市售,平均体长11.5~12.5cm,体质量10.8~11.8g。
8-苯胺基-1-萘磺酸钠(ANS)、牛血清蛋白、5,5'-二硫双(2-硝基苯甲酸)(DTNB) 上海生工生物工程技术服务有限公司;SDS-PAGE所用的标准蛋白样液 宝生物工程有限公司;其他试剂均为分析纯或化学纯。
1.2 仪器与设备
冷冻高速离心机 美国Sigma公司;HH-Z数显恒温水浴锅 国华电器有限公司;970CRT荧光分光光度计 上海精密科学仪器有限公司;T25 basic 型分散机 德国IKA公司;UV-2550型紫外-可见分光光度仪 日本Shimadzu公司;KJELTEC 2300自动定氮仪 瑞典福斯分析仪器有限公司;GS-800 校准型光密度仪 美国Bio-Rad公司;SQ119组织捣碎机 上海帅佳电子科技有限公司。
1.3 方法
1.3.1 采样方法
将鲜活的中国对虾置于冰水中使其致死,用蒸馏水冲洗并进行分级处理,真空包装后放置0℃和4℃冰箱中。每隔2d取虾,去头、壳、肠腺等杂质,然后用组织捣碎机捣碎,用于蛋白组成及生化特性指标的测定。
1.3.2 对虾肌肉基本营养成分测定
水分含量按照国标GB 5009.3—85《食品中水分的测定方法》中直接干燥法测定,在105℃干燥至恒质量;用凯氏定氮法测蛋白质含量,蛋白质系数选择6.25;脂肪含量按GB/T 5009.6—2003《食品中脂肪的测定方法》中索氏抽提法测定;灰分含量按GB/T 5009.4—2003《食品中灰分的测定方法》测定。
1.3.3 蛋白组成测定
按Hashimoto等[6]的方法,并稍作修改。虾肉(10g)与100mL磷酸缓冲液A(15.6mmol/L Na2HPO4,3.5mmol/L KH2PO4,pH 7.5)混合,在6500r/min分散3min,每分散15s,停10s,以防过热,然后将分散液在4℃离心(4000r/min,15 min)。再在沉淀中加入100mL磷酸缓冲液A,重复上述操作。将两次离心后的上清液合并,加入三氯乙酸(TCA),使TCA的终质量浓度达5g/100mL,然后离心,所得的沉淀为肌浆蛋白,上清液即为含氮非蛋白化合物。在用缓冲液A两次提取后所得的沉淀中加入100mL磷酸缓冲液B(0.5mol/L KCl,15.6mmol/L Na2HPO4,3.5mmol/L KH2PO4,pH 7.5),分散并离心,沉淀中再加入缓冲液B,重复一次,将两次离心后的上清液混合,作为肌原纤维蛋白。而在沉淀中加入0.1mol/L NaOH,过夜搅拌10h,然后离心,上清液即为碱溶性蛋白,沉淀为肌基质蛋白。以上所提取的蛋白质中,肌原纤维蛋白和碱溶性蛋白的定量方法采用双缩脲法,肌浆蛋白和肌基质蛋白含量测定则采用凯氏定氮法。
1.3.4 肌动球蛋白的提取
采用Benjakul等[7]的方法,即取鱼肉2g,加入20mL 0.6mol/L的冰KCl溶液(pH 7.0),在6500r/min分散2min,每分散10s,停10s,以防过热,然后将分散液在4℃离心(4000r/min,30min)。在上清液中加入3倍体积冰的蒸馏水,4000r/min 离心20min,最后在沉淀中加入等体积的冰KCl溶液(1.2mol/L,pH 7.0),在冰上放置30min后离心,离心后所得的上清液即为肌动球蛋白。
1.3.5 肌动球蛋白盐溶性的测定
按双缩脲法[8]测定蛋白质浓度。取1mL肌动球蛋白,加入4mL双缩脲试剂,25℃水浴30min,在波长540nm处测吸光度。对照标准曲线求出肌动球蛋白的浓度。
1.3.6 肌动球蛋白巯基(-SH)含量测定
按Benjakul等[9]的方法进行。取1mL 肌动球蛋白(0.4g/100mL),加入0.2mol/L的Tris-HCl缓冲液(包括8mol/L尿素,2% SDS 和10mmol/L EDTA,pH6.8),稀释后取4mL,加入0.4mL 0.1g/100mL DTNB ,40℃水浴25min,在波长412nm处测吸光度。用0.6mol/L KCl取代样品,作空白对照。-SH含量用公式(1)计算。

式中:A表示吸光度;11表示稀释倍数;c表示分子吸光系数,其值为13600L/(mol·cm);M表示肌动球蛋白的含量。
1.3.7 肌动球蛋白Ca2+-ATPase活性测定
[10]进行,并稍作修改。将肌动球蛋白稀释至3.0mg/mL,取1mL稀释液,依次加入0.6mL的Tris-HCl缓冲液(0.5mol/L,pH 7.0)和7.9 mL10mmol/LCaCl2溶液,最后加入0.5mL 20mmol/L的ATP,25℃反应8min,加入5mL 15%的TCA终止反应,并将反应体系在3500×g离心5min。上清液中无机磷的含量采用钼蓝染色法进行测定,无机磷标准曲线的回归方程为y=0.107 x-0.002,R2=0.9994,可应用于无机磷的定量分析。Ca2+-ATPase活性即可表示为每毫克肌动球蛋白每分钟所释放的无机磷量,按公式(2)计算。

式中:m表示生成无机磷量/μmol;t表示反应时间/min;M表示肌动球蛋白的含量/mg。
1.3.8 肌动球蛋白疏水性测定
按参考文献[11]的方法进行。将肌动球蛋白用0.6mol/L KCl、 20mmol/L的磷酸缓冲液稀释(pH 7.0)至0、0.1、0.3、0.6、1mg/mL,分别取2mL,加入8mmol/L的ANS 10μL,置于黑暗处10min。在激发波长为374nm,发射波长为485nm,缝宽为5nm处测定荧光强度。

式中:R为相对荧光强度;F为含肌动球蛋白的ANS溶液荧光强度;F0为不含肌动球蛋白的ANS溶液荧光强度。
以肌动球蛋白的浓度为横坐标,相对荧光强度R为纵坐标,所得直线的斜率即为肌动球蛋白的疏水性。
1.3.9 肌动球蛋白SDS-PAGE电泳分析
对提取的肌动球蛋白进行SDS-PAGE电泳,电泳操作参考文献[12]进行,采用10%的分离胶和4%的浓缩胶,并用0.25%的考马斯亮蓝染色液进行染色。
1.3.10 数据统计分析
采用Origin 8.0绘图,SPSS 18.0进行方差分析。显著性水平设置为P<0. 05。
2 结果与分析
2.1 肌肉基本营养成分
中国对虾肌肉的水分含量为(73.34±1.05)%,粗蛋白含量高达(21.75±0.12)%,粗脂肪含量为(1.21±0.03)%,灰分为(1.81±0.07)%。说明中国对虾虾肉是典型的高蛋白、低脂肪型食物。
2.2 肌肉蛋白组成变化
由表1可以看出,对于新鲜虾,肌原纤维蛋白占总蛋白质的61.96%,是主要蛋白。鲜虾中碱溶性蛋白占5.82%,这可能是因为在提取蛋白前,将虾置于碎冰上一段时间,导致蛋白质发生一定程度地降解,产生碱溶性蛋白。随着贮藏时间的延长,肌原纤维蛋白和肌基质蛋白的含量逐渐减少,肌浆蛋白则在前4d增加,后6d减少,同时,碱溶性蛋白的含量逐渐上升。在4℃贮藏温度时,各蛋白组分含量的下降或增加速度较0℃要快,表明4℃时蛋白质的变性程度比0℃稍大。
表1 冷藏过程中中国对虾肌肉蛋白质组成变化(±s)Table 1 Changes in various muscle protein components in Chinese shrimps during chilled storage at 0 or 4 ℃(± s)

表1 冷藏过程中中国对虾肌肉蛋白质组成变化(±s)Table 1 Changes in various muscle protein components in Chinese shrimps during chilled storage at 0 or 4 ℃(± s)
注: 同一行数据右上角字母不同表示显著差异(P<0.05)。
10肌原纤维蛋白/(mg/g) 0 109.41±1.02a 106.65±0.93b 104.33±1.16b 99.99±1.51c 89.34±1.64d 79.38±2.02e4 109.41±1.02a 104.37±1.27b 102.28±0.95b 90.08±2.05c 80.12±1.42d 75.21±0.69e碱溶性蛋白/(mg/g) 0 10.53±0.27a 11.59±0.34b 12.53±0.19c 13.27±0.29c 15.39±0.80d 18.11±0.36e4 10.53±0.27a 11.69±0.24b 15.15±0.46c 16.54±0.16d 18.27±0.41e 20.30±0.65f肌浆蛋白/(mg/g) 0 51.36±1.42a 59.18±2.11b 70.69±1.36c 67.02±0.96d 66.45±1.18e 52.83±0.92a4 51.36±1.42a 55.72±1.01b 66.02±1.72c 63.29±0.74d 61.35±0.98d 52.78±1.52a肌基质蛋白/(mg/g) 0 6.99±0.14a 6.62±0.22b 5.39±0.19c 4.92±0.15d 4.29±0.16e 3.55±0.06f4 6.99±0.14a 6.54±0.11b 5.25±0.18c 4.69±0.12d 3.75±0.11e 3.05±0.14f蛋白组分含量 温度/℃ 时间/d 0 2 4 6 8
蛋白组成发生一定地变化,是由于在贮藏过程中,蛋白质的高级结构发生变化,并且还出现了不同程度的变性和降解。其中肌浆蛋白的含量出现先增加后降低的情况,前期增加可能是由于肌原纤维蛋白含量的减少所造成的,而后期降低则可能是因为蛋白质发生变性和降解。
2.3 肌动球蛋白盐溶性的变化

图1 冷藏过程中对虾肌肉肌动球蛋白溶解性的变化Fig.1 Changes in solubility of muscle actomyosin in Chinese shrimps during chilled storage at 0 or 4 ℃
如图1所示,在0℃和4℃时,肌动球蛋白含量都与时间呈显著相关性(R0℃=-0.799,R4℃=-0.843)。在前2d内,对虾肌动球蛋白的溶出量呈上升趋势,而在后期都呈下降趋势。在0℃冷藏时,从第2天开始,溶出量迅速下降,尤其是在第2天和第4天之间,肌动球蛋白的溶出量从85.84mg/g下降到68.61mg/g,下降速度达17.23mg/(g·d)远高于冷藏后期的下降速度;在4℃条件下冷藏时,从第2天开始,肌动球蛋白的溶出量逐渐下降,从73.44mg/g下降到45.37mg/g。
引起肌动球蛋白在冷藏过程中溶解性下降的因素有多种,如由于肌原纤维蛋白变性后,会产生一种在高离子强度下不溶解但在碱液中可以溶解的蛋白质,即碱溶性蛋白质,也会导致肌动球蛋白在冷藏过程中溶解性的下降。Sompongse等[13]认为巯基氧化形成的二硫键会导致肌球蛋白重链的聚合,从而降低其盐溶性。从图1、2可以看出,对虾肌动球蛋白的溶出量在不同温度冷藏时的下降趋势与其巯基含量的变化存在相关性。因此,可以认为对虾在冷藏过程中肌动球蛋白溶出量的下降是由于巯基氧化形成二硫键所致。
值得提出的是鲜虾的肌动球蛋白溶出量低于冷藏2d后对虾,可能是活虾在死后的数小时内处于僵硬前期,体内ATP的作用阻碍或减弱了肌动蛋白和肌球蛋白的结合,致使肌动球蛋白数量偏低。
2.4 肌动球蛋白中-SH含量的变化
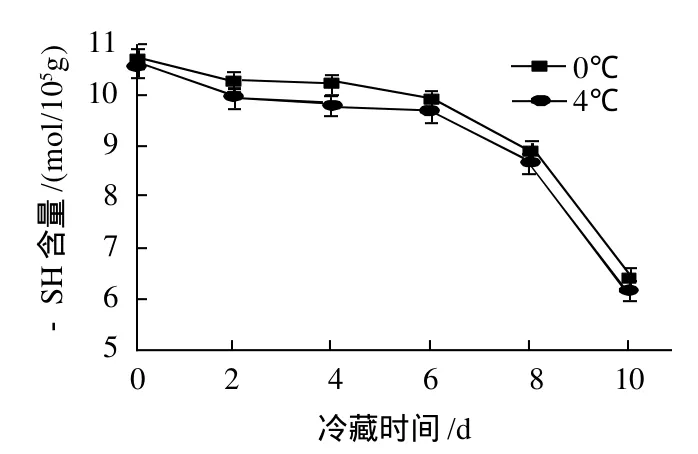
图2 冷藏过程中对虾肌动球蛋白中巯基含量的变化Fig.2 Changes in sulfhydryl content of muscle protein during chilled storage at 0 or 4 ℃
从图2可以看出,在0℃和4℃处理条件下,-SH含量随着时间延长显著降低(P<0.05),且与时间显著相关(R0℃= - 0.873,R4℃= - 0.883)。前 6d 内,- SH 含量的下降速度较缓慢,而从第6天开始,-SH含量急剧下降,其中0℃条件下-SH含量由9.884mol/105g下降到6.342mol/105g ,4℃条件下由9.721mol/105g下降到6.208mol/105g。在同一时间,4℃条件下的-SH含量均低于0℃,但差异不是很明显。
-SH含量在冷藏过程出现下降的原因可能是肌球蛋白降解,蛋白空间结构发生改变,使埋藏在分子内部的巯基暴露出来,导致巯基含量的减少[9]。
2.5 肌动球蛋白中Ca2+-ATPase活性变化
Ca2+-ATPase活性很好地反映了肌球蛋白的完整性,而肌球蛋白的Ca2+-ATPase在1~10mmol/L Ca2+存在时有很高的活性,而肌动蛋白的存在则对活性并无影响,因此肌球蛋白的Ca2+-ATPase活性实际上就是肌动球蛋白的 Ca2+-ATPase 活性[14]。
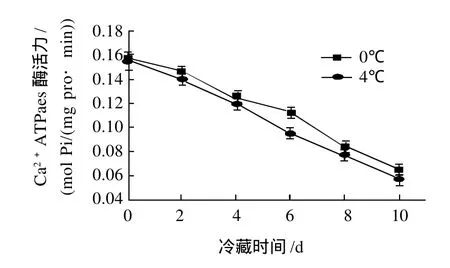
图3 冷藏过程中对虾肌动球蛋白中Ca2+-ATPase活性的变化Fig.3 Changes in Ca2+ATPase activity of muscle protein during chilled storage at 0 or 4 ℃
由图3可知,Ca2+-ATPase活性随着时间的延长显著下降(P<0.01),且与时间显著线性相关(R0℃=-0.991,R4℃= -0.998)。在同一时间下,4℃条件下的Ca2+-ATPase活性均低于0℃的,说明其肌动球蛋白的变性情况较0℃要略微严重,即温度越低,ATPase 活性下降越少,性质越稳定。
引起肌动球蛋白ATPase 活性下降的原因有多种解释。有许多学者[15]认为巯基氧化形成二硫键导致的分子聚合是ATPase 活性下降的主要原因。Okada等[16]则认为由于肌球蛋白头部的构象变化及聚合导致ATPase 活性下降。本研究表明Ca2+-ATPase活性与巯基含量的变化趋势非常相近,认为由于巯基的氧化导致了Ca2+-ATPase活性的降低。
2.6 肌动球蛋白疏水性变化

图4 冷藏过程中对虾肌肉肌动球蛋白疏水性的变化Fig.4 Changes in hydrophobicity of muscle protein during chilled storage at 0 or 4 ℃
从图4可以看出,在0℃和4℃条件下,中国对虾肌动球蛋白的疏水性都随时间的延长显著增大(P<0.01),且与时间显著线性相关(R0℃= 0.976,R4℃= 0.995)。Roura等[17]认为当蛋白质构象发生变化时,形成一种芳族环,如苯基丙氨酸和色氨酸,它们是疏水性氨基酸,可与荧光探针ANS结合。Hill等[18]认为不同氨基酸间的疏水作用及巯基的氧化会影响蛋白质的疏水性。Multilangi等[19]研究表明由于蛋白质的降解和变性作用,使埋藏在内部的分子暴露出来,导致疏水性的增加。研究认为疏水性的增加是由蛋白质的构象变化和降解两个因素引起的。
2.7 SDS-PAGE电泳

图5 冷藏过程中肌动球蛋白的SDS-PAGE图谱Fig.5 SDS-PAGE of actomyosin in Chinese shrimp muscle during chilled storage at 0 or 4 ℃
根据图5结果可清楚地辨别肌动蛋白(actin)、肌球蛋白重链(myosin heavy chain,MHC)和原肌球蛋白(actomyosin),随着时间的延长,蛋白条带密度减弱,说明三者均发生了不同程度的降解。另外,由于肌钙蛋白-T的分子质量为37~40kD,推测肌动蛋白和原肌球蛋白之间的两蛋白条带为肌钙蛋白-T的电泳图谱。从图5可以看出,肌钙蛋白-T的条带密度随着贮藏时间的延长逐渐降低,说明肌钙蛋白-T在冷藏过程中也发生了一定程度地降解。值得注意的是,在分子质量约为67kD处有一蛋白条带,0℃和4℃贮藏条件下,此条带密度分别在第8天和第10天时基本消失。虾肉中肌动球蛋白的降解,主要是因为蛋白质受自身蛋白酶和细菌蛋白酶的共同作用发生分解所引起的。
3 结 论
中国对虾虾肉是典型的高蛋白(21.75±0.12)%、低脂肪(1.21±0.03)%型食物。随着贮藏时间的延长,冷藏过程中对虾肌肉蛋白组成和各项生理指标均发生了较大变化。肌原纤维蛋白和肌基质蛋白的含量减少,肌浆蛋白含量先增加后减少,碱溶性蛋白含量逐渐增加。肌动球蛋白的盐溶性先上升后下降;巯基(-SH)数贮藏前期下降缓慢,第6天后显著下降;Ca2+-ATPase活性显著下降,且与贮藏时间呈显著线性相关(R0℃=-0.991,R4℃=-0.998),但0℃和4℃两组之间差异不显著;疏水性随贮藏时间显著增加,并呈显著线性关系(R0℃=0.976,R4℃= 0.995),且0℃和4℃两组之间差别显著;SDS-PAGE结果显示,肌动球蛋白发生了一定程度的降解。这些都说明中国对虾在冷藏过程中,肌肉蛋白质发生了一定程度的变性,并且在0℃和4℃时,变性程度为4℃略大于0℃,说明冷藏温度越低蛋白质的生化特性越稳定。Ca2+-ATPase活性和疏水性与贮藏时间呈显著线性关系,可以作为蛋白质变性程度的指示指标。
参考文献:
[1] SUVANICH V, JAHNCKE M L, MARSHALL D L. Changes in selected chemical quality characteristics of channel catfish frame mince during chill and frozen storage[J]. J Food Sci, 2000, 65(1): 24-29.
[2] LIAN P Z, LEE C M, HUFNAGEL L. Phisicochemical properties of frozen red hake (Urophycis chuss) mince as affected by cryoprotective ingredients[J]. J Food Sci, 2000, 65(7): 1117-1123.
[3] FUKUDA Y, KAKEHATA K I, ARAI K I. Denaturation of myobrillar protein in deep-sea fish by freezing and storage[J]. Bull Jap Soc Sci Fish,1981, 47(5): 663-672.
[6] HASHIMOTO K, WATABE S, KONO M, et al. Muscle protein composition of sardine and mackerel[J]. Bulletin of the Japanese Society of Scientific Fisheries, 1979, 45(11): 1435-1441.
[7] BENJAKUL S, SEYMOUR T A, MORRISSEY M T, et al. Physicochemical changes in pacific whiting muscle proteins during iced storage[J]. J Food Sci, 1997, 62(4): 729-733.
[8] ROBINSON H W, HODGEN C G. The biuret reaction in the determination of serum proteins[J]. Journal of Biological Chemistry, 1940, 135:707-725.
[9] BENJAKUL S, VISESSANGUAN W, THONGKAEW C, et al. Comparative study on physicochemical changes of muscle proteins from some tropical fish during frozen storage[J]. Food Res Int, 2003, 36: 787-795.
[10] THANONKAEW A, BENJAKUL S, VISESSANGUAN W, et al. The effect of metal ions on lipid oxidation, colour and physicochemical properties of cuttlefish(Sepia pharaonis) subjected to multiple freezethaw cycles[J]. Food Chem, 2006, 95: 591-599.
[11] YONGSAWATDIGUL J, PARK J W. Thermal denaturation and aggregation of threadfin bream actomyosin[J]. Food Chem, 2003, 83: 409-416.
[12] PORZIO M A, PEARSON A M. Improved resolution of myofibrillar proteins with sodium dodecyl sulfate-polyacrylamide gel electrophoresis[J]. Biochem Biophys Acta, 1977, 490(1): 27-34.
[13] SOMPONGSE E, ITOH Y, OBATAKE A. Effect of cryoprotectants and reducing reagent on the stability of actomyosin during ice storage[J].Fish Sci, 1996, 62: 110-113.
[14] 万建荣, 洪玉菁, 奚印慈, 等. 水产食品化学分析手册[M]. 上海: 上海科学技术出版社, 1993: 154-157.
[15] JIANG S T, HWANG D C, CHEN C S. Effect of storage temperature on the formation of disulfides and denaturation of milkfish actomyosin[J]. J Food Sci, 1988, 53(5): 1333-1335.
[16] OKADA T, INOUE N, AKIBA M. Electron microscopic observation and biochemical properties of carp myosin B during frozen storage[J].Bulletin of the Japanese Society of Scientific Fisheries, 1986, 52: 345-353.
[17] ROURA S J, SAAVEDRA J P, TRUCO R E, et al. Conformational changes in actomyosin from post-spawned hake stored on ice[J]. J of Food Sci, 1992, 57: 1109-1111.
[18] HILL A R, IRVINE D M, BULLOCK D H. Precipitation and recovery of whey proteins[J]. Canadian Institute of Food Science and Technology,1982, 15: 155-160.
[19] MULTILANGI W A M, PANYAM D, KILARA A. Functional properties of hydrolysates from proteolysis of heat-denatured whey protein isolate[J]. J Food Sci, 1996, 61: 270-274.
Biochemical Properties of Muscle Protein from Fenneropenaeus chinensis during Chilled Storage
LI Jiao,LI Xue-peng,LI Jian-rong*,ZHU Jun-li
(Food Safety Key Laboratory of Zhejiang Province, College of Food Science and Biotechnology,Zhejiang Gongshang University, Hangzhou 310035, China)
In order to explore changes in biochemical properties of muscle proteins from Chinese shrimps (Fenneropenaeus chinensis) during storage at 0 or 4 ℃, basic nutrients, protein composition, salt soluble actomyosin, sulfhydryl content, Ca2+-ATPase activity and hydrophobicity were determined and SDS-PAGE analysis was also conducted at two-day intervals. The results showed that the muscle of Chinese shrimps was a typical food with relatively high protein ((21.75 ± 0.12)%) and low fat ((1.21± 0.03)%). With the extension of storage time, a decrease trend in myofibrillar protein and muscle matrix protein, a pattern of initial increase and final decrease in sarcoplasmic protein and actomyosin, a gradual increase trend in alkali soluble protein and a slow decrease in sulfhydryl content were observed for the muscle of Chinese shrimps. Meanwhile, a significant reduction of Ca2+-ATPase activity was also determined, which exhibited an obvious linear relationship with storage time (R0 ℃= 0.991,R4℃= 0.998). However, the values of the above parameters at 0 ℃ did not significantly differ from those at 4 ℃. Hydrophobicity significantly increased with the extension of storage time, and revealed an obvious linear relationship with storage time (R0 ℃ =0.976, R4 ℃ = 0.995). SDS-PAGE analysis showed that actin, myosin heavy chain, actomyosin and the protein with a molecule weight of 67 kD were obviously degraded during the storage. Based on a comprehensive consideration of these changes in various indicators, the denaturation of proteins was enhanced due to the extension of storage time. The degree of degradation at 4 ℃ was higher than that at 0 ℃. Ca2+-ATPase activity and hydrophobicity displayed a strong correlation with storage time, which can be considered to indicate the degradation of muscle protein during chilled storage.
Chinese shrimp (Fenneropenaeus chinensis);muscle;protein;biochemical property
S912;TS254.1
A
1002-6630(2011)05-0016-06
2010-06-14
国家“863”计划项目(2007AA091806);浙江省研究生创新项目(YK2008062);
浙江工商大学研究生科研创新基金项目(1110 XJ 1509106)
李姣(1986—),女,硕士研究生,研究方向为水产品贮藏加工。E-mail:lijiao210@yahoo.com.cn
*通信作者:励建荣(1964—),男,教授, 博士,研究方向为生鲜食品贮藏加工与安全控制。E-mail:lijianrong@zjgsu.edu.cn
