环烷酸模型化合物酯化反应体系的热力学分析
2011-10-13任正时朱建华
任正时,朱建华
(中国石油大学化学科学与工程学院,北京102249)
环烷酸模型化合物酯化反应体系的热力学分析
任正时,朱建华
(中国石油大学化学科学与工程学院,北京102249)
以选取的环烷酸模型化合物为基础,利用热力学方法分析其酯化反应的可能性。由于环烷酸物质结构的特殊性,它们的热力学数据通常无法直接获取,采用了基团贡献法估算酯化反应体系中环烷酸及环烷酸酯在298.15K标准态下的生成焓和标准熵,同时确定了这两种物质等压热容随温度的变化关系,进而得到了不同温度条件下酯化反应的吉布斯自由能变及平衡常数。计算结果表明,酯化反应的平衡常数很大(107),从而确定了该反应体系的可能性。
环烷酸;酯化脱酸;热力学分析;基团贡献法
环烷酸是原油中存在的石油酸的主要成分,其基本结构为含有五元环或六元环的单环或多环一元羧酸。由于在原油加工过程中环烷酸腐蚀设备,导致设备使用周期减短[1],如何减少其对设备的腐蚀,并使之转化为有用的成分,是一个亟待解决的问题。本文选取带有双环的-(3,4)-环戊烷基环己烷乙酸作为环烷酸的模型化合物,同时为了使生成的环烷酸酯成为馏分油的有益成分,选取乙二醇作为进行酯化反应的醇类物质。在常压及一定的温度条件下,-(3,4)-环戊烷基环己烷乙酸与过量乙二醇在催化剂作用下的酯化反应。
1 热力学数据的估算
1.1 298.15 K理想状态条件下生成焓与规定熵值的估算
利用Benson基团贡献法[2~4],估算反应体系中环烷酸(酸C11H18O2)和环烷酸酯(酯C13H22O3)在298.15K标准状态下为理想气体时的生成焓和标准熵值的计算公式如下所示:
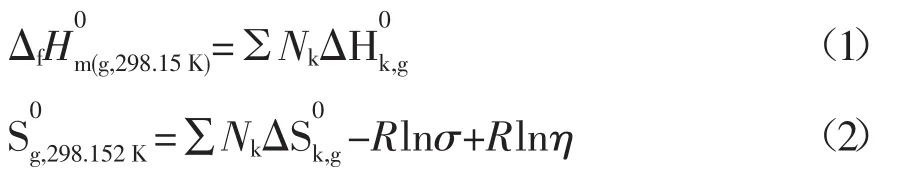
式中:Nk为k型基团的数目;σ为分子的对称数;η为光学异构体数。
反应组分中各基团的贡献值如表1所示:

表1 Benson基团贡献值
将表1中的数据代入式(1)和(2)中,便可计算出各物质在298.15 K标准状态下呈理想气体状态时的摩尔生成焓与摩尔标准熵的估算值,计算结果如表2所示:

表2 标准状态下各组分的标准摩尔生成焓和标准熵物质
1.2 298.15K条件下各组分液态生成焓的估算
由于反应体系中的各组分均以液态形式参与反应,所以需对各组分在298.15 K呈液态状态下的相关热力学数据进行估算,298.15 K时各组分呈液态时的焓变按式(3)计算:
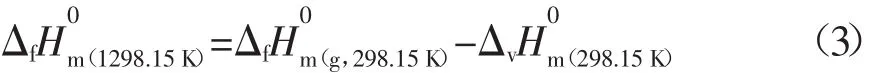

式中:ni表示i型基团的数目;εi表示i型基团对蒸发热的贡献值,单位为J·mol-1。

表3 Fedors基团贡献值
298.15K各组分为理想液体时的标准摩尔生成焓计算结果为:C11H18O2(l)-635.026 kJ·mol-1、C13H22O3(l)-833.768 kJ·mol-1、C2H6O2(l)-455.340*kJ·mol-1、H2O(l)-285.830*kJ·mol-1。带*的为文献[6]数据。
1.3 298.15 K条件下液态组分规定熵值的估算
在298.15 K标准状态下,酯化反应中各组分呈液态时的规定熵值可由式(5)计算:
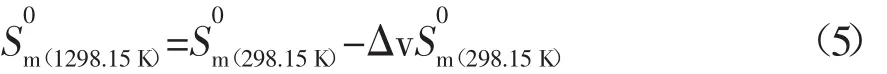
式中:为液态组分在298.15 K标准状态下的摩尔蒸发熵,可按经验关联式(6)进行计算[2,3]:

式中:A和B均为经验常数,二者的数值应根据化合物的类型进行选取,估算酸或醇时,A、B分别取390.203 J·mol-1·K-1和-873.3274 J·mol-1·K-1;估算酯时,A、B分别取125.4 J·mol-1·K-1和-222.376 J·mol-1·K-1;Tb为物质在常压下的沸点。据相关文献[5]可知乙二醇的沸点为505.15 K,由Joback基团贡献法[2,3]可估算出-(3,4)-环戊烷基环己烷乙酸及-(3,4)-环戊烷基环己烷乙酸2-羟基乙酯的沸点分别为618.21 K和668.86K。
结合式(5)和(6)可以计算出在298.15 K标准状态下各组分的摩尔蒸发熵和298.15 K条件下呈液态时的规定熵值,结果见表4。

表4 298.15K各组分为理想液体时的标准摩尔规定熵
1.4 液态有机组分热容的估算
当温度低于沸点时,不同温度条件下各组分液态热容的估算可采用Ruzicka-Domalski基团贡献法[2~6],计算公式如式(7)所示:
我国柳属植物资源丰富,但目前对其研究多属于基础性药理研究,临床应用研究较少,药用资源的开发利用还比较薄弱。今后应进一步在中医药理论的指导下,对柳属植物进行系统的药效活性筛选和化学成分分离,从中寻找活性强、疗效高、毒副作用小的天然产物进行药品的研发;利用构效关系对天然化合物进行结构修饰,开发更适于临床的高效低毒的药物;结合分子生物学对药物的作用靶点进行预测,深入研究其作用机制;对活性部位及活性化合物进行临床研究,为柳属植物临床用药的安全性提供可靠的科学依据,进而促进柳属植物的合理开发与应用。
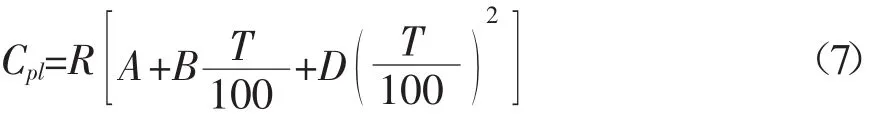
各组分的Ruzicka-Domalski基团贡献值如表5所示:

表5 Ruzicka-Domalski基团贡献值
将表5中的数据代入式(7)中,可得到各组分呈液态时的热容表达式(J·mol-1·K-1),结果是:C11H18O2(l)为198.159+0.274T+8.089×10-4T2、C13H22O3(l)为317.069+0.072T+1.061×10-3T2、C2H6O2(l)为111.238-7.765×10-3T+4.479×10-4T2、H2O(l)*为75.6(温度在298.15~373.15 K范围内的平均值)、H2O(g)*为29.16+14.19×10-3T-0.2022×10-5T2(温度高于373.15 K时)。带*的为文献[7]数据。
2 热力学分析
2.1.298.15-373.15 K范围内时
由各组分的热容与温度关系式,可求得在298.15-373.15 K温度范围内该反应的热容(单位:J·mol-1·K-1)表达式如下:

将298.15 K时反应的焓变值代入Kirchhoff公式[7]:[∂(ΔrG/T)/∂T]p=-ΔrH/T2,可得到在此温度区间内反应焓变(单位:J·mol-1)随温度变化的关系式如下:

将298.15K时反应的吉布斯自由能的变化值代入Gibbs-Helmholtz方程[7]:[∂(ΔrG/T)/∂T]p=-ΔrH/T2,可计算得到在此温度区间内反应的吉布斯自由能变(单位:J·mol-1)随温度变化的关系式如下:

2.2 在373.15-450 K范围内时
在373.15K、常压条件下,水的摩尔蒸发焓为40.637 kJ·mol-1,该可逆过程的摩尔蒸发熵为108.903 J·mol-1·K-1,通过恒压变温过程和可逆过程设计,并结合相关的热力学公式,可计算得到在373.15 K、标准状态下该反应的焓变、熵变和吉布斯自由能变分别为:11.098 kJ·mol-1、162.655 J·mol-1·K-1、-49.60 kJ·mol-1。
根据各组分热容与温度的关系,可求得在373.15-450K温度范围内反应的热容表达式如下:
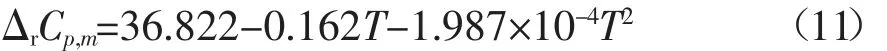
同理可得到373.15-450 K温度范围内反应的焓变和自由能变与温度的关系式分别如下所示:

通过式(9)、(10)、(12)和(13)可计算得到不同温度条件下,反应的焓变、吉布斯自由能变和平衡常数值,其中反应平衡常数按求得,根据计算结果绘制出图1、图2、图3。
3 结果与讨论
由图1可知,反应过程中生成水的相态改变对反应热的影响非常显著。以常压条件下水的沸点为界,在298.15-373.15 K温度区间内该反应的焓变均小于零,表明反应为放热反应,从热力学上讲此时低温对反应有利;而在温度大于373.15K时,反应的焓变均大于零,此时该反应为吸热反应,升高温度将有利于反应向生成酯的方向移动。
由图2可知,在温度区间内该反应的Gibbs自由能变均小于零,说明在此温度区间内,该反应自发进行,从而判知该酯化反应在指定的反应条件下是可能发生的。而在实际反应过程中,可使用高活性的催化剂加速该酯化反应,缩短酯化反应达到平衡所需的时间。

图1 反应焓变与温度的关系
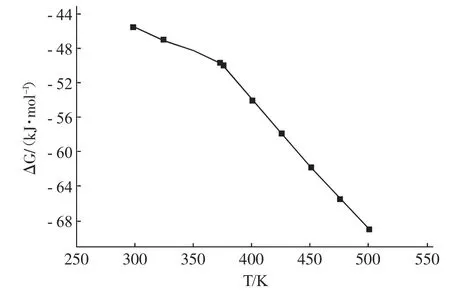
图2 反应Gibbs自由能变与温度的关系
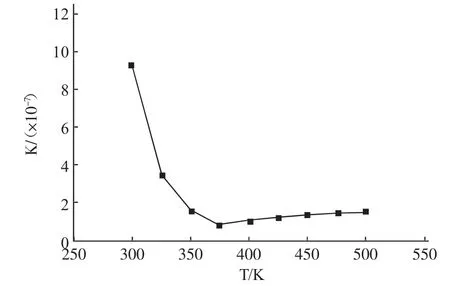
图3 反应平衡常数与温度的关系
由图3可知,在298.15~373.15 K温度区间内,反应平衡常数随温度升高而急剧减小;当温度高于373.15 K时,反应平衡常数随温度的升高而增大,这是由于在两个温度范围内反应热效应的不同引起的。在整个考察温度范围内,反应平衡常数值均非常大,因此在此条件下当反应达到平衡时,反应几乎能够进行到底,这表明该反应在热力学上是完全可能的。另外,由于该反应是一个典型的可逆反应,在反应过程中若能将生成的水及时移出反应体系,将会使平衡向生成酯的方向移动,并缩短反应达到平衡所需的时间。因此,在合成环烷酸酯的过程中,需采取行之有效的方法将反应生成的水及时从体系中分离出去,推动反应向生成环烷酸酯的方向进行以实现酯化反应过程的强化。
4 关于合成环烷酸酯化反应的副反应
由于该反应体系中的-(3,4)-环戊烷基环己烷乙酸在反应温度内是稳定的,副反应主要为乙二醇的分子内和分子间脱水以及环烷酸酯与乙二醇生成环烷酸二酯的反应,它们均是互相竞争的反应。副反应的发生可能是由于乙二醇过量和温度引起的,因此在反应过程中需控制加入乙二醇的量及适宜的反应温度。此外选择合适的催化剂对抑制各种副反应的发生也非常重要。
5 小结
通过对环烷酸与乙二醇酯化反应体系的热力学分析,可以得到以下结论:
(1)采用Benson,Fedors,Rùzicka-Domalski和Joback基团贡献法对-(3,4)-环戊烷基环己烷乙酸、乙二醇和-(3,4)-环戊烷基环己烷乙酸2-羟基乙酯在298.15 K标准状态下的热力学数据进行了估算,为该酯化反应的热力学分析提供了基础数据。
(2)确定了不同温度区间内反应的热容、焓变、Gibbs自由能,及反应平衡常数与温度的关系式,从而为-(3,4)-环戊烷基环己烷乙酸与乙二醇酯化反应体系的热力学分析提供了依据。
(3)热力学分析结果表明,该酯化反应在所分析的温度区间可自发进行,且具有较大的平衡常数,从而验证了环烷酸模型化合物与乙二醇发生酯化反应的可能性。此外,对该反应体系中可能发生的副反应也进行了简要分析。
由于大部分环烷酸均为同系物,对于其它环烷酸与二元醇的酯化反应,可依据本文建立的方法进行热力学分析,从而为高酸原油酯化脱酸技术的开发,并将高酸原油中的环烷酸转化为有益组分—环烷酸酯提供了理论指导。
[1]吕振波,田松柏,翟玉春,等.原油中环烷酸腐蚀预测方法综述[J].石油化工腐蚀与防护,2004,21(3):1-4.
[2]刘光启,马连湘,刘杰.化学化工物性数据手册[M].北京:化学工业出版社,2002.
[3]马沛生.化工数据[M].北京:中国石化出版社,2003.
[4]董新法,方利国,陈砺.物性估算原理及计算机计算[M].北京:化学工业出版社,2006.
[5]PolingBE,Prausnitz J M,John.P.O'Connell.The Properties of Gases and Liquids,5th ed.[M].New York:McGraw-Hill Companies,Inc.,2001.
[6]李梦龙.化学数据速查手册[M].北京:化学工业出版社,2003.
[7]宋世谟,庄公惠,王正烈.物理化学(第三版)[M].北京:高等教育出版社,1992.
Thermodynamics analysis for the esterification of model naphthenic acid compounds
REN Zheng-shi,ZHU Jian-hua
(Faculty of Chemical Science and Engineering,China University of Petroleum,Beijing102249,China)
In this paper,the possibility of the esterification of model naphthenic acid compounds in high acid oil would be verified by thermodynamic analysis method.Due to the particularity of these organic compounds,their thermodynamic date could not be found in literatures.Therefore,the methods of group contribution are applied to estim ate the enthalpy and entropy of naphthenic acid,ethylene glycol and naphthenic acid esters under the standard state.Meanwhile,the functional correlations between the heat capacity of these organic compounds and temperature are established.Furthermore,the Gibbs free energy change and equilibrium constant of the esterification reaction are calculated under the different temperature.The result shows that equilibrium constant of the reaction are very large(>107) which prove the esterification reaction of naphthenic acid and ethylene glycol is possible in view of thermodynamics.
naphthenic acid;esterification;thermodynamic analysis;group contribution method.
10.3969/j.issn.1008-1267.2011.02.009
O624.5
A
1008-1267(2011)02-0022-05
2010-11-02
任正时(1984-),男,湖北荆州人,硕士研究生,主要从事原油深度预处理研究。朱建华(1963-),男,博士生导师,中国石油大学(北京)教授。
