光系统Ⅱ超分子复合物的放氧活性分析
2011-10-11孙瑞雪杨春虹
刘 坤, 孙瑞雪, 赵 晨, 杨春虹
1.中国科学院植物研究所光生物重点实验室,北京 100093
2.中国科学院研究生院,北京100049
光系统Ⅱ超分子复合物的放氧活性分析
刘 坤1,2, 孙瑞雪1,2, 赵 晨1,2, 杨春虹1
1.中国科学院植物研究所光生物重点实验室,北京 100093
2.中国科学院研究生院,北京100049
以高等植物大量捕光色素蛋白复合物 (major light harvesting complexⅡ,LHCⅡb)对光系统Ⅱ (photosystemⅡ,PSⅡ)放氧活性的影响为研究对象,从豌豆类囊体膜中分步提取出三种PSⅡ蛋白复合物,结合电泳和光谱分析,鉴定出三种复合物的主要区别是LHCⅡb含量不同。对于三种PSⅡ色素蛋白复合物在不同光质和光强下放氧速率变化的测定结果表明,三种复合物的放氧速率均存在光饱和点。含有1~2个LHCⅡb三体的粗核心提取物的放氧活性和几乎不含LHCⅡb的纯核心的放氧活性一致,但是它们的放氧活性都远低于含有5~6个LHCⅡb三体的富含PSⅡ颗粒的膜片。说明PSⅡ超分子体系在少于2个外周天线时不能发挥正常的光化学活性。
光系统Ⅱ;大量捕光色素蛋白复合物;放氧速率
引 言
光系统Ⅱ (photosystemⅡ,PSⅡ)吸收太阳光能,利用所吸收的太阳能,催化水的氧化裂解并产生氧气,是地球上所有生物赖以生存的条件[1,2]。在高等植物中,PSⅡ主要以二聚体形式存在,每个单体由至少27~28个亚基组成[3],它们可以分为核心复合物和外周天线系统。核心复合物主要包括:1)D1和D2蛋白,结合有反应中心P680和电子传递链的所有辅因子;2)内周天线蛋白CP43和CP47,结合叶绿素a(chlorophyll,Chl a)分子;3)位于腔侧的放氧复合物 (oxygen evolution complexe,OEC);4)若干低分子量的亚基。对蓝细菌PSⅡ高分辨率 (2.9 Å)晶体结构解析表明,每个PSⅡ结合35个Chl a分子、2个脱镁叶绿素 (pheophytin,Pheo)分子和12个β胡萝卜素分子 (β-carotenoid)[4]。外周天线系统由Lhcb多基因家族编码的6种蛋白与色素形成的复合物组成[5],它们结合的Chl a、Chl b和叶黄素的比值各不相同。其中,大量天线复合物 (major light harvesting chlorophyll a/b complex,LHCⅡb),是由Lhcb1-3基因编码的产物组成的异质三聚体。另外三个亚基CP29(Lhcb4)、CP26(Lhcb6)和CP24(Lhcb5)则以单体的形式存在[6]。PSⅡ的外周天线系统是类囊体膜上最重要的、也是最富集的蛋白系统。
外周天线最主要的作用就是捕获光能,将激发能传递到反应中心。为了避免在强光条件下过剩的激发能对光合色素蛋白复合体超分子体系产生光破坏,外周天线还可以将PSⅡ中过剩的激发能以热的形式耗散掉。从冷冻电镜和原子力显微镜得到的信息表明,核心复合物可以和不同数量的外周天线系统组成超分子复合体。目前广泛接受的是C2S2M2模型,即两个LHCⅡb三体 (trimer S)在CP43和CP26侧紧密地贴近一个核心复合物二聚体(C2),另两个LHCⅡb三体 (trimer M)与CP29和CP24中度结合[7]。植物PSⅡ对于LHCⅡ的亲和力随着外界光强的波动而发生变化,通过LHCⅡ磷酸化、形成聚集体或者叶黄素循环等机制来实现PSⅡ-LHCⅡ超分子体系的能量平衡以及光保护等功能[8~10]。而PSⅡ-LHCⅡ超分子体系的组成变化对植物PSⅡ放氧活性有何影响,目前没有文献给予证实。
材料与方法
实验材料
豌豆 (Pisum sativum L.)播种在一倍营养土搭配两倍蛭石的基质上,生长温度20℃,湿度50%,光周期为16 h光照(150 μmol/m2·s),8 h黑暗。连续培养14 d后收获。
PSⅡ核心复合物的分离纯化
类囊体膜的制备参照改良的Kuhlbrandt方法[11]进行。豌豆苗叶片经过捣碎,除残渣。离心得到的沉淀用清洗液 (0.2 mol/L蔗糖、0.1 mol/L NaCl、50 mmol/L Tricine、5 mmol/L MgCl2,pH 8.0)重悬,再经离心。沉淀悬浮于胀破液 (20 mmol/L MES-NaOH、5 mmol/L MgCl2、15 mmol/L NaCl,pH 6.5)中冰浴静置20 min,离心。沉淀再重悬,色素浓度调整至3 mg/mL液氮速冻,-80℃保存。以上所有提取步骤都在4℃和暗中〔操作时采用绿光(波长520~560nm)照明,光强小于5 μmol/m2·s〕进行。
在类囊体膜的基础上,依照Ghanotakis等的方法提取富含PSⅡ颗粒的类囊体膜 (Photosystem Ⅱ enriched membranes,BBY)[12]。向色素浓度为3 mg/mL的类囊体膜中滴加半倍体积的10%Triton X-100,搅拌增溶30 min,离心40 min(35000 g)。用保存液〔0.4 mol/L 蔗糖、25 mmol/L MES-NaOH(pH 6.5)、10 mmol/L NaCl、5 mmol/L CaCl2、0.5 mol/L甜菜碱〕重悬沉淀,离心收集BBY。以上所有提取步骤都在4℃和暗中进行。
按照Hankamer等[13]的方法提取PSⅡ粗核心 (PSⅡ crude core,CC)以及PSⅡ纯核心(PSⅡ core)。将BBY颗粒用 346 mmol/L的辛基葡萄糖苷 (n-octyl β-D-glucopyranoside,OG)增溶,离心10 min(48400 g)。上清液经过稀释后再次离心1 h(150000 g,4℃),所得沉淀即为粗核心。粗核心经过50 mmol/L十二烷基麦芽糖苷 (n-Dodecyl β-D-pyranoside,DDM)增溶后,通过蔗糖梯度离心 (90000 g,5 h),分离出PSⅡ核心二聚体。以上所有提取步骤都在4℃和暗中进行。
变性聚丙烯酰胺凝胶电泳
按照Hunt等[14]的方法,制备含有6 mol/L尿素的聚丙烯酰胺分离胶 (15%T,4%C)和浓缩胶 (5%T,4%C)。将样品与样品缓冲液 〔12%SDS(w/v),6% 巯基乙醇,30% 甘油 (w/v),0.05%考马斯亮蓝G250,150 mmol/L Tris-HCl(pH 7.0)〕混合均匀,上样前在40℃水浴1 h。
叶绿素浓度测定
将10 μl的样品溶于2 ml的80%丙酮,离心去除沉淀。测定750、663.6和646.6 nm下的吸光度。按照Porra[15]的公式,计算出Chl a和Chl b的浓度。
吸收光谱和77 K荧光光谱
吸收光谱用Shimadzu UV-2550双光束分光光度计 (岛津,东京)在室温下进行检测,扫描速率为100 nm/min,分辨率为0.5 nm。样品色素浓度为10 μg/mL。
样品的荧光发射光谱用Hitachi F-7000荧光分光光度计 (日立,东京)在77 K条件下检测。激发光选用波长为436 nm,激发狭缝和发射狭缝分别是10 nm和5 nm。样品色素浓度为 1.5 μg/mL。
液相放氧速率测定
样品的放氧活性以单位时间内、单位质量Chl a(核心复合物中的Chl a)的放氧量(μmol O2/mg Chl aPSⅡcore·h)表示。放氧量用Clark型氧电极 (汉莎科学仪器,诺福克)于25℃水浴下进行测定,电子受体2,6-二氯对苯醌 (2,6-dichloro-p-benzoquinone,2,6-DCBQ)的浓度为0.5 mmol/L,样品浓度为10 μg Chl/mL。光源采用100 W、无紫外波段的OSRAM卤钨灯,通过光导,以相等光斑大小导入放氧反应界面。
结 果
提取并鉴定PSⅡ色素蛋白复合物
图1所示为三种不同的PSⅡ提取物的电泳结果,从中可以分辨出三种复合物的亚基组成。三种复合物的主要差别在于外周天线系统的含量不同,特别是大量天线LHCⅡb,表现出由富含PSII颗粒的类囊体膜 (BBY)、PSⅡ粗核心(CC)、向PSⅡ核心逐渐减低的过程。
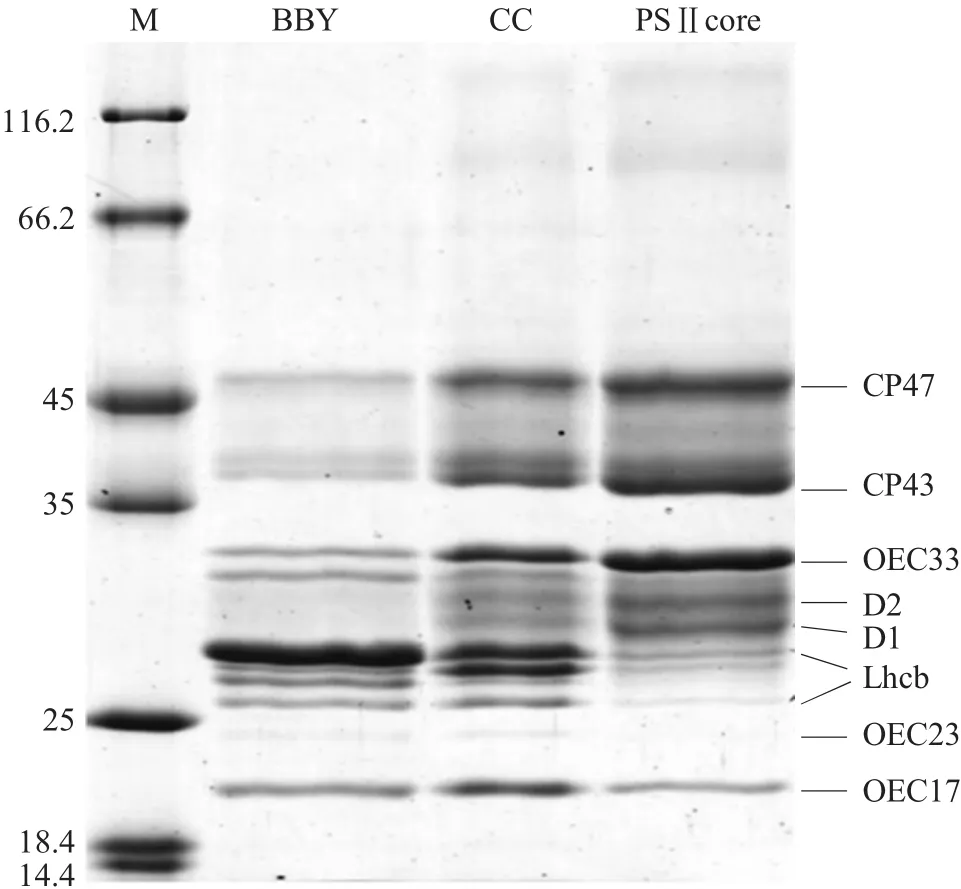
图1 三种PSⅡ提取物的SDSPAGE电泳图谱 标准分子量蛋白标签的分子量在左侧标出。主要蛋白质条带在右边标出Fig.1 SDS-PAGE profileofthe three types of PSⅡpreparations Molecular weights(kDa)of the protein marker bands are given in the left margin
图2表示三种样品的室温吸收光谱。BBY的吸收光谱呈现4个主要的吸收峰 (红光区为650和675 nm,蓝光区为435和470 nm),435和675 nm附近的吸收峰对应BBY的Chl a的吸收,而470和650 nm附近的两个主峰主要对应于结合在LHCⅡb上的Chl b分子的吸收峰。CC或者PSⅡ核心的吸收光谱在435和675 nm附近的吸收峰与BBY的相应的吸收峰相对应,而在Chl b分子的吸收峰附近(470和650 nm)的吸收大大低于BBY,特别是PSⅡ核心在这一区域几乎没有吸收峰。这一结果与图1的结果相对应,BBY含有最高量的LHCⅡb组分,而CC或者PSⅡ核心的LHCⅡb含量递减。
我们根据Porra[15]的计算方法测定出BBY中Chl a/Chl b为2,CC中Chl a/Chl b为4.22,PSⅡ核心中Chl a/Chl b为22.8。前人的结果表明:LHCⅡb[16,17]、CP29[18]、CP26[18]和CP24[19]中的Chl a/Chl b分别是1.33、3.4、2.5和1.17。而核心复合物是没有Chl b的,这也说明三种提取物所含的LHCⅡb是逐渐减少的。
图3所示为由436 nm波长激发不同PSⅡ色素蛋白复合物提取物的荧光发射光谱。可以看出,在最大发射峰归一化后,最大荧光发射峰位从BBY的683.6 nm红移到CC的685.8 nm,再到PSⅡ核心的687.6 nm。放氧速率的变化
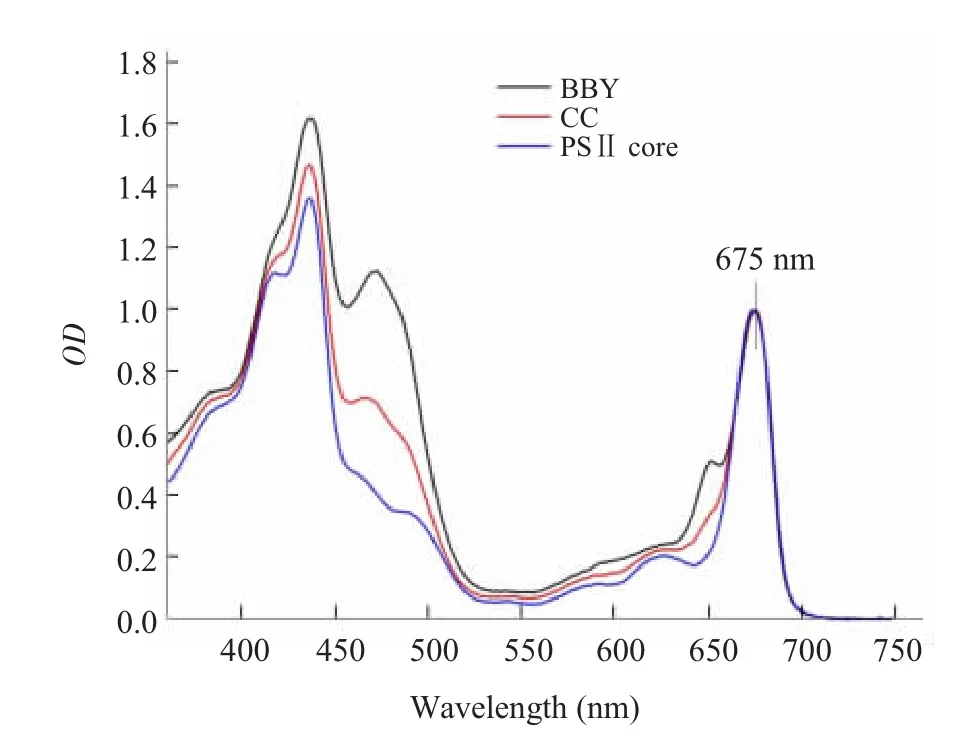
图2 三种PSⅡ提取物的室温吸收光谱 按10 μg Chl/mL的总叶绿素量测定。然后在Qy区最大吸收值处归一化Fig.2 Room temperature absorption spectra of three types of PSⅡpreparation with varying contents of LHCIIb The Chl concentration is 10 μg Chl/mL.The spectra are normalized to the maximum absorption in the Qyregion
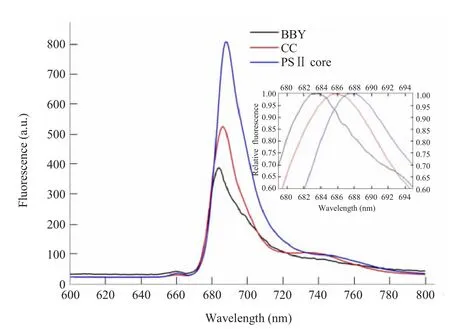
图3 三种PSⅡ提取物的77 K荧光发射光谱 (激发光为436 nm) 叶绿素的浓度为1.5 μg Chl/mL。插图表示归一化后各个提取物最大发射峰峰位的红移Fig.3 77 K fluorescence emission spectra of the three types of PSⅡ preparations The spectra were measured upon excitation at 436 nm(Chl a).The Chl concentration was 1.5 μg Chl/mL. Inset displays the red shift of maximum peaks from BBY to PSⅡcore
为了分析不同PSⅡ提取物的功能,我们测量了BBY、CC和PSⅡ核心在不同光强条件下的放氧速率。
放氧速率与放氧复合物的数量有直接关系。通过对三种样品的分析已知,不同提取物的主要区别是PSⅡ超分子体系所结合的LHCⅡb数量的不同。我们测定出BBY中Chl a/Chl b为2,CC中Chl a/Chl b为4.22,PSⅡ核心中Chl a/Chl b为22.8,而LHCⅡb中Chl a/Chl b等于1.33,再结合三种样品各自的Chl a/Chl b,计算各种复合物中纯核心所结合的Chl a在总叶绿素中的比例。根据这个比例,计算出在放氧复合物数量一致时,三种复合物各自的放氧速率,得到图4。
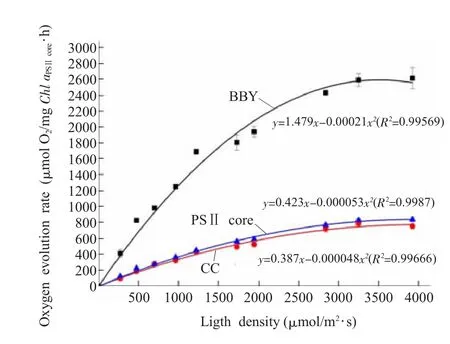
图4 三种PSⅡ提取物的放氧速率随光强的变化 每个测量值表示为三次独立测量的平均值±标准差。放氧速率以等量核心复合物Chl a计算Fig.4 Light dependent changes of oxygen evolution rates of the three types of PSⅡpreparations The results are expressed as x±s of three individual experiments.The values are calculated based on the amount of Chl a in PSII core complex
图4 表示不同样品在不同光强条件下的放氧速率,各样品的放氧曲线均存在光饱和点。在达到饱和光强之前,放氧速率随光强增加呈现近似线性上升的趋势。在光强达到饱和后,放氧速率的增加减慢,最后达到最大值。
为了表征不同的PSⅡ提取物在达到饱和光强之前的放氧速率与光强变化的数量关系,我们对各组测量点进行了二次函数拟合。如图4所表示,我们得到BBY、CC和PSⅡ核心的三个拟合函数,分别是:y=1.479x-0.00021x2、y=0.387x-0.000048x2和 y=0.423x-0.000053x2。根据所得函数,在 3 521 μmol/m2·s光强下,BBY的最大放氧速率为2604 μmol O2/mg Chl aPSⅡcore·h,和所测数值一致。而CC和PSⅡ核心根据函数计算的最大放氧分别为 780 和 844 μmol O2/mg Chl aPSⅡcore·h,分别出现在 4031 和 3991 μmol/m2·s光强处,与测量结果有很好的吻合。计算三个函数的一阶导数,得到BBY、CC和PSⅡ核心的放氧速率随光强增强的变化率,分别是:dy/dx=1.479-0.00042x、dy/dx=0.387-0.000096x和dy/dx=0.423-0.000106x。从这一计算可以看出,在低光强时,放氧速率随光强增强的变化率近似于常数。CC和PSⅡ核心随着光强增加而上升的速率比较接近 (分别为0.387和0.423),而BBY放氧活性的上升速率明显大于CC和PSⅡ核心 (1.479)。从图4中还可以看出,随着光强增加,BBY不仅放氧速率上升较快,而且在同一光强下具有最高的放氧能力,远远大于CC或者PSⅡ核心的放氧能力。
讨 论
PSⅡ是进行光合作用光反应的原初反应的场所,是直接决定光合作用光反应效率的关键部位。为了高效率地吸收和传递光能,植物经过30亿年的进化,发展了非常复杂的捕光天线系统。天线系统怎样和核心复合物结合在一起?以怎样的叶绿素通道把激发能传递到反应中心?为适应环境中光强的变化,天线系统和核心复合物之间保持怎样的数量关系?虽然已经有大量的研究阐明PSⅡ核心复合物可以和外周天线LHCⅡb组成多种不同的超分子体系[20,21],但是,这些不同的超分子体系的功能如何变化,到现在还没有得到系统的研究。本文提取三种不同LHCⅡb含量的PSⅡ复合物,主要通过测定它们不同光强下的放氧速率,探讨了PSⅡ超分子体系中LHCⅡb的结合量对于PSⅡ反应中心功能以及放氧复合体活性的影响。
对于三种样品,均出现饱和,且饱和光强相同。PSⅡ在达到饱和值之前,其放氧活性和光强呈线性相关。就PSⅡ自身而言,限制放氧速率的因素是两方面的,其一是光能吸收和传递存在效率限值;其二是反应中心电荷分离后,在体内需要完整的电子传递链,在体外需要依赖人工电子受体。这种电子载体是一种在PSⅡ外扩散的物质,其接受电子的效率在体外受扩散率控制,与浓度相关,在体内受到膜和膜蛋白的区域化限制[22]。
从不同PSⅡ复合物的荧光发射光谱可以看出,三种复合物各自的放氧活性不同,相应于不同的荧光发射最大峰值,从Chl a的荧光发射光谱中能够看到,最大发射峰从BBY的683.6 nm红移到CC的685.8 nm,再红移到PSⅡ核心的687.6 nm,表明具备完整外周天线的BBY可以将吸收的光能更多地激发传递到反应中心。而随着外周天线的减少,峰位红移,表明内周天线CP43和CP47的荧光发射增加,反应中心的荧光发射减少。这一现象说明了外周天线的作用不仅仅是吸收光能,并将产生的激发能传递到反应中心,而且,外周天线的结合也影响到内周天线和反应中心间的能量传递,最终影响到反应中心的光化学反应和放氧复合物功能。
根据每个LHCⅡb单体中有8个Chl a和6个Chl b[16],纯核心复合物二体中Chl a=70[4],结合我们提取的三种复合物的Chl a/Chl b(表1),我们可以得出BBY中每个二体周围平均有5.83个三体LHCⅡb,CC中每个二体周围平均有1.36个三体LHCⅡb,而PSⅡ核心中几乎没有LHCⅡb。这与Dekker等人提出的C2S2M2模型[7]相吻合,即核心复合物与其外周天线的结合强度是不同的。本文所提的BBY是LHCⅡb更为充裕的状态[23],其应以C2S2M2超分子体为主,并且还结合了更为松散的LHCⅡb三体或单体。而PSⅡ粗核心在提取的过程中,中度结合的LHCⅡb三体被去垢剂剔除,仅留下紧密结合的LHCⅡb。
观察放氧速率随光强变化的增加率,我们发现CC和PSⅡ核心在相同光质条件下的增长率几乎一致。可见,在核心外结合1~2个LHCⅡb,其传递的光能对于放氧复合物的光化学反应没有明显的作用。我们的观察与Caffarri等人[24]对于用温和去污剂处理拟南芥类囊体膜,分离出的不同组合的PSⅡ-LHCⅡ超分子体的结果不一致,这是由于他们只是在非常低的光强 (180 μmol/m2·s)条件下作的相同观察,其测定放氧速率的光强较低,故并未反映出这些超分子体之间放氧活性的差异。
综上所述,我们可以提出结论,LHCⅡ-PSⅡ超分子体系的5个以上的外周天线 (BBY)有助于提高PSⅡ中的能量传递效率和放氧效率,这一体系所结合的外周天线少于2个,则不能发挥正常的光化学活性。
1. Barber J.Photosynthetic energy conversion:Natural and artificial.Chem Soc Rew,2009,38(1):185~196
2. Gust D, Moore T, Moore A. Solar fuels via artificial photosynthesis. AccountsChem Res, 2009, 42(12):1890~1898
3. Barber J.Crystal structure of the oxygen-evolving complex of photosystem Ⅱ.Inorg Chem,2008,47(6):1700~1710
4. Guskov A,Kern J,Gabdulkhakov A,Broser M,Zouni A,Saenger W. CyanobacterialphotosystemⅡ at 2.9 Å resolution and the role of quinones,lipids,channels and chloride.Nat Struct Mol Biol,2009,16(3):334~342
5. Jansson S. The light-harvesting chlorophylla/b-binding proteins.Biochim Biophys Acta,1994,1184(1):1~19
6. Caffarri S,Croce R,Cattivelli L,Bassi R.A look within LHCⅡ: Differential analysis of the Lhcb1-3 complexes building the major trimeric antenna complex of higher-plant photosynthesis.Biochemistry,2004,43(29):9467~9476
7. Dekker J,Boekema E.Supramolecular organization of thylakoid membrane proteinsin green plants. Biochim Biophys Acta,2005,1706(1-2):12~39
8. Allen J.Thylakoid protein phosphorylation,state 1 state 2 transitions, and photosystem stoichiometry adjustment:Redox control at multiple levels of gene expression-Minireview. Physiol Plantarum, 1995, 93(1):196~205
9. Horton P,Wentworth M,Ruban A.Control of the light harvesting function of chloroplast membranes:The LHCⅡ-aggregation model for non-photochemical quenching.FEBS Lett,2005,579(20):4201~4206
10.Ruban A,Phillip D,Young A,Horton P.Carotenoid dependent oligomerization of the major chlorophylla/blight harvestingcomplexofphotosystemⅡofplants.Biochemistry,1997,36(25):7855~7859
11.Kuhlbrandt W,Wang D,Fujiyoshi Y.Atomic model of plant light-harvesting complex by electron crystallography.Nature,1994,367(6464):614~621
12.Ghanotakis DF,Demetriou DM,Yocum CF.Isolation and characterization of an oxygen-evolving photosystem-Ⅱreaction center core preparation and a 28 kDa Chl-a-binding protein.Biochim Biophys Acta,1987,891(1):15~21
13.Hankamer B,Nield J,Zheleva D,Boekema E,Jansson S,BarberJ. Isolation and biochemicalcharacterisation of monomeric and dimeric photosystemⅡcomplexes from spinach and their relevance to the organisation of photosystemⅡin vivo.Eur J Biochem,1997,243(1-2):422~429
14.Schägger H.SDS electrophoresis techniques.In:Hunte C,Jagow G,Schegger H.Membrane protein purification and crystallization-a practical guide.Second edition.San Diego:Elsevier Inc,2003.85~103
15.Porra RJ,Thompson WA,Kriedemann PE.Determination of accurate extinction coefficients and simultaneous-equations for assaying chlorophyll-a and chlorophyll-b extracted with 4 different solvents-verification of the concentration of chlorophyll standards by atomic-absorption spectroscopy. Biochim Biophys Acta,1989,975(3):384~394
16.Barros T,Kuhlbrandt W.Crystallisation, structure and functionofplantlight-harvestingcomplexⅡ. Biochim Biophys Acta,2009,1787(6):753~772
17.Liu Z,Yan H,Wang K,Kuang T,Zhang J,Gui L,An X,Chang W. Crystal structure of spinach major light-harvesting complex at 2.72 Å resolution.Nature,2004,428(6980):287~292
18.Ruban A,Lee P,Wentworth M,Young A,Horton P.Determination of the stoichiometry and strength of binding ofxanthophyllstothephotosystemⅡlightharvesting complexes.J Biol Chem,1999,274(15):10458~10465
19.Pagano A,Cinque G,Bassi R.In vitroreconstitution of the recombinant photosystemⅡlight-harvesting complex CP24 and its spectroscopic characterization.J Biol Chem,1998,273(27):17154~17165
20.Boekema EJ,van Roon H,Calkoen F,Bassi R,Dekker JP.Multiple types of association of photosystem II and its light-harvesting antenna in partially solubilized photosystemⅡ membranes.Biochemistry,1999,38(8):2233~2239
21.Danielsson R,Albertsson PA,Mamedov F,Styring S.Quantification,of photosystemⅠandⅡin different parts of the thylakoid membrane from spinach.Biochim Biophys Acta,2004,1608(1):53~61
22.Kirchhoff H,Mukherjee U,Galla H.Molecular architecture ofthe thylakoid membrane: Lipid diffusion space for plastoquinone.Biochemistry,2002,41(15):4872~4882
23.Haferkamp S,Haase W,Pascal A,van Amerongen H,Kirchhoff H.Efficient light harvesting by photosystem Ⅱrequiresanoptimized protein packing densityin Grana thylakoids.J Biol Chem,2010,285(22):17020~17028
24.Caffarri S,Kouril R,Kereiche S,Boekema E,Croce R.Functionalarchitecture ofhigherplantphotosystem Ⅱsupercomplexes.EMBO J,2009,28(19):3052~3063
Analysis of Oxygen Evolution of PhotosystemⅡSuper-Complexes
LIU Kun1,2,SUN Ruixue1,2,ZHAO Chen1,2,YANG Chunhong1
1.Institute of Botany,Key Laboratory of Photobiology,Chinese Academy of Science,Beijing 100093,China;
2.Graduate School of the Chinese Academy of Sciences,Beijing 100049,China
Communication by editorial board members(LIU Pingsheng)
This work was supported by grants from The National Natural Science Foundation of China(71070212),The"973"Program(2009cb118501)
Oct 30,2010 Accepted:Dec 3,2010
YANG Chunhong,Tel:+86(10)62836252,Fax:+86(10)62836219,E-mail:yangch@ibcas.ac.cn
Three different types of photosystem Ⅱ (PSⅡ)preparations,PSⅡ enriched membranes,PSⅡcrude core particles and PSⅡcore complexes,were isolated from thylakoid membranes of pea seedlings.The structural analysis showed that the main difference among the preparations was the size of the antenna cross section in the PSⅡ macrostructure.The functional analysis to different PSⅡ preparations showed that the oxygen evolution from PSⅡ enriched membranes,containing 5~6 LHCⅡb trimers per PSⅡ dimmer,was about three times higher than those of PSⅡ particle preparation(containing 1~2 LHCⅡb)and the PSⅡcorecomplexes(containingalmostnoLHCⅡb). ComparingthedifferencesamongthethreePSⅡpreparations reveals that the attachment of more than 2 trimeric LHCⅡb is the prerequisite for the perfect functionality of PSⅡsupercomplexes.
Photosystem Ⅱ;Major light-harvesting chlorophyⅡ a/b complexe of photosystem Ⅱ;Oxygen evolution rate
本文通过“绿色通道”投稿 (推荐编委:刘平生)
2010-10-30;接受日期:2010-12-03
国家自然科学基金项目(71070212),“973”计划项目(2009cb118501)
杨春虹,电话:(010)62836252,传真:(010)62836219,E-mail:yangch@ibcas.ac.cn
Q946