高速逆流色谱法分离制备花生壳中的黄酮类化合物
2011-10-09牛丹丹刘彩霞刘绣华李明静1河南大学化学化工学院
牛丹丹,刘彩霞,刘绣华,李明静*1河南大学化学化工学院;
河南省天然药物与免疫工程重点实验室,开封 475004
高速逆流色谱法分离制备花生壳中的黄酮类化合物
牛丹丹1,2,刘彩霞1,2,刘绣华2,李明静1,2*1河南大学化学化工学院;2
河南省天然药物与免疫工程重点实验室,开封 475004
应用高速逆流色谱法首次从花生壳中分离制备了 3种黄酮类化合物。以正己烷-乙酸乙酯-甲醇-水-冰醋酸 (5∶3∶3.5∶5∶0.25,v/v)为两相溶剂系统,在主机转速 800 r/min、流速 2 mL/min、检测波长 275 nm条件下进行分离制备,纯度用 HPLC法测定,各化合物结构经质谱和核磁共振氢谱、碳谱鉴定。结果表明,100 min内从70 mg花生壳粗提物中一步分离制备得到木犀草素 11.0 mg,香叶木素 2.2 mg,5,7-二羟基色原酮 5.2 mg,其纯度均达 96.0%以上。利用该方法可以对花生壳中的黄酮类化合物进行快速的分离和纯化。
高速逆流色谱;花生壳;木犀草素;香叶木素;5,7-二羟基色原酮
Abstract:Three flavoneswere prepared,isolated and purified from peanut hull by high-speed counter-current chromatography(HSCCC)for the first time.A two-phase solvent system composed of n-hexane:ethyl acetate:methanol:water:acetic acid(5∶3 ∶3.5∶5∶0.25,v/v)was used.The obtained fractionswere analyzed by HPLC and identified byMS,1H and13C NMR.W ithin 100 minute,11.0 mg of luteolin,2.2 mg of dios metin,and 5.2 mg of 5,7-dihydroxychromonewith their purities over 96.0%were obtained from 70 mg crude extractof peanut hull in one-step elution under the conditions of a flow rate of 2.0 mL/min,while the apparatus rotated at 800 r/min and the effluentwas detected at 275 nm.The results indicated thatHSCCC was a powerful technique for the separation and purification of flavones from the peanut hull.
Key words:HSCCC;peanut hull;Luteolin;Dios metin;5,7-dihydroxychromone
花生 (A rachis hypogaeaL.)亦名落花生,长生果,属豆科一年生草本科植物。我国广泛种植花生,在花生的加工过程中,每年产生花生壳约 450万吨,其中大部分被当作废弃物,仅有少量被加工成饲料或用于化工原料,资源利用率较低[1]。花生壳中以木犀草素为代表的黄酮类化合物具有降低血胆固醇、降血压、降血脂和扩张冠状动脉等作用,还具有抗氧化、镇咳、祛痰、平喘、抗菌、消炎、增强免疫和抗肿瘤等药理活性[2-4]。因此,分离制备花生壳总黄酮中的活性成分对进一步研究黄酮类化合物药效作用机制和开发新的天然药物具有重要的意义。
目前,花生壳的提取分离主要采用柱色谱法,分离周期长,消耗溶剂多,操作复杂。高速逆流色谱(High-speed countercurrent chromatography,HSCCC)作为一种新型分离纯化技术,操作方便、快捷,分离度较高,液-液分配体系选择广泛,克服了由固相载体带来的样品结合、失活、污染等缺点。它已被广泛应用于天然产物活性成分的分离制备和中草药的分析鉴定[5,6]。本文采用乙醇提取和 LSA-30型大孔吸附树脂从花生壳中得到粗提物,以此粗提物经HSCCC一步分离得到木犀草素、香叶木素、5,7-二羟基色原酮 (纯度均高于 96.0%),为花生壳进一步开发利用提供了一种快速实用的新方法。目前,尚未见 HSCCC分离制备花生壳中的黄酮类化合物。
1 仪器与材料
1.1 仪器
TBE-300A型高速逆流色谱仪 (中国上海同田生化技术有限公司);AKTA purifier泵及紫外检测系统 (美国 GE公司);Agilent 1100 HPLC仪 (美国Agilent公司);超声波清洗器 (上海现科仪器有限公司);核磁共振仪 (Bruker AV400);质谱仪 (Bruker ESQU IRE-LC);XTS显微熔点仪 (温度计未校正)。
1.2 试剂
正己烷、乙酸乙酯、甲醇、冰醋酸均为分析纯,高效液相色谱所用的甲醇为色谱纯,均为天津市四友精细化学品有限公司;水为二次蒸馏水;LSA-30型大孔吸附树脂 (西安蓝晓科技有限公司)。
1.3 材料
花生壳采自河南开封近郊,40℃烘干,粉碎,备用。
2 实验方法
2.1 花生壳总黄酮粗提物的制备
取花生壳粉末 300 g,置于 10 L圆底烧瓶中,加入 70%乙醇 7 L,80℃水浴回流提取 3次,每次 2.5 h,抽滤,合并滤液减压浓缩至无醇味。将浓缩液经LSA-30型大孔吸附树脂吸附后,先用蒸馏水淋洗至无色,除去水溶性杂质,依次用 30%、50%、70%、95%的乙醇洗脱至三氯化铝显色剂无颜色变化,收集洗脱液经减压浓缩、冷冻干燥,得花生壳粗提物 4 g,备用。
2.2 溶剂体系及样品溶液的配制
在分液漏斗中配制正己烷-乙酸乙酯-甲醇-水-冰醋酸 (5∶3∶3.5∶5∶0.25,v/v)两相溶剂体系 ,充分震摇后在室温下静置 12 h。使用前将上相和下相分离,超声脱气 30 min,冷却、待用。称取 70 mg花生壳粗提物,用溶剂体系的上下相各 4 mL超声溶解样品,备用。
2.3 高速逆流色谱法分离制备
开启恒温循环器,设定温度为 25℃,以 10 mL/min的流速将上相 (固定相)泵入主机管路,当有固定相流出时,改用 2 mL/min的流速泵下相 (流动相),同时开启 AKTA purifier检测系统,按 800 r/min的转速启动主机。观察透明容器,待流动相以液滴形式穿透固定相,从管柱出口流出,且基线稳定后,将样品溶液由载样注射器经进样圈注入。管柱出口处的流出物经 AKTA purifier的紫外检测器在275 nm波长下进行检测,记录色谱图,根据色谱图收集目标成分。
2.4 高效液相色谱分析条件
色谱柱:Agilent Zorbac C18(21 mm×150 mm,5 μm),流动相为 0.1%磷酸水溶液和甲醇,梯度洗脱程序为 20 min内甲醇从 35%升至 65%;检测波长为 275 nm;柱温为 30℃;进样量为 10μL;流速为0.3 mL/min。
3 结果与讨论
3.1 溶剂系统选择
在高速逆流色谱中,溶剂体系的选择至关重要,合适的溶剂体系是其分离的关键。通常样品成分在溶剂系统中的分配系数及管柱中固定相能否实现较高的保留值均会影响分离效果。根据色谱理论,利用 HSCCC进行样品分离的必要条件是样品在互不相溶的两相中具有合适的分配系数[7],一般情况下分配系数在 0.5~2之间,固定相保留值在 50%以上,及两相溶剂体系分层时间小于 30 s,能得到满意的分离效果。分配系数的测定,可利用 TLC、HPLC、HPCE来测定[8,9],本文采用 TLC和 HPLC测定。
3.1.1 薄层色谱法 (TLC)
实验选取乙酸乙酯 -甲醇 -水 、氯仿 -甲醇 -水 、正己烷-乙酸乙酯-甲醇-水三个体系做为分离的溶剂系统。分别配制不同比例的上述三个体系,取上下相各 5 mL于 10 mL具塞量瓶中,加入 5 mg花生壳粗提物,超声溶解,转移至分液漏斗中,静置分层,用毛细管取近似等量的上下相于硅胶薄层板上,以氯仿-乙酸乙酯-冰醋酸 (1∶1∶0.02,v/v)为展开剂,展开,碘显色。薄层色谱的分析结果表明:溶剂体系为乙酸乙酯 -甲醇 -水 (2∶1∶1,v/v)时 ,目标化合物基本集中在下相甲醇和水的体系中,不符合溶剂体系选择的一般要求;溶剂体系为氯仿-甲醇-水 (3∶4∶2,v/v),正己烷 -乙酸乙酯 -甲醇 -水 (5∶3∶3.5∶5,v/v)时 ,目标化合物在溶剂体系的上下相中溶解程度相近。通过薄层色谱对溶剂体系的初步筛选确定氯仿-甲醇 -水 (3∶4∶2,v/v),正己烷 -乙酸乙酯 -甲醇 -水 (5∶3∶3.5∶5,v/v)为分离体系。
3.1.2 高效液相色谱法 (HPLC)
用 HPLC测定 3.1.1条件下确定的两个体系的分配系数:称取适量的花生壳粗提物置于 5 mL试管中 ,分别加入氯仿 -甲醇 -水 (3∶4∶2,v/v),正己烷 -乙酸乙酯 -甲醇 -水 (5∶3∶3.5∶5,v/v)两体系的上下相各 1 mL,超声使样品充分溶解,静置平衡,取上下相各 0.2 mL,离心浓缩干,用色谱级甲醇溶解,经HPLC检测,并计算出各目标化合物的分配系数 (K=Aupper/Alower,A为目标峰面积),结果见表 1。

表1 3种黄酮类化合物在两种溶剂体系中的分配系数(K)Table 1 The K(Partition coefficients)valuesof 3 flavones(1-3)in tow solvent systems
由表 1可知,样品在正己烷-乙酸乙酯-甲醇-水(5∶3∶3.5∶5,v/v)溶剂体系中的分配系数在 0.5~2范围内,通过 HSCCC预分离后,3种化合物可以分离,但分离时间过长。通过实验发现,在正己烷-乙酸乙酯 -甲醇 -水 (5∶3∶3.5∶5,v/v)体系中加入一定比例的冰醋酸,可以改善分离效果。当实验改为正己烷 -乙酸乙酯 -甲醇 -水 -冰醋酸 (5∶3∶3.5∶5∶0.25,v/v)体系分离时,3种化合物分离较好,固定相保留率为 65%,分离时间适中。实验表明,由于所分离黄酮类化合物分子结构中含有酚羟基,在体系中加入少量的酸,让目标样品不电离增加有机性,从而可以改善分离效果[10,11]。因此,确定正己烷-乙酸乙酯 -甲醇 -水 -冰醋酸 (5∶3∶3.5∶5∶0.25,v/v)为最终使用体系。
3.2 HSCCC分离参数的考察
3.2.1 样品溶剂量的考察
实验采用等体积的上下相进行样品的溶解,分别考察了总体积为 (5、6、7、8、9、10 mL)溶剂量溶解70 mg花生壳粗提物。实验结果表明:当溶剂量小于 8 mL时有部分被分离物质不溶;当溶剂量大于 8 mL时,虽然被分离物质能够很好的被溶解,但是在进行 HSCCC分离过程中会有固定相的流失,故采用总体积为 8 mL的溶剂量作为最佳溶剂量。
3.2.2 进样量的考察
本实验同时还考察了不同的上样量 (50、60、70、80 mg),当上样量大于 70 mg时,选用 3.2.1条件下确定溶剂用量时,不能使被分离物质彻底溶解。因此,体系进样量不超过 70 mg为宜。
3.3 HSCCC分离制备的结果
按“2.3”节操作方法 100 min内经 HSCCC分离制备得到 3个化合物 (见图 1中 1、2、3)。结果显示,从 70 mg花生壳粗提物中一次分离得到化合物1(11.0 mg),化合物 2(2.2 mg),化合物 3(5.2 mg)。而且,此法分离时间短,可以采用连续进样方式来制备此三种化合物。
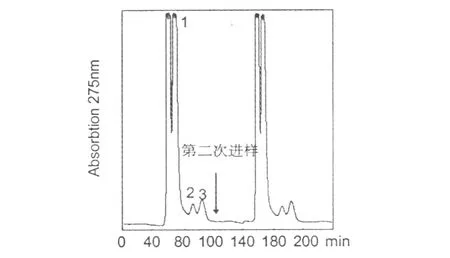
图1 花生壳粗提物高速逆流色谱图Fig.1 HSCCC chromatogram of crude extract from peanut hull

图2 (a)花生壳粗提物、(b)木犀草素、(c)香叶木素和 (d)5,7-二羟基色原酮的 HPLC谱图Fig.2 HPLC chromatograms of(a)the crude extract of peanut hull,(b)luteolin,(c)dios metin,and(d)5,7-dihydroxychromone
3.4 纯度分析
采用“2.4”节的条件对高速逆流色谱所得到的化合物 1、2、3进行 HPLC检测分析,经峰面积归一化法计算可知纯度均大于 96.0%,如图 2所示。
3.5 结构鉴定
化合物 (1) 为黄色粉末,mp.327~329℃,EI-MSm/z:286[M]+,分子式为 C15H10O6。1H NMR(DMSO-d6,400 MHz)δ:7.41(1H,dd,J=8.4,2.0 Hz,H-6′),7.39(1H,d,J=2.0 Hz,H-2′),6.87(1H,d,J=8.4 Hz,H-5′),6.66(1H,s,H-3),6.43(1H,d,J=2.0 Hz,H-8),6.19(1H,d,J=2.0 Hz,H-6),12.97(1H,s,OH-5),10.75(1H,s,OH-7),9.91(1H,s,OH-3′),9.41(1H,s,OH-4′);13C NMR(DMSO-d6,100MHz)δ:164.3(C-2),103.3(C-3),182.1(C-4),157.5(C-5),99.3(C-6),164.4(C-7),94.3(C-8),161.9(C-9),104.2(C-10),122.0(C-1′),113.8(C-2′),146.2(C-3′),150.2(C-4′),116.5(C-5′),119.4(C-6′)。以上光谱数据与文献[12]报道的木犀草素一致,故鉴定该化合物为木犀草素。
化合物 (2) 为黄色粉末,mp.256~258℃,EI-MSm/z:300[M]+,分子式为 C16H12O6。1H NMR(DMSO-d6,400 MHz)δ:7.55(1H,d,J=2.1 Hz,H-2′),7.65(1H,dd,J=8.2,2.1 Hz,H-6′),6.92(1H,d,J=8.2 Hz,H-5′),6.90(1H,s,H-3),6.50(1H,d,J=2.0 Hz,H-8),6.20(1H,d,J=2.0 Hz,H-6),13.0(1H,s,OH-5),10.8(1H,s,OH-7),9.50(1H,s,OH-3′);13C NMR(DMSO-d6,100 MHz)δ:163.9(C-2),104.0(C-3),181.9(C-4),157.8(C-5),99.5(C-6),164.6(C-7),94.63(C-8),161.9(C-9),103.6(C-10),119.8(C-1′),113.10(C-2′),148.52(C-3′),151.2(C-4′),116.40(C-5′),121.0(C-6′),56.0(OCH3)。以上光谱数据与文献[13]报道的香叶木素一致,故鉴定该化合物为香叶木素。
化合物 (3) 为黄色粉末,mp.270~272℃,EI-MSm/z:178[M]+,分子式为 C9H6O4。1H NMR(DMSO-d6,400 MHz)δ:12.6(1H,s,OH-5),10.88(1H,s,OH-7),8.16(1H,d,J=610 Hz,H-2),6.26(1H,d,J=610 Hz,H-3),6.18(1H,d,J=2.1 Hz,H-6),6.34(1H,d,J=2.1 Hz,H-8).13C NMR(DMSO-d6,100 MHz)δ:157.3(C-2),110.4(C-3),181.6(C-4),162.0(C-5),99.1(C-6),165.5(C-7),94.0(C-8),157.8(C-9),104.7(C-10)。以上光谱数据与文献[14]报道 5,7-二羟基色原酮一致,故鉴定该化合物为 5,7-二羟基色原酮。
4 结论
本文应用高速逆流色谱法首次从花生壳粗提物中一步分离制备了木犀草素、香叶木素、5,7-二羟基色原酮三种黄酮类化合物,均达到较好的分离和纯化效果。实验结果表明,HSCCC可以从粗提物中一次分离得到多个纯度较高的单体,并且可以连续进样,分离周期短、操作快捷、简便,对于分离得到的样品可应用于制备对照品,研究中药材化学成分以及新药开发等领域。高速逆流色谱在天然产物分离纯化领域具有独特的优势,必将促进现代分离技术应用的发展。
1 LiQF(李清芳),XuWD(徐卫东).Extraction and purification of total flavonoids from peanut hulls.Food Sci(食品科学),2009,30:101-105.
2 Bi J(毕洁),Yang QL(杨庆利 ),Yu LN(于丽娜),et al.Ethanol extraction technology of flavonoids from peanut hull.M od Che mInd(现代化工),2008,28:316-319.
3 Yang Z M(杨增明 ),WangWJ(王文静 ),Gong YL(龚云麒),et al.Dete rmination of flavonoids of peanut hull from different region.Chin J Ethnomed Ethnopha rm(中国民间医药杂志),2004,71:359-360.
4 Zhou P(周萍 ),Ru HL(汝海龙 ),Jiang HD(蒋惠娣 ).Studies on purification of total flavonoids from peanut hull with macroporous adsportion resin.J Dali Univ(大理学院学报),2007,6:10-12.
5 Wu FY(伍方勇),DaiDS(戴德舜),Wang Y M(王义明),et al.Application of high-speed counter-current chromatography electrospray ionization-mass spectrometry in analysis of traditional Chinese herbs.Chem J Chin Univ(高等学校化学学报),2002,23:1698-1700.
6 Gao YY(高荫榆),WeiQ(魏强),Fan QS(范青生),et al.Advances of high-speed countercurrent chromatography on separation of natural products.Food Sci(食品科学),2008,29:461-465.
7 Wang FM(王风美),Chen JH(陈军辉),Li L(李磊 ).Preparative separation of salvianoilic acid salvia miltiorrhiza by high-speed countercurrent chromatography.Nat Prod Res Dev(天然产物研究与开发),2006,18:100-104.
8 Tan LQ(谭龙泉),Zhang S M(张所明),Ou QY(欧庆瑜).Application of thin layer chromatography insolvent system selection for high-speed counter-current chromatography.J Chin Anal Chem(分析化学),1996,24:1448-1451.
9 Tan LQ(谭龙泉),Ruan ZQ(阮宗琴),Ou QY(欧庆瑜 ).Application of capillary electrophoresis in solvent system selection for high-speed counter-current chromatography.J Chin Anal Chem(分析化学),1997,25:515-518.
10 Liu Y(刘云),Chou GX(侴桂新).Isolation and preparation from the leaves of lindera aggregate using high-speed counter-current chromatography.Chin J ChroMatogr(色谱),2007,25:735-739.
11 Ito Y.Golden rules and pitfalls in selecting optim conditions for high-speed counter-current chromatography.J Chromatogr A,2005,1065:145-168.
12 Zhao DB(赵东保 ),ZhangW(张卫 ),LiMJ(李明静 ),et al.Studies on chemical constituens of Acroptilon repens.Chin J Chin Mat Med(中国中药杂志),2006,31:1869-1872.
13 Yin F(尹锋 ),ChengL(成亮 ),Lou FC(楼凤昌 ).Studites on the constituents of Citrus medica L.var.sarcodactylis(Noot.)Swingle.Chin J NatMed(中国天然药物),2004,2:149-151.
14 Zhou DN(周道年),Ruan JL(阮金兰),Cai YL(蔡亚玲).Flavonoids from aerial parts of Arachniodes exilis.Chin J Pha rm(中国药学杂志),2008,43:1218-1220.
Preparative Separation of Flavones from Peanut Hull by High-Speed Counter-Current Chromatography
N IU Dan-dan1,2,L IU Cai-xia1,2,L IU Xiu-hua2,L IMing-jing1,2*1College of Che mistry and Chemical Engineering,Henan University,Kaifeng 475004,China;2
Key Laboratory of NaturalMedicine and Immunology Engineering Henan Province,Kaifeng 475004,China
R284.2;Q946.91
A
1001-6880(2011)01-0110-05
2009-10-20 接受日期:2009-12-29
河南省教育厅自然科学研究项目 (200510475040)
*通讯作者 Tel:86-378-5918398;E-mail:lmjhellen6@163.com
