固定云芝漆酶纳米金颗粒修饰金盘电极的制备及其对氧还原反应的生物电催化性能
2011-10-09龚兰新侯凤兰
曾 涵,龚兰新,崔 婷,侯凤兰
新疆师范大学生命科学与化学学院化学系,乌鲁木齐 830054
固定云芝漆酶纳米金颗粒修饰金盘电极的制备及其对氧还原反应的生物电催化性能
曾 涵*,龚兰新,崔 婷,侯凤兰
新疆师范大学生命科学与化学学院化学系,乌鲁木齐 830054
利用 1,6-己二硫醇作为联结剂将纳米金颗粒修饰到金盘电极上,再以 L-半胱氨酸为修饰剂使纳米金颗粒功能化并进一步与漆酶充分作用,制备了固定漆酶的纳米金颗粒修饰金盘电极并以循环伏安法测试了其对氧还原的催化性能。实验结果表明:O2在该电极上还原电位约为-0.26 V(vs SCE),氧还原峰电流为 3.0 uA(25℃),较文献[7]报导的固酶聚异丙基丙烯酰胺 (PN IPAM)水凝胶修饰 ITO电极的氧还原催化性能要优。(氧气还原电位:-0.26 V,vsNHE,峰电流:0.47 uA)进一步研究表明:本文制备的修饰电极稳定性好,适于长期使用而且热稳定性优于文献[7]报道的固酶聚异丙基丙烯酰胺水凝胶修饰 ITO电极:50℃时在本文制备的纳米金修饰电极上氧还原峰电流仍保持为 25℃时修饰电极上氧还原峰电流的 40%左右。
漆酶直接电迁移 (DET)氧还原 (ORR)
Abstract:Gold disk electrode wasmodified with nanogold particle using 1,6-hexanedithiol(HET)as linker and nanogold particle modified with L-cystein to be functionalized was reacted with laccase enough to immobilize enzyme tightly.After doing so,gold disk electrode modified with nanogold particle which covalently coupled with laccase has been achieved.The catalytic function towardsoxygen reduction reaction(ORR)ofprepared electrodewas evaluatedwith cyclic voltammograms(CV).The resultsobtained from exper imentswhich indicated dioxygen reduction reaction on prepared electrode occurred at about-0.14 V(vs SCE),much better than that of literature[7]reported(-0.26 V vsNHE)ITO electrode modified with poly(N-isopropylacrylamide)(PN IPAM)hydrogel;peak current of ORR on prepared electrode was 3.0μA or so,about 6.5 times of that of literature[7]reported ITO electrode modified by PN IPAM with laccase.Further investigation showed gold disk electrode modified by nanogold particlewith immobilized laccase through covalent coupling had excellent stability for long-termuse and had better ther mal stability than literature[7]reported ITO electrode modified with PN IPAM hydrogel:prepared electrode can retain 40%of peak current corresponding to oxygen reduction at 25℃when system temperature was kept at 50℃.
Key words:laccase;direct electron transfer(DET);oxygen reduction reaction(ORR)
当前生物燃料电池的主要研究对象是以人体体液组分或代谢产物 (如乳酸或葡萄糖)为阳极燃料,以氧作为氧化剂的酶燃料电池[1]。由于酶活性中心与电极之间的直接电子传递十分困难,因此目前利用合成模拟酶或利用具有生物催化活性的电子传递介体制备修饰电极是当前生物燃料电池,生物传感器研究的热点[2,3]。为使传感器或燃料电池的输出功率增强,就必须将电子中介体固定于靠近酶氧化还原中心的最佳位置,但由于目前广泛使用的阴、阳极电子中介体如羰基二茂铁、ABTS等价格较为昂贵,回收工艺复杂且回收率不高,在实际应用方面存在较大限制。因此,无电子中介体实现酶活性中心与基底电极之间的直接电子传递便成为近十余年来修饰酶电极的研究前沿[4]。一般而言常规燃料电池氧阴极操作条件较为严格,而且氧还原的过电位很高使得电池输出功率很低,如何降低氧还原过电位一直是提高生物燃料电池的关键。目前文献报道的性能较好的酶催化剂主要是含铜的“蓝铜”酶如阿祖灵 (Azurin)、胆红素氧化酶 (BOD)及漆酶(Laccase)等。目前普遍采用的酶修饰电极制备方法包括物理吸附法、静电吸引法和共价偶联法等[5]。无论采用哪一种方法都要对基底电极进行一定的化学修饰,修饰物要有一定的电导率而且与酶要有一定的亲和力,这样才能缩短酶活性中心与基底电极间的距离减小传荷超电势。
郑华与胡劲波等[6]曾利用双硫醇分子作为联结剂将纳米金颗粒固定于金电极上,将制备的纳米金修饰电极用于 DNA测定及其对 DNA损伤的检测,证明可以通过共价偶联方式将蛋白质分子通过可导电的纳米金颗粒实现氧化还原蛋白质分子与基底电极之间的直接电子迁移 (DET)。Klis和Bilewicz等[7]则将漆酶固定在聚 N-异丙基丙烯酰胺(PN IPAM)水凝胶修饰的铟锡氧化物 (ITO)电极上,研究了固定漆酶的电化学行为和对氧还原反应(ORR)的催化性能。这种酶修饰电极存在响应信号弱,氧气还原超电位大 (O2的还原发生在相对标准氢参比电极 NHE为-0.26 V处)而且当体系温度超过 35℃时几乎完全丧失 O2还原催化能力等缺陷,在实际应用上仍然存在着较多的限制。本文研究以 1,6-己二硫醇为锚将纳米金颗粒固定在金盘电极上并进一步以共价偶联的形式将漆酶固定于修饰金盘电极的纳米金粒子上并研究此种酶修饰电极对氧还原反应的催化性能。此法通过化学修饰的纳米金颗粒与漆酶分子之间以化学键形式共价偶联,缩短了漆酶分子内活性位 T1与基底电极间距离,增强了固定漆酶氧还原催化性能的稳定性。但仍然存在着响应信号不够强,过电位偏高,热稳定性不够好等不足,应可通过纳米金颗粒-(导电)高聚物自组装层叠层体系来固定更多的漆酶,以达到增加响应电流信号,降低超电势的目的。
1 实验部分
1.1 试剂和仪器
CH I400A型电化学分析仪 (CH I Inc,USA);三电极体系:对电极为铂丝电极,参比电极为饱和甘汞电极 (SCE),工作电极为金盘电极 (直径 1 mm,购自天津艾达恒晟工贸有限公司)。工作电极使用前先后以 500#砂纸及 1.0μm氧化铝粉浆打磨,然后先后用丙酮和三次重蒸水超声清洗各两次。清洗过的金电极以高纯 N2吹干。ALV/DLS/SLS-5022F激光光散射光谱仪 (德国 ALV公司),配以 ALV-5000型数字时间相关器和 He-Ne激光光源 (波长 632 nm,输出功率 22 mW)。实验前,样品溶液均经过除尘处理,溶液浓度分别为 0.914×10-3mol/L,0.814×10-3mol/L,0.714×10-3mol/L。测量温度 22±0.3℃,θ=90°。云芝漆酶 (分子量 68000 Da,已纯化,现买现用),购自 Sigma化学试剂有限公司 (美国),保存在-18℃冰箱中;N-乙基-N′-(3-二甲基氨丙基)碳二亚胺 (EDC)、1,6-己二硫醇 (HET)、N-羟基丁二酰亚胺 (NHS)、L-半胱氨酸 (L-cys)均购自阿拉丁试剂公司,分析纯;四氯金酸 (HAuCl4·4H2O)购自国药集团化学试剂有限公司,分析纯;其余所有试剂均为分析纯,使用前无需纯化。实验过程中使用的缓冲液为 0.2 mol/L的磷酸盐缓冲液 (pH4.41),配制溶液的水均为三次重蒸水。
1.2 纳米金溶胶的制备
金溶胶的制备参考 Frens[6]法:将 100 mL1.0×10-3mol/L的四氯金酸溶液加热至沸腾,分别向沸液中一次性地加入 9.34 mL、18.7 mL、40 mL 1%柠檬酸三钠溶液,保持沸腾 20 min,自然冷却,收集三种溶胶液,分别记为 sample 1、sample 2、sample 3。得到的三种纳米金溶胶液以激光光散射光谱仪测定其平均粒径分别为 23.8 nm (sample 1)、36.7 nm(sample 2)和 57.4 nm(sample 3)。
1.3 固酶纳米金修饰电极的制备
预处理过的金盘电极,在 14.3 g/L HET溶液中浸泡 6 h后再把修饰有 HET的金电极浸在纳米金溶胶里,静置 4 h。这样就制备了修饰纳米金颗粒的金盘电极。再将此电极浸泡在 0.5 mol/L L-半胱氨酸溶液中,静置 10 h。这样 L-半胱氨酸以 Au-S键形式吸附在修饰金盘电极的纳米金颗粒上,接着将修饰有 L-半胱氨酸的纳米金/金盘电极浸泡在 10 mL 75 mmol/L EDC和 15 mmol/L NHS混合溶液中再静置 12 h,待反应完全后,以三次重蒸水清洗电极三次。将清洗过的金电极放入 25 mL 1.1 g/L云芝漆酶溶液 (漆酶溶解在 pH4.41磷酸盐缓冲液中制得)中,于 4℃下保存 24 h,待修饰金电极与漆酶液充分作用后以缓冲液清洗电极 3次以冲去电极上结合不牢固的漆酶。最后吸取 3μL质量浓度为 1%的Nafion溶液均匀涂在电极表面上,风干后备用。制备好的修饰电极不用时于 4℃下保存在冰箱中(泡在 pH 4.41缓冲液中)。具体的电极修饰过程见图 1。
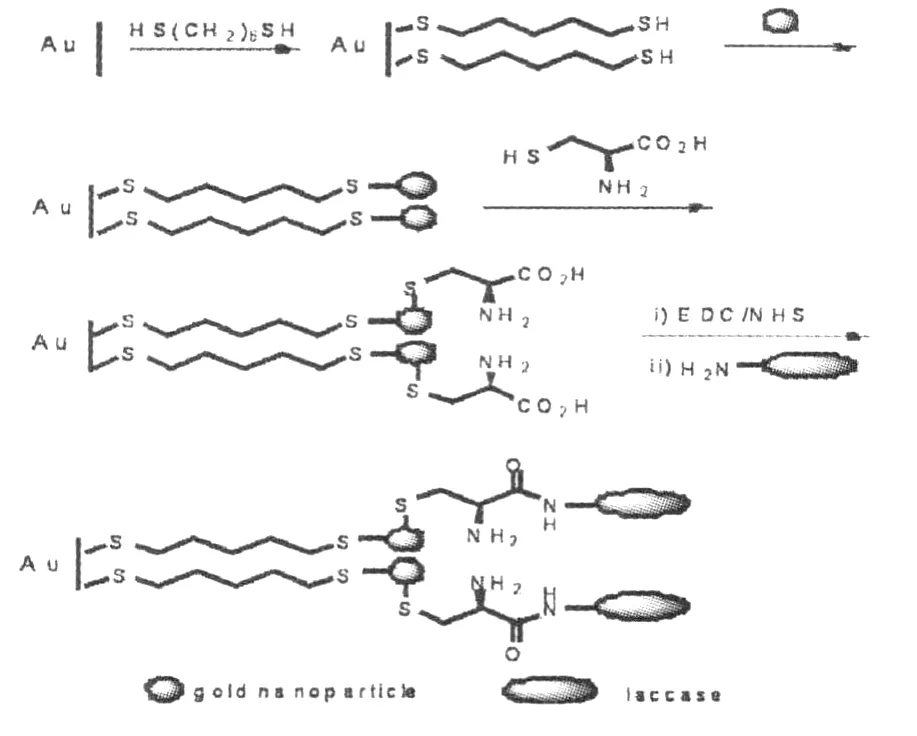
图1 金盘电极的修饰过程示意图Fig.1 Process of gold disk electrode modification
1.4 固酶纳米金粒子修饰金盘电极的电化学行为及氧还原催化性能
为了研究固酶纳米金粒子修饰金盘电极的电化学行为,先将高纯 N2通入电解液 (pH4.41磷酸盐缓冲液)中除氧 30 min后再将三电极组装好进行循环伏安 (CV)测试。扫描电位范围:-0.4~0.55 V,静置时间 2 s,扫描圈数:1圈,灵敏度:10△Ep uA,扫描速率:10 mV/s。
为了研究固酶纳米金粒子修饰金盘电极对氧还原反应 (ORR)的催化性能,先将工业纯 O2通入pH4.41缓冲液中鼓泡 30 min使溶液溶氧达饱和,再组装好三电极电解池,进行循环伏安测试。扫描电位范围:-0.4~0.55 V,静置时间 2 s,扫描圈数:1圈,灵敏度:10μA,扫描速率:10 mV/s。如无特殊说明,文中所提电位均为相对于饱和甘汞电极的电位。
2 结果与讨论
2.1 纳米金在基底电极表面的吸附
图2是纳米金修饰电极在 1 mmol/L K3Fe(CN)6和 0.1 mol/L KCl支持电解质溶液中的循环伏安图。从图 2中可以看出:基底金电极表面吸附了 HET后,阻碍了 K3Fe(CN)6在电极表面的氧化还原,氧化还原峰高明显降低,峰形变宽;当有纳米金颗粒吸附在电极表面后,由于纳米金颗粒具有大的比表面、尺寸量子效应和较高的化学反应活性[6]使纳米金修饰金盘电极的 K3Fe(CN)6还原峰显著增高而且使峰的对称性得到一定的改善。

图2 金基底电极﹑ HET修饰电极和纳米金修饰电极在 1 mmol/L鉄氰化钾和 0.1 mol/L KCl支持电解质溶液中 CVFig.2 Cyclic voltammograms of NGS/HET/GD(1),HET/GD(2)and bare GD(3)in 1 mmol/L K3Fe(CN)6and 0.1 mol/L KCl solution.
2.2 漆酶在纳米金修饰金盘电极上的电化学行为
图3 是无氧气存在时固定漆酶的 L-半胱氨酸偶联纳米金颗粒修饰金盘电极的循环伏安曲线,与之作为对照的是直接将漆酶固定在金盘电极上的循环伏安曲线(漆酶直接固定在金盘电极上的方法参见文献[8]。从图 3中可以看出:直接固定漆酶的金盘电极在给定的扫描电位范围和灵敏度范围内未出现任何可分辨的氧化还原峰,这是因为漆酶的电子受体活性性 T1与基底电极没有充分接触,仅靠酶分子在空间随机排列使活性中心 T1与金盘电极表面近距离接触实现电子传递,故响应电流信号十分微弱;而固定了漆酶的 L-半胱氨酸偶联纳米金修饰金盘电极却产生了一对明显的准可逆氧化还原峰:当扫描速率为 100 mV/s时,化学式电位 E°=(EPa+EPc)/2和△Ep分别为 236 mV和 98 mV,此电位与文献[7]中所提的漆酶活性中心 T1位的化学式电位相一致。这两种电极直接电子传递上的差异是由于电极表面修饰物-纳米金粒子存在引起的。由于纳米金粒子本身导电又以酰胺键与漆酶分子表面相连接,纳米金粒子实际上起到了电子中介体作用,缩短了酶活性位与基底电极间距。

图3 修饰漆酶金电极(1)和固定漆酶纳米金修饰金盘电极 (2)在 pH4.41磷酸盐缓冲液 (无氧)中的循环伏安曲线 (扫描速率:100 mV/sFig.3 Cyclic voltammograms of two different electrodes in 0.2 mol/L phosphate buffer solution(pH4.41,deaerated)scan rate:100 mV/s 1.laccase modifed gold disk electrode 2.laccase entrapped Cys-NGS-HET/gold disk electrode
图4 是体系中无氧气存在时固定漆酶的 L-半胱氨酸偶联纳米金颗粒修饰金盘电极在 pH4.41缓冲液中以不同扫描速率进行测试时所得的 CV曲线以及阴阳极峰电流与扫描速率的关系曲线。从图 4中可以看出在此固定了漆酶的纳米金修饰金盘电极上,无论阴极还是阳极的峰电流均与扫描速率德一次方均成良好的线性关系,这证明在此修饰电极上漆酶分子与电极间的电子传递为一表面控制过程[8]。

图4 固酶纳米金修饰电极 (sample1)在无氧 pH4.41磷酸盐缓冲液中的循环伏安图(25℃)插图:阴阳极峰电流与扫速关系曲线Fig.4 Cyclic voltammograms of laccase-entrapped on L-cys-NGS(sample 1)-HET/gold disk electrode in 0.2 mol/L deaerated phosphate buffer solution(pH4.41)(25℃)Scan rate:1-10 mV/s,2-40 mV/s,3-80 mV/s,4-100 mV/sInset:Related curves of peak current of cathode and anodewith scan rate(RC=0.996,R -0.990)
2.3 不同固定漆酶策略对固定漆酶热稳定性和重复使用性的影响
图5 是固定漆酶的纳米金修饰电极在通氮除氧,空气饱和和氧气饱和的情况下分别按 1.4所述条件进行测试得到得 CV曲线。从图 5中可以看出:在空气饱和的缓冲液中,固定了漆酶的被 L-半胱氨酸偶联纳米金颗粒修饰金盘电极的阴极峰出现在-0.26 V(相对于饱和甘汞电极),这个峰对应于氧气的还原反应[9],这个电位值远高于 O2在裸金电极上的还原电位 (-0.7 V,vs Ag/AgCl参比电极)和O2在纳米金/玻碳电极上的还原电位 (-0.55 V,vs Ag/AgCl参比电极),也比文献[7]报道的 O2在固定漆酶聚合物水凝胶修饰 ITO电极上的还原电位 (大约为-0.26 V,相对于标准氢电极)高得多;本文得到的此种固定漆酶纳米金修饰金盘电极的响应电流也远高于文献[7]报道的固酶聚合物水凝胶修饰电极;在同为氧气饱和的缓冲液中,文献[7]报道的修饰电极的 O2还原阴极峰电流仅有 0.47μA,而本文制得的修饰电极的 O2还原阴极峰电流可达 3.0μA左右,为前者的 6.5倍左右。进一步研究表明:固酶的纳米金粒颗粒越小,纳米金颗粒由于具有大的比表面积和较小的空间位阻便于和酶分子充分地相互作用,同时亦有利于电子从金电极向漆酶电子受体 T1活性位的直接传递。这一结果与文献[8]所得的结论相一致。当纳米金颗粒粒径分别为23.8 nm(sample 1)、 36.7 nm(sample 2)和 57.4 nm(sample 3)时 ,O2还原阴极峰 (氧气饱和的缓冲液中)分别出现在-0.26 V,-0.31 V,-0.34 V;而阴极峰电流分别为 3.0 μA,2.42μA,1.72μA。

图5 固酶纳米金 (sample1)修饰金盘电极在除氧 (1),空气饱和 (2)及氧气饱和 (3)的 pH4.41磷酸盐缓冲液中的循环伏安图 (25℃)扫描速率:10 mV/sFig.5 Cyclic voltammograms of laccase-entrapped L-cystein-NGS-HET/gold(sample 1)disk electrode(GD)in(1)deaerated,(2)air-saturated and(3)oxygen-saturated phosphate buffer solutions(pH4.41)(25℃)Scan rate:10 mV/s
2.4 固定漆酶纳米金修饰金盘电极长期使用的稳定性和热稳定性
为了考察固定漆酶纳米金修饰金盘电极的长期使用性能,将新制备的修饰电极浸泡在 pH4.41缓冲液中,于 4℃下保存 21 d。将此电极放入饱和 O2的 pH4.41缓冲液中按 1.4所述实验条件进行循环伏安测试,发现与新制备电极在饱和了O2的同样溶液中同样实验条件下得到的 CV曲线没有明显的差别。
为了评价固定漆酶纳米金修饰金盘电极的热稳定性,将新制备的固酶纳米金修饰金盘电极分别浸泡在饱和了 O2的 pH4.41缓冲液中,静置 10 min后再分别按 1.4所述实验条件进行 CV测试,所得结果见图 6。从图 6中可以看出当缓冲液温度保持在50℃时,O2还原的阴极峰电位负移到了-0.32 V,峰电流也降到了 25℃时氧还原峰电流的大约 40%,但这个值仍然远高于文献[7]报道的聚合物水凝胶固定漆酶修饰 ITO电极 35℃时 (即相转变温度后聚合物水凝胶塌缩状态)的阴极峰电流,而且比文献[7]报道的聚合物水凝胶固定漆酶修饰 ITO电极在电子介体存在条件下 30℃时 (即相转变温度前聚合物水凝胶呈无规线团状态)的阴极峰电流 (大约-1.5μA)仅低 0.3μA。这可以归因于纳米金溶胶经 L-半胱氨酸修饰后与漆酶分子表面氨基共价耦合而使漆酶分子较为牢固地固定在纳米金粒子,在一定程度上减弱了酶分子活性位因分子热运动而使周围环境发生扭曲导致的失活。

图6 固定漆酶纳米金 (sample 1)修饰金盘电极对氧还原反应催化性能的热稳定性实验 (1.25℃,2.50℃)Fig.6 Thermal stability of laccase-entrapped L-cystein-NGS-HET/gold(sample 1)disk electrode’s catalytic function on oxygen reduction reaction. (1.25℃,2.50℃)
1 Bao Y(宝玥 ),Wu XQ(吴霞琴 ).Progress in research for biofuel cell(生物燃料电池的研究进展).Electrochem istry(电化学),2004,10:1-8
2 Blanford CF,Foster CE,Heath RS,et al.Efficient electrocatalytic oxygen reduction by the‘blue’copper oxidase,laccase,directly attached to chemicallymodified carbons.Faraday D iscuss,2008,140:319-335
3 Blanford CF,Heath RS,Armstrong FA.A stable electrode for high-potential,electrocatalytic oxygen reduction based on rational attachment of a blue copper oxidase to a graphite surface.Chem Comm un,2007:1710-1712
4 Park DH,Zeikus JG. Impact of electrode composition on electricity generation in a single compartment fuel cell using Shewanellaputrefaciens.Appl.MicrobiolB iotechnol,2002,59:58-61
5 Qiu HJ,Xu CX,Huang XR,et al. Immobilization of laccase on nanoporous gold:Comparative studies on the immobilization strategies and the particle size effects.J Phys Chem C,2009,113:2521-2525
6 H.Zheng JB.Hu QL.Preparation of daunomycin modified nano-gold electrode and its application to detection of DNA.Acta Ch im Sin,2006,64:806-810
7 Maciej Klis,Marcin Karbarz,Zbigniew Stojek,et al.Thermoresponsive poly(N-isopropylacrylamide)gel immobilization of laccase on indium tin oxide electrodes.J Phys Chem B,2009,113:6062-6067
8 Qiu HJ,Xu CX,Huang XR,et al.Adsorption of laccase on the surface on nanoporous gold and the direct electron transfer between them.J Phys Chem C,2008,112:14781-14785
9 Stolarczyk K,Nazaruk E,Rogalski J,et al.Nanostructured carbon electrodes for laccase-catalyzed oxygen reduction without added mediators.Electrochim Acta,2008,53:3983-3990
Preparation of Gold Disk Electrode Modified by Nanogold Particle with Laccase through Covalent Coupling and Its Bioelec trocatalytic function towards Oxygen Reduction Reaction
ZENG Han*,GONGLan-xin,CU I Ting,HOU Feng-lan
Acade my of Life Science and che mistry,Xing Jiang Nor mal University,U ru muqi,830054
O629.8
A
1001-6880(2011)01-0105-05
2009-09-14 接受日期:2009-12-15
*通讯作者 E-mail:zenghan1289@163.com
