一氧化氮在有氧运动大鼠股四头肌过氧化应激及JNK表达中的作用
2011-09-30秦春霞钱海车力龙秦从军陈谦肖德生
秦春霞,钱海,车力龙,秦从军,陈谦,肖德生
(1.江苏大学基础医学与医学技术学院,江苏镇江212013;2.广州医学院公共卫生与全科医学学院,广东广州510182)
一氧化氮在有氧运动大鼠股四头肌过氧化应激及JNK表达中的作用
秦春霞1,钱海1,车力龙1,秦从军1,陈谦1,肖德生2
(1.江苏大学基础医学与医学技术学院,江苏镇江212013;2.广州医学院公共卫生与全科医学学院,广东广州510182)
目的:探讨有氧运动后一氧化氮(NO)对股四头肌的过氧化应激及MAPK通路的调控作用。方法:大鼠分为静息组(SED)、运动组(EXE)、静息+NOS抑制组(SED-LNAME)、运动+NOS抑制组(EXE-LNAME)。运动组及运动+NOS抑制组每周连续游泳5d。共持续3个月。观察大鼠股四头肌MDA、SOD、TAOC及JNK水平的变化。结果:与SED组比较,EXE组大鼠股四头肌SOD、TAOC、p-JNK蛋白显著升高,在应用L-NAME干预后,运动+NOS抑制组MDA升高,SOD、TAOC、p-JNK显著下降,t-JNK无显著性变化。结论:运动训练诱导产生的NO可能介导JNK信号激酶诱导抗氧化酶产生,从而提高骨骼肌的抗氧化能力。
运动;抗氧化;NO;JNK
有氧运动时肌组织血流量和氧消耗增多,自由基生成增多,引起过氧化应激反应,同时骨骼肌抗氧化机制增强,从而对肌肉发挥保护作用。NO以多种形式保护细胞免受过氧化损伤,包括与多种脂质过氧化产物以近扩散速率进行反应,阻止脂质过氧化链,甚至抑制细胞凋亡[1]。运动期间NO还能激活NF-κB DNA结合物,促进Mn-SOD,iNOS和eNOS的表达[2]。运动可通过激活大鼠骨骼肌细胞MAPK通路(ERK1/2、JNK、P38),参与过氧化应激机制[3,4],其中运动后股四头肌NO水平升高,是否通过JNK通路调控对氧化应激发挥调节作用?本研究对此加以探讨。
1 研究方法
1.1 实验动物与分组
雌性SD大鼠40只,由江苏大学实验动物中心提供,饲养于带不锈钢底的标准大鼠笼内,室温(23±1)℃,相对湿度(50±5)%,12h/12h光-暗节律。40只大鼠随机分为静息组(SED)、运动组(EXE)、静息+NOS抑制组(SEDLNAME)、运动+NOS抑制组(EXE-LNAME),每组10只。静息+NOS抑制组和运动+NOS抑制组均以灌胃的方式给予一氧化氮合酶拮抗剂(L-NG-nitro-arginine methyl ester,LNAME,1mg/ml)的蒸馏水。大鼠饲料为AIN-93标准饲料,由南通特洛菲饲料科技有限公司提供。
1.2 运动方法
运动组和运动+NOS抑制组大鼠在80cm×50cm×80cm的玻璃水缸中游泳,水深50cm,水温(34±1)℃。每周连续游泳5d,休息1d,1次/d。每次游泳持续时间为第1周30min,第2周1h,第3周开始固定为2h,共持续3个月。静息组和静息+NOS抑制组除运动以外,其余处理与相应的运动组相同。
1.3 动物处理
大鼠在禁食12~24h后,用乙醚麻醉断头放血。迅速取其股四头肌,液氮速冻,存放于-70℃待测。
1.4 分析方法
采用BCA法测蛋白含量,硫代巴比妥酸TBA比色法测定MDA含量,黄嘌呤氧化酶法测定超氧化岐化酶SOD活力,比色法测定总抗氧化能力T-AOC,硝酸还原酶法测定NO,试剂盒均购自南京建成生物工程研究所,蛋白免疫印迹法测定JNK水平,实验操作严格按说明书进行。
1.5 统计方法
实验数据用均数±标准差表示,统计学处理采用SPSS 16.0统计软件进行双因素方差分析和组间比较。
2 结果
2.1 NO含量的变化
如图1所示,与静息组相比,运动组NO含量显著升高(P<0.01),表明运动可升高股四头肌内NO含量;静息+NOS抑制组NO含量无显著性差异。表明了内源性NOS的活性受到抑制。运动+NOS抑制组NO含量低于运动组(P<0.05),表明一氧化氮酶抑制剂在运动期间抑制了运动诱导的股四头肌NOS活性的升高。

图1 游泳运动及L-NAME对大鼠股四头肌NO含量的影响注:a表示P<0.01vs SED;b表示P<0.05vs EXE,下同。
2.2 MDA水平的变化
如图2所示,与静息组相比,运动组MDA水平有降低趋势但无显著性差异(P>0.05)。运动组+NOS抑制组MDA水平高于运动组(P<0.05),表明运动期间一氧化氮合酶抑制剂干预后,股四头肌脂质过氧化水平升高。
2.3 SOD水平的变化
如图3所示,与静息组比较,运动组SOD含量升高(P<0.05),表明运动可升高股四头肌SOD含量;静息+NOS抑制组无显著性差异。运动+NOS抑制组SOD水平低于运动组(P<0.05),表明在运动期间一氧化氮合酶抑制剂干预后,股四头肌SOD含量降低。
2.4 TAOC水平的变化
如图4所示,与静息组比较,运动组TAOC水平显著升高(P<0.01),表明运动后股四头肌TAOC含量升高;静息+NOS抑制组差异无显著性意义;运动+NOS抑制组低于运动组(P<0.05),表明在运动期间一氧化氮合酶抑制剂干预后,股四头肌TAOC水平下降。

图2 游泳运动及L-NAME对大鼠股四头肌MDA含量的影响

图3 游泳运动及L-NAME对大鼠股四头肌SOD含量的影响
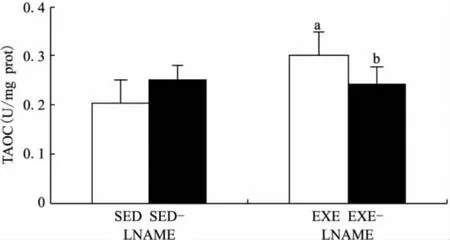
图4 游泳运动及L-NAME对大鼠股四头肌TAOC水平的影响
2.5 p-JNK表达的变化
如图5所示,与静息组比较,运动组JNK水平显著升高(P<0.01),表明运动可升高股四头肌JNK蛋白表达水平;应用L-NAME干预后,静息+NOS抑制组差异无显著意义,运动+NOS抑制组显著降低(P<0.01),表明在运动期间给予一氧化氮合酶抑制剂干预后,股四头肌P-JNK蛋白表达水平降低。
2.6 t-JNK表达的变化
如图6所示,与静息组比较,运动组t-JNK蛋白表达水平无显著差异。应用L-NAME干预后,静息+NOS抑制组和运动+NOS抑制组没有显著性变化,表明运动训练及LNAME对大鼠股四头肌t-JNK蛋白表达水平无影响。

图5 游泳运动及L-NAME对大鼠股四头肌p-JNK水平的影响

图6 游泳运动及L-NAME对大鼠股四头肌t-JNK水平的影响注:1:SED;2:EXE;3:SED-LNAME;4:EXE-LNAME
3 讨论
早期研究已证明游泳三个月后大鼠腓肠肌GSH含量显著降低,MDA无显著变化[5]。大量研究发现,有氧运动提高机体清除自由基的能力和降低骨骼肌自由基[6]。有氧运动增加血清和腓肠肌TAOC,减小脂质过氧化水平[7,8]。本研究结果说明,运动训练后大鼠股四头肌SOD、TAOC升高,MDA没有显著性改变,表明自由基的产生与清除处于动态平衡,抗氧化酶活性增强,机体的抗氧化能力提高,骨骼肌对运动产生了适应性。股四头肌与报道中的腓肠肌的抗氧化差别可能包括运动对象、运动时间、运动强度、机制的不同。
NO与体内的氧、超氧阴离子、血红蛋白等发生氧化反应形成稳定的硝酸盐或亚硝酸盐,以多种方式保护细胞免受过氧化损伤。NO与多种脂质过氧化产物以近扩散速率进行反应,阻止脂质过氧化链,甚至抑制细胞凋亡[1]。同时NO还促进线粒体的增多和增大[9],长期有氧运动训练使线粒体产生适应性变化,线粒体数目增多、酶合成增加、活性提高。研究表明,运动中产生的RON能激活NF-κB DNA结合物,促使腓肠肌中Mn-SOD,iNOS和eNOS的表达[2]。本研究观察到,运动后股四头肌氧化指标无显著性变化,抗氧化能力提高,同时p-JNK表达升高,但是在NOS表达受抑制时,使NO产生减少,氧化损伤增加,抗氧化能力减弱,p-JNK表达降低。说明运动后诱导产生的NO水平影响了抗氧化酶的活性,同时NO可能介导了JNK的磷酸化过程。因此,可以认为运动产生的NO分子可能通过增加JNK磷酸化表达,上调抗氧化酶基因表达和调节参与运动训练的蛋白表达,从而使机体对运动训练产生生理适应性。
运动激活JNK活性,并促进c-Jun的表达与磷酸化[10]。运动形式、运动对象、运动强度不同,JNK活性程度也不同。江钟立等研究显示急性等张运动可以使股四头肌的JNK活性升高4.1倍,而三周运动训练使JNK活性更高。提示运动对肌肉蛋白代谢的调节机制与JNK激活的活性有关[11]。人及大鼠的股外侧肌急性运动后,JNK活性显著升高并且上调了c-Jun mRNA的表达,且认为运动诱导的JNK信号激活是肌肉收缩的内在反应,急性运动训练表现为骨骼肌蛋白降解的一过性增多,而运动训练反应表现为蛋白合成的增加和基因表达的改变[10]。
运动产生的多种抗氧化蛋白与JNK通路相关。运动训练提高了HO-1水平,同时HO-1还可以调节细胞内铁贮存和增加铁排出,进而阻止游离铁通过Harber-weiss反应产生羟自由基而造成组织损伤[12]。JNK参与了HO-1的信号通路,保护内皮细胞免受损伤[13]。研究表明HSP72在骨骼肌表达是骨骼肌自身的内源性保护机制[14],HSP72可诱导SOD活性增加,对保护细胞免受自由基损伤起重要的作用[15,16,17]。运动能够诱导骨骼肌表达IL-6[18,19],在肌肉收缩时IL-6通过上游NF-κB和JNK被激活[20,21]。最新研究发现,运动肌肉中产生的NO增加了IL-6,IL-8,HO-1,HSP72蛋白的表达,并且在应用L-NAME干预后都发生了逆转[22]。说明NO参与调控了骨骼肌中抗氧化相关蛋白的表达。JNK信号通路诱导抗氧化酶的研究未见报道,本研究证明,NO可以对抗运动对骨骼肌脂质过氧化损伤,JNK信号通路可能参与抗氧化酶的产生,但是JNK与NO介导的信号通路之间的关系需要进一步研究。
综上所述,运动骨骼肌中NO生成增多,而NO直接或者间接的与细胞因子作用对抗机体脂质过氧化损伤,并且可能调控骨骼肌JNK信号通路,诱导骨骼肌抗氧化蛋白及酶的表达。使其适应运动所产生的各种生理变化,而对于NO对骨骼肌运动适应性精确的信号调节机制仍需要进一步研究。
[1]Beligni MV,Fath A,Bethke PC,et al.Nitric oxide acts as an antioxidant and delays programmed cell death in barley aleurone layers[J].Plant Physiol,2002,129(4):1642-1650.
[2]Gomez-Cabrera MC,Borrás C,Pallardó FV,et al.Decreasing xanthine oxidase-mediated oxidative stress prevents useful cellular adaptations to exercise in rats[J].J Physiol,2005,567:113-120.
[3]Guan Z,Buckman SY,Springer LD,et al.Both p38alpha(MAPK)and JNK/SAPK pathways are important for induction of nitric-oxide synthase by interleukin-1beta in rat glomerular mesangial cells[J].J Biol Chem,1999,274(51):36200-36206.
[4]Martindale JL,Holbrook NJ.Cellular response to oxidative stress:signaling for suicide and survival[J].J Cell Physiol,2002,192(1):1-15.
[5]车力龙,冯书改,钱海,等.长期耐力运动对大鼠心肌和骨骼肌中NO,GSH及MDA水平的影响[J].江苏大学学报(医学版),2008,18(6):507-510.
[6]Brooks SV,Vasilaki A,Larkin LM,et al.Repeated bouts of aerobic exercise lead to reductions in skeletal muscle free radical generation and nuclear factor kappaB activation[J].J Physiol,2008,586(16):3979-3990.
[7]González D,Marquina R,Rondón N,et al.Effects of aerobic exercise on uric acid,total antioxidant activity,oxidative stress,and nitric oxide in human saliva[J].Res Sports Med,2008,16(2):128-137.
[8]闻剑飞,刘玉倩,王海涛,等.不同强度运动对大鼠自由基代谢影响的研究[J].中华医学康复杂志,2009,24(12):1080-1103.
[9]Nisoli E,Carruba MO.Nitric oxide and mitochondrial biogenesis[J].J Cell Sci,2006,119:2855-62.
[10]Aronson D,Boppart MD,Dufresne SD,et al.Exercise stimulates c-Jun NH2 kinase activity and c-Jun transcriptional activity in human skeletal muscle[J].Biochem Biophys Res Commun,1998,251(1):106-110.
[11]江钟立,苏家伟,苏恩本,等.运动对大鼠肌细胞丝裂素活化蛋白酶信号传导系统的调节作用[J].中华物理医学与康复杂志,2002,24(6):353-355.
[12]Agarwal A,Nick HS.Renal response to tissue injury:lessons from heme oxygenase-1 GeneAblation and expression[J].J Am Soc Nephrol,2000,11(5):965-973.
[13]Choi BM,Kim YM,Jeong YR,et al.Induction of heme oxygenase-1 is involved in anti-proliferative effects of paclitaxel on rat vascular smooth muscle cells[J].Biochem Biophys Res Commun,2004,321(1):132-137.
[14]Liu Y,Steinacker JM.Changes in skeletal muscle heat shock proteins pathological significance[J].Front Biosci,2001(6):12-25.
[15]Karmazyn M,Mailer K,Currie RW.Acquisition and decay of heatshock-enhanced postischemic ventricular recovery[J].Am J Physiol,1990,259(2):H424-H431.
[16]Lille S,Su CY,Schoeller T,et al.Induction of heat-shock protein 72 in rat skeletal muscle does not increase tolerance to ischemia-reperfusion injury[J].Muscle Nerve,1999,22(3):390-393.
[17]谭红梅.热休克反应缺血-再通心肌保护作用的机制探讨[J].中国病理生理学杂志,1999,15(10):868-870.
[18]Pedersen BK,Steensberg A,Schjerling P.Muscle-derived interleukin-6:possible biological effects[J].J Physiol,2001,536:329-337.
[19]Febbraio MA,Pedersen BK.Muscle-derived interleukin-6:mechanisms for activation and possible biological roles[J].FASEB J,2002,16(11):1335-1347.
[20]Kosmidou I,Vassilakopoulos T,Xagorari A,et al.Production of interleukin-6 by skeletal myotubes:role of reactive oxygen species[J].Am J Respir Cell Mol Biol,2002,26(5):587-593.
[21]Frost RA,Nystrom GJ,Lang CH.Lipopolysaccharide regulates proinflammatory cytokine expression in mouse myoblasts and skeletal muscle[J].Am J Physiol,2002,283(3):698-709.
[22]Steensberg A,Keller C,Hillig T,et al.Nitric Oxide production is a proximal signaling event controlling exercise-induced mRNA expression in human skeletal muscle[J].FASEB J,2007,21(11):2683-2694.
责任编辑:乔艳春
Role of Nitric Oxide in Oxidative Stress and JNK Expression of Quadriceps Femoris of Rats in Aerobic Exercise
QIN Chunxia1,QIAN Hai1,CHE Lilong1,QIN Congjun1,CHEN Qian1,XIAO Desheng2
(1.School of Medical Science and Laboratory Medicine,Jiangsu University,Zhenjiang 212013,Jiangsu,China;2.School of Public Health and General Practice,Guangzhou Medical University,Guangzhou 510182,Guangdong,China)
Objective:To investigate the role of NO(nitric oxide)in oxidative stress and the MAPK pathways of quadriceps femoris in long-term aerobic exercise.Methods:Rats were divided into a sedentary group(SED),an exercise group(EXE),a sedentary plus L-NAME group(SED-LNAME)and an exercise plus L-NAME group(EXE-LNAME).The rats in the EXE group and EXE plus LANME group swam for 5 days in a week,lasting for 3 months,and then the levels of MDA(malonaldehyde),SOD(Superoxide Dismutase),TAOC(total antioxidant capacity)and JNK(c-Jun N-terminal kinase)in the quadriceps femoris were analyzed.Results:Compared with the sedentary group,the contents of SOD,TAOC and p-JNK(phosphorylation-JNK)of the exercise group were significantly increased in quadriceps femoris.Treatment with L-NAME led to an increase in the MDA content,a significant decrease in the SOD,TAOC and p-JNK levels,without significant changes of the level of t-JNK in the EXE-LNAME group.Conclusion:During long-term aerobic exercise,NO may improve antioxidant capacity in skeletal muscle by increasing antioxidant enzymes activities,possibly through activating the JNK pathway.
exercise;antioxidant;NO;JNK
G804.23
A
1004-0560(2011)01-0058-04
2010-12-20;
2011-01-05
国家自然科学基金项目(30570894,30270639)。
秦春霞(1986-),女,硕士研究生,主要研究方向为营养学及运动生理学调控机制。
肖德生(1961-),男,教授,博士生导师,主要研究方向为营养学。
