我国地方药品不良反应专业监测机构建设现状调研分析
2011-09-28王文沛
王文沛,邵 蓉
(中国药科大学国际医药商学院,江苏 南京 211198)
我国地方药品不良反应专业监测机构建设现状调研分析
王文沛,邵 蓉
(中国药科大学国际医药商学院,江苏 南京 211198)
目的 了解我国药品不良反应(ADR)专业监测机构建设不足对开展ADR监测工作的消极影响,探讨机构建设不足的深层原因。方法 基于文献研究、问卷调研,全面了解我国地方ADR专业监测机构的建设现状。结果 目前我国省级ADR监测机构未实现完全独立,呈现出职责定位不清晰、人员不足、软硬件配置不完备等问题,市、县级机构建设则流于形式,制约了ADR监测工作的有效开展。结论 只有通过制度设计,引导相关部门重视ADR监测工作,才能从根本上推进ADR专业监测机构的完善。
药品不良反应;监测机构;现状
药品不良反应(ADR)监测是药品安全监管领域的重要工作内容之一,ADR专业监测机构则是药品监管主体落实这一工作的重要组织保障。2010年《国务院办公厅关于印发医药卫生体制改革五项重点改革2010年度主要工作安排的通知》提出了完善地市级ADR报告评价体系的工作要求,世界卫生组织(WHO)发布的《药物警戒中心建立与运行工作指南》也明确强调,健全的地方药物警戒中心对大国和有着不同文化传统的国家来说尤为重要[1]。我国幅员辽阔,人口超过3 000万的省、自治区、直辖市达19个,人口超过百万的城市有100个以上,因此完善我国地方ADR专业监测机构,是深入开展ADR监测工作的现实需要。
1 研究方法和范围
以“药品不良反应监测机构”为关键词,检索年限为2006年至2010年,检索中国期刊全文数据库,检索出相关文献10余篇,基本了解近年来各省ADR专业监测机构的建设进程。根据国家食品药品监督管理局安监司《关于加强ADR监测工作的指导意见》的工作安排,对全国31个省、自治区、直辖市各级ADR监测机构的机构设置、职责、人员、软硬件建设和相关工作情况进行了问卷调研。截至2010年9月31日,收回问卷530份。结合电话访谈,对收回的部分问卷数据作进一步确认。
2 调研情况汇总分析
2.1 省级ADR监测中心尚未实现完全独立
截至问卷收回日期,我国独立设置的省级ADR监测中心已达23个,较2007年多了6个[2],包括独立设置并参公管理模式、独立设置的普通事业单位模式和与其他部门合署办公的独立法人事业单位模式,我们称前两种模式为“小中心”,第3种模式为“大中心”,它们均具有独立的ADR编制、人事权和财务权,开展工作的自主性较强;非独立设置的ADR监测中心有8个,分为挂靠药品检验所、挂靠药品认证审批中心、挂靠药物情报研究所3种形式,挂靠的ADR监测中心除没有独立的人事权和财务权外,还缺乏独立的编制,如海南、内蒙古和新疆。具体见表1。

表1 我国省级ADR监测机构设置情况
调查显示,近80%的地方中心认为,独立设置ADR监测机构更有利于ADR监测工作的开展。调研中也发现,独立的省中心收集的百万人口ADR报告数、新的严重的ADR报告比例、主动开展药品安全性重点监测等体现工作开展情况的指标更优。部分挂靠的省中心业务和经费的归口部门不统一,监测工作在挂靠单位难以受到重视,监测工作人员易被边缘化,在很大程度上影响了监测队伍的稳定性。需要肯定的是,近年来我国省级ADR监测中心已由挂靠设置模式逐步向独立设置模式过渡,但仍没有实现完全独立。
2.2 省级ADR监测人力资源状况
2.2.1 工作人员数量偏少
目前没有编制的省级ADR监测中心有3个,其中内蒙古有6名兼职人员,海南有4名专职人员和2名兼职人员,新疆有7名专职人员。其余的28个省中心从事ADR监测工作的人员数量从3~40名不等,正式编制从3~22名不等,其中23个省中心的工作人员在10名以内。若按照世界卫生组织的建议,可以按每份报告平均处理1 h的原则估算出各省应配备审核报告的人员数量[1],则有21个省中心的现有编制数量无法满足需要。58%的问卷认为,现有人员数量严重不足,29%的问卷表示不太足。
2.2.2 工作人员学历和专业结构有待优化
从总体来看,全国省级中心从事ADR监测的工作人员本科学历达70%以上,硕士研究生近20%,本科以下学历和博士研究生学历各占5%。专业组成方面,现有工作人员以药学和临床医学为主,占80%以上,另外也有少数中药学、中医学、预防医学、信息管理、药物流行病学、统计学、检验、公共卫生等相关专业人员。调查显示,临床药学、药物流行病学、统计学和信息管理(计算机)专业人才对于开展ADR监测工作是必需的,但目前却紧缺。68%的问卷表示现有人员学历基本能满足工作需要,26%表示不太满足。对于现有专业分布,16%的省中心表示严重不满足工作需要,52%的省中心表示不太满足。
2.2.3 各省ADR专家委员会尚未全部成立
由于ADR监测工作的复杂性,各级ADR监测机构的分析评价水平并不能完全满足工作需要,需要一个由多学科专家组成的咨询委员会来为其提供技术支持[1]。尤其面对一些突发性群体或严重不良事件时,应及时有效地组织各方专家在第一时间进行全面调查和准确判断,充分发挥专家在ADR监测与评价中的技术指导和决策咨询作用。目前全国23个省建立了ADR专家委员会,尚有8个省没有成立。100%的被调查单位认为,应设立专家委员会。
2.3 省级ADR监测中心职能和职责定位
2.3.1 职能范围较大
所有省级ADR监测中心均承担至少两项主要职能,“药品不良反应监测”是最主要的职能,此外还涉及“医疗器械不良事件监测”和“药物滥用监测”职能。26个省中心的主要职能为上述3项,内蒙古、山东、宁夏、浙江4个省中心的主要职能为“药品不良反应监测”和“医疗器械不良事件监测”,青海省中心的主要职能为“药品不良反应监测”和“药物滥用监测职能”。将多项职能与现有人员编制对比,职能范围偏大。以江苏省为例,省中心从事ADR监测的人员共8人,同时承担3项监测职能,无论是在编人员还是兼职人员都在超负荷工作。
2.3.2 职责定位不清晰
《药品不良反应监测管理办法》(2004年)规定:“省、自治区、直辖市药品不良反应监测中心在省、自治区、直辖市(食品)药品监督管理局的领导下承办本行政区域内药品不良反应报告资料的收集、核实、评价、反馈、上报及其它有关工作”。但对于市、县级中心的职责,则没有规定。然而实际工作中,各省中心对ADR监测工作的职责定位各异,主要表现为:与药监部门的职责区分不明确,省中心是“主动组织”还是“受药品监督管理部门委托”来承担、配合或参与相关工作;对工作的范围存在质疑,如并非所有省中心都实施辖区内重点品种的监测工作,也有不少省中心认为反馈职责难以履行;省、市、县三级ADR监测工作职责在实际工作是否应各有侧重。职责定位的差异,说明我国关于ADR监测工作的工作职责和工作程序还有待进一步明确。否则,会造成地方ADR监测机构对应承担的责任认识不清、定位不准,也使得作为技术机构的ADR监测机构与行政部门之间的职责“扯皮”,制约工作的深入开展。
2.4 省级ADR监测中心硬、软件配备状况
2.4.1 监测装备配置不足
我国省级ADR监测中心日常办公设备和监测设备的配置情况均不理想(表2),最基本的台式电脑也没能达到每人1台的标准,只有传真机和数码相机能勉强达到每个中心1台。部分省中心的配置在平均水平之下,工作将更加得不到保障。如新疆ADR监测中心仅有1台传真机和每人0.5台台式电脑,更谈不上打印机、复印机这类最基本的办公设备。除了日常监测,地方中心对严重和群发性病例报告还需进行现场核实调查,然而开展现场调查的应急用车、取证工具等都得不到保障,工作必然不畅。
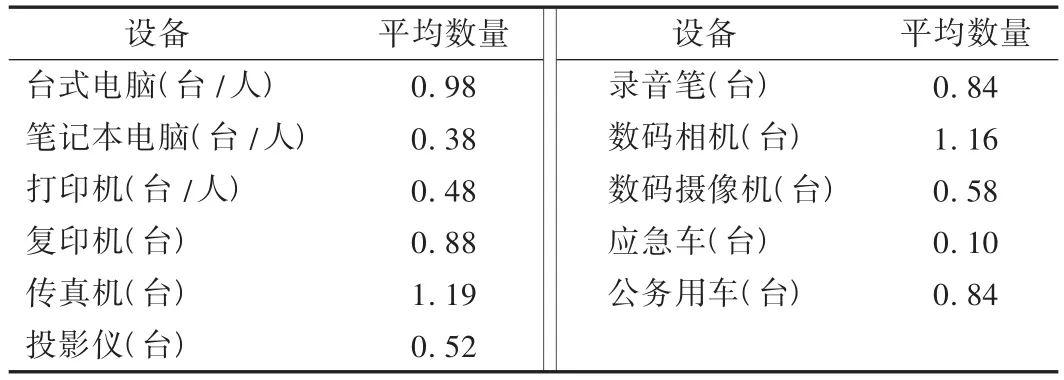
表2 全国各省级中心的专用设备配置情况
2.4.2 ADR 信息网络建设薄弱
目前我国ADR报告收集的网络平台是全国统一在线呈报系统,而大部分基层报告单位和ADR专业监测机构对ADR报告的初步评价也主要基于全国在线呈报系统的数据。截至2009年底,各省已开通在线呈报的基层用户数量从43~9 487家不等,实际使用用户从30~4 532家不等,还有不少偏远基层地区没有被监测网络覆盖到。对于基层用户数量较多的省份,由于现有在线呈报平台的局限性导致系统难以同时容纳较大数量用户,因而网络堵塞现象十分严重,用户经常无法登陆系统,制约了ADR报告的积极性和专业监测机构对数据的处理及利用效率。ADR信息网络建设的不足还体现在网络的功能并不完善,主要是缺乏信号监测、应急预警、统计分析、病例讨论分析、药物相互作用检测等功能;并且,基层单位还未实现与省中心的数据共享,医疗机构自主开展评价工作的数据平台也无法与现有省中心网络系统有效对接,限制了基层单位自主开展初步评价工作的积极性。
2.4.3 数据分析能力不足
多数省中心使用至少一种数据分析软件。84%的省中心使用过全国在线呈报系统;58%的省中心将Excel作为常用的数据分析软件之一,使用ACESS和SPSS分析软件的省份也各占19%。此外,北京、江苏、广东、辽宁都开发了独有的药品不良反应信息管理平台或信号检测系统,重庆和云南使用的是广东省中心开发的软件。大多数省中心在线呈报系统的数据分析等功能十分局限,然而大部分省中心自主开发数据分析软件的动力不足,至今仍有不少省中心难以胜任报告评价工作。独立开发出数据分析软件,在一定程度上反映出该省中心在ADR监测工作的数据处理方面先行一步,ADR监测评价工作相对更受重视。
2.5 市、县级ADR监测机构建设流于形式
市、县级ADR监测中心的建设情况明显流于形式。据调查,全国设有药监机构的458个省辖市中,只有6个省辖市设立了经编办批准的独立的ADR监测中心,分别是辽宁大连、黑龙江哈尔滨、山西晋城、安徽阜阳、广东深圳以及海南三亚;其他省辖市级ADR监测中心则以加挂牌形式挂靠在药监局、药品检验所、医院等,其中有独立ADR编制的仅有4个中心,即浙江的杭州和宁波、广东广州、辽宁沈阳。从全国范围来看,西部地区的省辖市级ADR监测机构更不理想,大都未设置、未挂牌。据此次问卷的不完全统计,全国近一半的省份未设置县/区级ADR监测机构。约70%以上省辖市级ADR监测中心的工作人员少于3人,对县级ADR监测机构来说,一般只有0~2人兼职负责报告的收集。在一些ADR监测工作较落后或不受重视的地区,甚至连收集报告的人员都无法保证。
3 建设滞缓的原因
我国地方ADR监测中心的建设情况虽在经济发展程度不同的省份之间有所差异,但普遍呈现出机构队伍不稳定、职责不清晰、软硬件保障不足等问题。省级ADR监测中心相较于市县级机构虽已基本落实,但其机构建设近年来并无突破性进展,机构建设的不足明显对现有工作产生了直接且消极的影响。ADR专业监测机构的建设之所以推进较缓慢,笔者认为,根本原因在于ADR监测工作的制度依存性不足,主要体现在监测机构的法律地位不明确,报告主体的责任规定过于笼统,ADR赔偿和救济制度尚难以建立,以及缺乏科学的行政手段、工作程序和技术规范。
政府的支持是ADR监测工作在全国范围内取得良好协调开展的重要保证[3]。ADR监测工作涉及地方政府、卫生部门、药监部门和各个报告主体的多方利益博弈,在制度缺失的情况下,缺乏平衡利益的规制,形成了不利于ADR制度实施的格局。地方药品监管部门往往也没有足够动力重视此项工作,这直接影响了ADR专业监测机构建设的进展。在当前机构改革背景下,药监部门大都划归卫生部门或地方政府管理,由于ADR监测工作与医药产业的经济利益弱相关,因此相对于企业准入和产品上市等工作,ADR监测工作较难获得地方政府的重视。有不少监测机构反映,机构改革后ADR报告数量下滑较明显,ADR监测工作的形势更加严峻。
4 建议
要从根本上解决ADR专业监测机构建设过程中存在的问题,从而提高机构的工作能力,需要从完善制度的层面着手。首先,应完善法律法规以及制订相应的技术规范、工作程序,以明确各级ADR专业监测机构的法律地位、设置要求、具体职能定位和职责分工,为监测机构执行每一项工作提供有效依据,也为争取地方政府的政策支持和保障措施提供依据。其次,应进行平衡利益的制度设计,对ADR监测机构建设这项工作来说,平衡药监系统内部的利益是首要的,要改善从事ADR监测工作的人员易被边缘化的现状,例如可将ADR监测工作与其他药品许可制度相链接,同时针对机构建设和工作实施情况设置科学的考核指标和激励措施,引导各地监管系统内部对ADR监测工作的重视。在此基础上,完善ADR监测机构这一目标,才能真正落到实处。
[1]陈易新.WHO关于药物警戒中心建立与运行工作指南(二)[J].中国药物警戒,2007,4(4):200-203.
[2]谢金洲,周 勇,田月洁,等.我国省级药品不良反应监测机构模式研究[J].中国药物警戒,2009,17(8):8-12.
[3]陈易新.澳大利亚药品研发生产机构上报药品不良反应指南[J].中国中医药信息杂志,2003,10(9):88-89.
R954
A
1006-4931(2011)08-0005-03
2010-12-28)
