NirB启动子调控下鼠沙门氏菌体内诱导型表达载体的构建
2011-09-28王学林李慧萍张凌怡唐艺芝杨秀丽徐德启刘明远王光明
郭 恒,王学林,李慧萍,刘 学,张凌怡,唐艺芝,高 鹤,杨秀丽,徐德启,3,刘明远*,王光明*
(1.吉林大学人兽共患病研究所,吉林长春130062;2.吉林大学第二临床医学院妇产科;3.美国食品与药品管理局(FDA),美国马里兰20892)
减毒沙门氏菌是细胞内致病菌,可通过肠道黏膜侵入黏膜相关淋巴组织,被抗原提呈细胞如巨噬细胞摄取,并在其中增殖。由于其感染的细胞靶向性,减毒沙门氏菌作为口服疫苗载体具有很好的发展潜力,可在多种哺乳动物体内诱导出体液、细胞及黏膜免疫应答[1-3]。由于外源基因表达的蛋白对沙门氏菌可能具有毒性作用,在缺乏选择条件的体内环境中,菌体内的外源质粒可逐渐丢失,因此构建营养缺陷系统、染色体整合、使用体内激活的启动子等已成为改进减毒沙门氏菌载体的关键。体内激活启动子转录活性极低,而在被摄入的宿主细胞内高水平表达,故这种宿主体内激活的启动子不仅可减少表达产物对细菌的毒性,而且也有助于防止重组质粒的丢失[4,5]。
本研究从鼠沙门氏菌基因组DNA中克隆出PnirB启动子,以绿色荧光蛋白(EGFP)为报告基因,构建一个遗传稳定性好、蛋白表达量高的沙门氏菌体内诱导型表达载体,为以减毒沙门菌为活载体的安全、有效、廉价的新型“暴露前”口服疫苗的研究奠定基础。
1 材料与方法
1.1 实验材料
鼠沙门氏菌PhoP/PhoQ株(简称S.PQ株),大肠埃希菌(E.coli)JM109,载体质粒 pGB2、pkk233-2、pEGFP-N1由本实验室保存。核酸内切酶HindⅢ、BamHⅠ、EcoRⅠ、XhoⅠ,T4 DNA连接酶,DNA凝胶回收试剂盒购自MBI公司,Ex Taq DNA聚合酶、pMD18-T simple载体、DNA Marker(DL2000)购自TaKaRa公司,细菌基因组DNA小量抽提试剂盒、质粒提取试剂盒购自V-gene公司。
1.2 目的片段的扩增
以S.PQ株基因组:pEGFP-N1、Pkk233-2载体质粒为模板,分别扩增PnirB、EGFP和 rrnbT1T2转录终止序列。纯化回收的PCR产物连至pMD18-T simple载体构建重组质粒。PCR和双酶切鉴定正确后送Sangon公司测序。测序正确的重组质粒命名为18TPnirB、18T-EGFP、18T-rrnb。具体引物序列如表1:

表1 扩增用引物序列
1.3 重组表达载体的构建
将构建的18T-PnirB、18T-EGFP、18T-rrnb质粒分别用HindⅢ/BamHⅠ 、BamHⅠ/XhoⅠ、XhoⅠ/EcoRⅠ进行双酶切,回收目的片段。回收后的片段与HindⅢ/EcoRⅠ酶切的pGB2载体片段22℃在T4 DNA连接酶作用下连接2 h,转化至宿主菌JM109中。重组菌质粒经PCR、双酶切及测序鉴定正确后命名为pGnirB-EGFP-rrnb。
1.4 减毒鼠沙门氏菌的电穿孔转化
按Sanderson KE等[6]的方法制备S.PQ感受态细菌,分别加入 1 μ g pGnirB-EGFP-rrnb和 pGB2质粒,混匀后冰浴15 min并移入1 mm电转杯中。电转仪经预热后,C=25 μ F 、PC=200 ohm、V=1.25 kV参数下进行电转化操作。电击结束后迅速加入1 ml液体LB培养基,37℃震荡培养1 h。取 300 μ l菌液涂布于含 50 μ g/ml壮观霉素(spectinomycin,SPC)的LB固体培养基平皿上,于37℃培养12-16 h。重组菌经 PCR鉴定正确后命名为S.PQ-EGFP、S.PQ-pGB2。
1.5 S.PQ-EGFP重组菌中质粒的体外遗传稳定性试验
参考Xu DQ等[7]的方法在无抗生素选择压力下用连续传代法鉴定质粒在转化菌中的遗传稳定性。挑取S.PQ-EGFP单菌落,接种到5 mL LB培养基中,37℃,空气浴振荡培养12-16 h,将重组菌梯度稀释至约100 CFU/ml,在无抗生素的LB液体培养基中继续培养12 i(约25代),同法获得第50、75、100代的细菌。将不同代次的重组菌稀释后涂于无抗生素的琼脂板上,37℃倒置培养12 h,每个板随机挑取20个单菌落进行PCR鉴定。
1.6 EGFP表达的检测
将5 ml S.PQ-EGFP和S.PQ-pGB2重组菌37℃空气浴振荡培养至OD值约0.5,用无菌液体石蜡封闭液面,37℃恒温培养箱中静置培养72 h。离心收集重组菌,0.01×PBS洗3遍后取适量菌涂布于载玻片上于激光共聚焦显微镜(10×,200×)下观察。
2 结果
2.1 基因的克隆、鉴定及序列分析
扩增的PnirB、EGFP和rrnbT1T2片段电泳结果显示分别获得与理论值大小相符的特异目的条带(图1)。双酶切相应的连于T载体的质粒,电泳后出现与目的片段大小一致的特异带(图2)。测序表明扩增的EGFP和rrnb和PnirB片段GenBank中序列完全一致。

图1 PnirB、EGFP、rrnbT1T2片段的 PCR扩增
2.2 重组表达载体的构建
按低拷贝质粒提取说明书提取构建的重组菌质粒,用 GFP-1 和 GFP-2、NirB-1 和 GFP-2、NirB-1和rrnb-2引物进行PCR验证,1%琼脂糖凝胶电泳显示分别扩增出约750 bp、1 000 bp和1 400 bp的片段,大小与理论值相符(图3)。BamHⅠ和XhoⅠ双酶切重组质粒,电泳显示插入的基因片段与理论大小相符(图4)。重组质粒于Sangon公司以引物NirB-1和rrnb-2测序,结果表明插入到pGB2载体上的三个片段均无突变错误,而且未出现移码,该表达载体可应用于后续实验。
2.3 S.PQ-EGFP中质粒的遗传稳定性检测
S.PQ-EGFP在无抗生素的情况下连续传代培养,长势良好,每25代随机挑取20个单菌落进行PCR,重复两次,只一组的第100代次出现一个阴性结果,表明重组质粒在菌中未丢失,遗传稳定性高于95%。
2.4 EGFP在沙门氏菌中的表达
重组菌厌氧静置培养72 h后,表达菌细胞涂布于载玻片上,激光共聚焦显微镜下观察发现S.PQEGFP组菌体有绿色荧光出现,而对照组无绿色荧光,说明PnirB调控下的沙门氏菌体内诱导型表达载体构建成功(图5)。
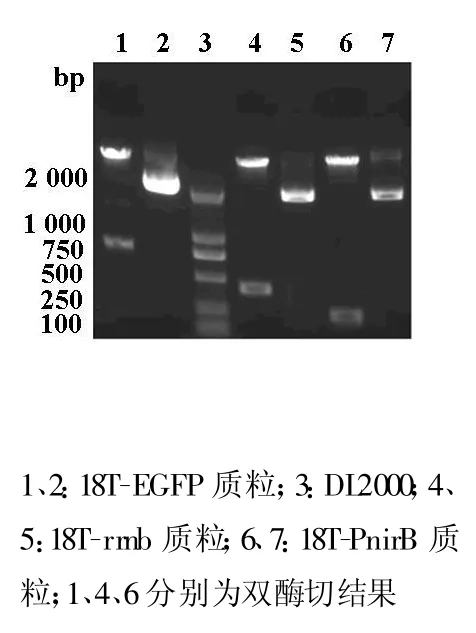
图 2 18T-EGFP、rrnb、PnirB质粒的酶切图

图3 重组表达载体的PCR鉴定

图4 重组表达载体的酶切鉴定
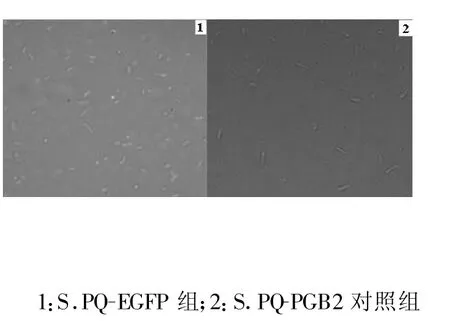
图5 重组菌表达的荧光检测(10×,200×)
3 讨论
本实验选用了含pSC101复制子的低拷贝(5-7个/cell)pGB2载体为骨架。pSC101复制子中含有具有分配功能的DNA片段即par区(410 bp),par区不含有转录或翻译的起始信号,可专一性地负责质粒的分配和稳定的维持。研究显示[8],贯穿启动子的转录将抑制启动子的功能,造成所谓的启动子封堵。由此本实验在构建的pGB2-EGFP载体的多克隆位点的下游加入了来自大肠杆菌rrnB操纵元的两个终止子T1和T2串联的强转录终止序列rrnbTlT2。虽然转录终止子在表达质粒的构建过程中常被忽略,但有效的转录终止子是表达载体必不可少的元件。转录终止子的出现将增强mRNA的稳定性,并最大限度地减小背景的转录。体外遗传稳定性研究显示,本试验构建的表达载体无抗生素下培养24 h后稳定性达95%以上,明显高于使用PGB2载体构建的炭疽保护性抗原表达系统(73%)无终止序列[9],这种差异的原因尚需进一步的实验研究。
由于目前尚无商品化的含有nirB启动子的表达载体,本文使用常规分子生物学方法构建了低拷贝的体内诱导型表达载体。通过报告基因EGFP的使用实现了对重组载体在沙门菌中表达蛋白能力的方便、快速、直观的检测。本实验的完成为以减毒沙门菌为活载体的安全、有效、廉价的新型“暴露前”口服疫苗的研究奠定了基础。
[1]Galen JE,Pasetti MF,Tennant S,et al.Salmonella enterica serovar Typhi live vector vaccines finally come of age[J].Immunol Cell Biol,2009,87(5):400.
[2]Sztein MB.Cell-mediated immunity and antibody responses elicited by attenuated Salmonella enterica serovar Typhi strains used as live oral vaccines in humans[J].Clin Infect Dis,2007,45(Suppl 1):S15.
[3]Li Y,Wang S,Xin W,et al.A sopB deletion mutation enhances the immunogenicity and protective ef?cacy of a heterologous antigen delivered by live attenuated Salmonella enterica vaccines[J].Infect Immun,2008,76:5238.
[4]Garmory HS,Titball RW,Brown KA,et al.Construction and evaluation of a eukaryotic expression plasmid for stable delivery using attenuated Salmonella[J].Microb Pathog,2003,34(3):115.
[5]Chatfield SN,IG Charles,Makoff A J,et al.Use of the nirB promoter to direct the stable expression of heterologous antigens in Salmonella oral vaccine strains:development of a single-dose oral tetanus vaccine[J].Nature Biotechnology,1992,10:888.
[6]Sanderson KE,MacLachlan PR,Hessel A.Electrotransfor mation in Salmonella[J].Methods Mol Biol,1995,47:115.
[7]Xu DQ,Cisar JO,N Ambulos,et al.Molecular cloning and characterization of genes forShigella sonnei form IO polysaccharide:proposed biosynthetic pathway and stable expression in a live Salmonella vaccine vector[J].Infect Immun,2002,70(8):4414.
[8]Adhya S,Gottesman M.Promoter occlusion:transcription through a promoter may inhibit its activity[J].Natuve Biotechnology,1992,10:888.
[9]Manuel Osorio,Yanping Wu,Sunil Singh,et al.Anthrax Protective Antigen Delivered by Salmonella enterica Serovar Typhi Ty21a Protects Mice from a Lethal Anthrax Spore Challenge[J].Infect Immun,2009,77(4):1475.
