高温高压转化合成丹酚酸A的工艺研究
2011-09-26王颖,朱靖博,付绍平,张凯璞,张毅
王 颖, 朱 靖 博, 付 绍 平, 张 凯 璞, 张 毅
( 1.大连工业大学 食品学院, 辽宁 大连 116034;2.大连博迈科技发展有限公司, 辽宁 大连 116034 )
0 引 言
丹参水溶性成分是丹参中的一类重要活性成分,具有很强的抗过氧化和清除自由基的能力[1-2]。丹参水溶性成分多为酚酸性结构,常见的有丹参素、迷迭香酸、紫草酸、丹酚酸B、丹酚酸A等[3],其中以丹酚酸B含量最高,但是丹酚酸A对心肌、脑组织缺血再灌注损伤[4-5]的保护作用强于丹酚酸B,丹酚酸A还具有良好的抗氧化作用[6],抗肝损伤作用[7]。由于丹酚酸A在丹参中含量极低且性质不稳定,故采用传统的提取分离方法难以得到大量丹酚酸A。
丹酚酸B经过水解、脱羧及开环一系列反应能够生成丹酚酸A(图1)。本实验以丹酚酸提取物(主要为丹酚酸B)为原料研究了转化制备丹酚酸A的工艺路线,为今后丹酚酸A的工业化生产和医学研究奠定了的基础。

图1 丹酚酸B及丹酚酸A的结构
1 仪器与试剂
Dionex UltiMate3000高效液相色谱仪,美国戴安公司;1810D型自动双重纯水蒸馏器,上海申生科技有限公司;超声波清洗器,天津奥特塞恩斯仪器有限公司;恒温电加热反应釜(内径40 mm,最大承压30 MPa),实验室自制。
丹酚酸B质量分数分别为10%和28%的丹酚酸提取物,陕西昂盛生物医药科技有限公司;丹酚酸A、丹酚酸B对照品,实验室自制,纯度≥98%。实验用水经自动双重纯水蒸馏器处理。
2 试验方法
2.1 酸的配制
精密量取磷酸0.34 mL、硫酸0.27 mL、盐酸0.42 mL、硝酸0.33 mL,称取柠檬酸1.551 0 g,分别置于5支50 mL容量瓶中,加入去离子水定容至刻度,配置成浓度均为0.1 mol/L的酸溶液。
2.2 丹酚酸A质量分数的测定
2.2.1 色谱条件
色谱柱,Kromasil C18(250 mm×4.6 mm,5 μm);体积流量,1 mL/min;检测波长,280 nm;进样量,20 μL;柱温,25 ℃。流动相:A,体积分数0.1%的甲酸水;B,乙腈;梯度洗脱条件:0~8 min,8%~18% B;8~15 min,18%~21% B;15~40 min,21%~34% B;40~50 min,34% B。
2.2.2 标准曲线的制作
精密称取丹酚酸A对照品0.027 5 g于50 mL容量瓶中,加甲醇定容至刻度,得到质量浓度为0.550 mg/mL的标准溶液。分别精确移取1、2、3、4、5 mL标准溶液至5支10 mL容量瓶中,加入甲醇定容,配制成0.055、0.110、0.165、0.220、0.275 mg/mL的不同质量浓度梯度的溶液,用于标准曲线绘制。以丹酚酸A的质量浓度为横坐标,峰面积为纵坐标,绘制标准工作曲线。求得回归方程为:Y=638.69X-1.012 6,(R2=0.999 8),丹酚酸A的质量浓度在0.055~0.550 mg/mL线性关系良好。
2.3 转化合成丹酚酸A的方法
精密称取适量丹酚酸提取物(丹酚酸B质量分数为10%),加入去离子水超声溶解,配制成一定浓度的丹酚酸提取物溶液,调节pH后,精密吸取5 mL于试管中,密封,将试管置于恒温电加热反应釜中,在80~120 ℃下加热1~6 h,加热完毕后,取出冷却,将反应溶液稀释至0.5 mg/mL(以反应前丹酚酸B计),经0.45 μm微孔滤膜过滤,进样20 μL进行HPLC分析。
根据标准曲线方程计算出反应后丹酚酸A的浓度,据下式得到丹酚酸A的得率为
YA=CAV/m
式中,YA,丹酚酸A的得率,%;CA,反应后稀释溶液中丹酚酸A的质量浓度,mg/mL;V,反应后稀释溶液的体积,mL;m,反应前丹酚酸提取物的质量,mg。
2.4 酸的种类及丹酚酸B含量对转化反应的影响
分别用硫酸、磷酸、盐酸、硝酸、柠檬酸调节反应溶液pH,按照“2.3”的方法进行反应,分别以丹酚酸B质量分数为10%、28%的丹酚酸提取物和丹酚酸B纯品为反应原料进行反应,以丹酚酸A的得率为衡量指标对酸的种类及丹酚酸B含量进行考察。
2.5 转化合成丹酚酸A的单因素试验及正交试验
分别对丹酚酸提取物转化条件中的反应时间、反应温度、pH、物料浓度进行单因素试验,并根据单因素试验得出的各因素最适范围,设计L9(34)正交试验,以确定转化合成丹酚酸A的最佳工艺条件。
3 结果与讨论
3.1 酸的选择
由图2及表1可以看出经过高温高压反应后丹酚酸B的含量明显下降,而丹酚酸A的含量大幅度增加,在加入不同酸的条件下丹酚酸A的得率均大于3.8%,其中加入硝酸后丹酚酸A的得率最低,加入盐酸丹酚酸A的得率最高;硫酸、磷酸、柠檬酸三者差距不大,反应中丹酚酸A的得率均在4%以上。因此选择除硝酸外的酸调节pH,更有利于丹酚酸A的生成。
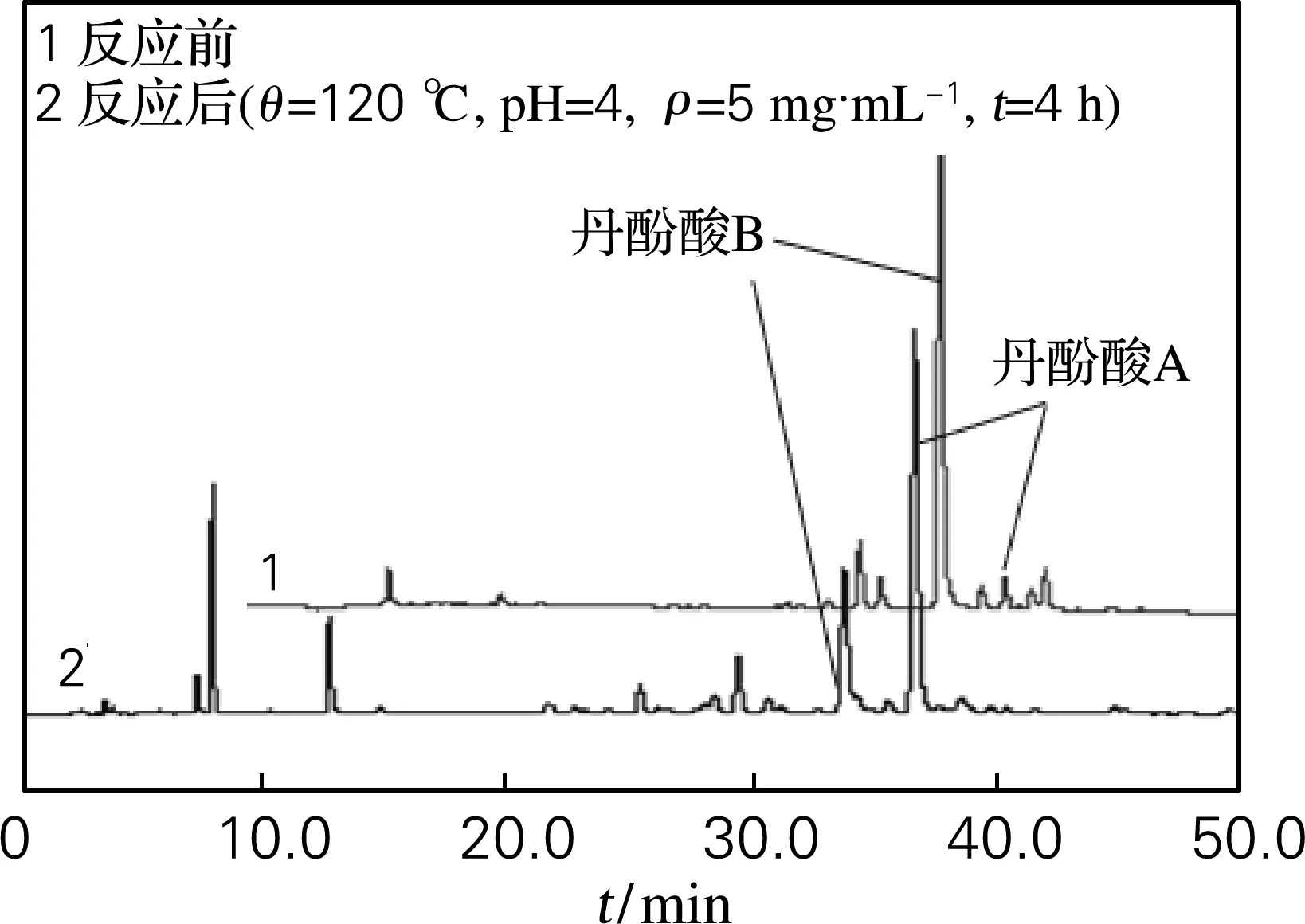
图2 丹酚酸提取物的高效液相色谱图

表1 酸的种类对转化合成丹酚酸A的影响
3.2 丹酚酸提取物中丹酚酸B的含量对转化合成丹酚酸A的影响
丹参酚酸B含量对转化合成丹酚酸A的影响研究表明,丹酚酸B质量分数为10%和28%的丹酚酸提取物反应后丹酚酸A的得率分别为2.48%和2.34%,而丹酚酸B纯品经高温高压转化后,丹酚酸A的得率仅为0.69%,明显低于其他两种原料。由此可以推测,丹酚酸A不完全由丹酚酸B转化而成,可能还与其他酚酸类成分有关。
3.3 反应时间对转化合成丹酚酸A的影响
在温度为120 ℃,pH为4,物料质量浓度(以丹酚酸提取物中丹酚酸B计)为5 mg/mL的条件下考察反应时间对反应的影响。由图3可以看出在1~3 h内,反应溶液中丹酚酸A的得率随着反应时间的增加而提高;反应时间为3 h时,丹酚酸A的得率几乎达到5%;4 h时转化丹酚酸A的得率达到最高;随着反应时间的延长,其得率不再有明显变化。由图3可见,丹酚酸提取物在反应4 h时产生的丹酚酸A最多。

图3 反应时间对转化合成丹酚酸A的影响
3.4 反应温度对转化合成丹酚酸A影响
在反应时间为4 h,pH为4,物料质量浓度(以丹酚酸提取物中丹酚酸B计)为5 mg/mL的条件下考察温度对转化反应的影响。由图4看出转化温度在80~120 ℃时,丹酚酸A的得率随着温度的升高而不断提高;120 ℃时丹酚酸A的得率达到最高;当转化温度达到140 ℃时,丹酚酸A的得率急剧下降。由图4可见,温度低于120 ℃时,丹酚酸提取物转化不充分;温度高于120 ℃时,过高的温度和压力导致转化得到的丹酚酸A遭到破坏,这可能是丹酚酸得率降低的原因。

图4 反应温度对转化合成丹酚酸A的影响
3.5 pH对转化合成丹酚酸A影响
在温度为120 ℃,反应时间为4 h,物料质量浓度(以丹酚酸提取物中丹酚酸B计)为5 mg/mL的条件下考察pH对反应的影响。如图5所示,pH 1~4,丹酚酸A的得率随着pH的增大而不断提高;当pH大于4时,丹酚酸A的得率反而降低。由图5可见,反应最适pH为4,说明反应溶液呈酸性时有利于转化为丹酚酸A,酸性过强或过弱都不利于丹酚酸A的产生。
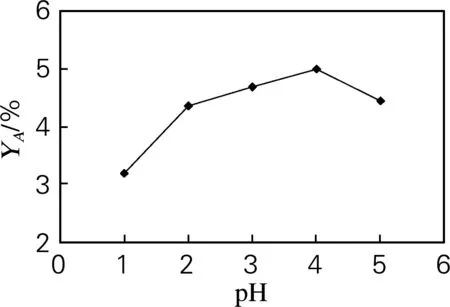
图5 pH对转化合成丹酚酸A的影响
3.6 物料质量浓度对转化合成丹酚酸A影响
在温度为120 ℃,反应时间为4 h,溶液pH为4的反应条件下考察物料质量浓度(以丹酚酸提取物中丹酚酸B计)对丹酚酸A得率的影响。如图6所示,物料质量浓度在0.5~5 mg/mL时,丹酚酸A的得率随着物料浓度的增大而提高;物料质量浓度在5~15 mg/mL时,丹酚酸A的得率随着物料浓度的增大而减小。
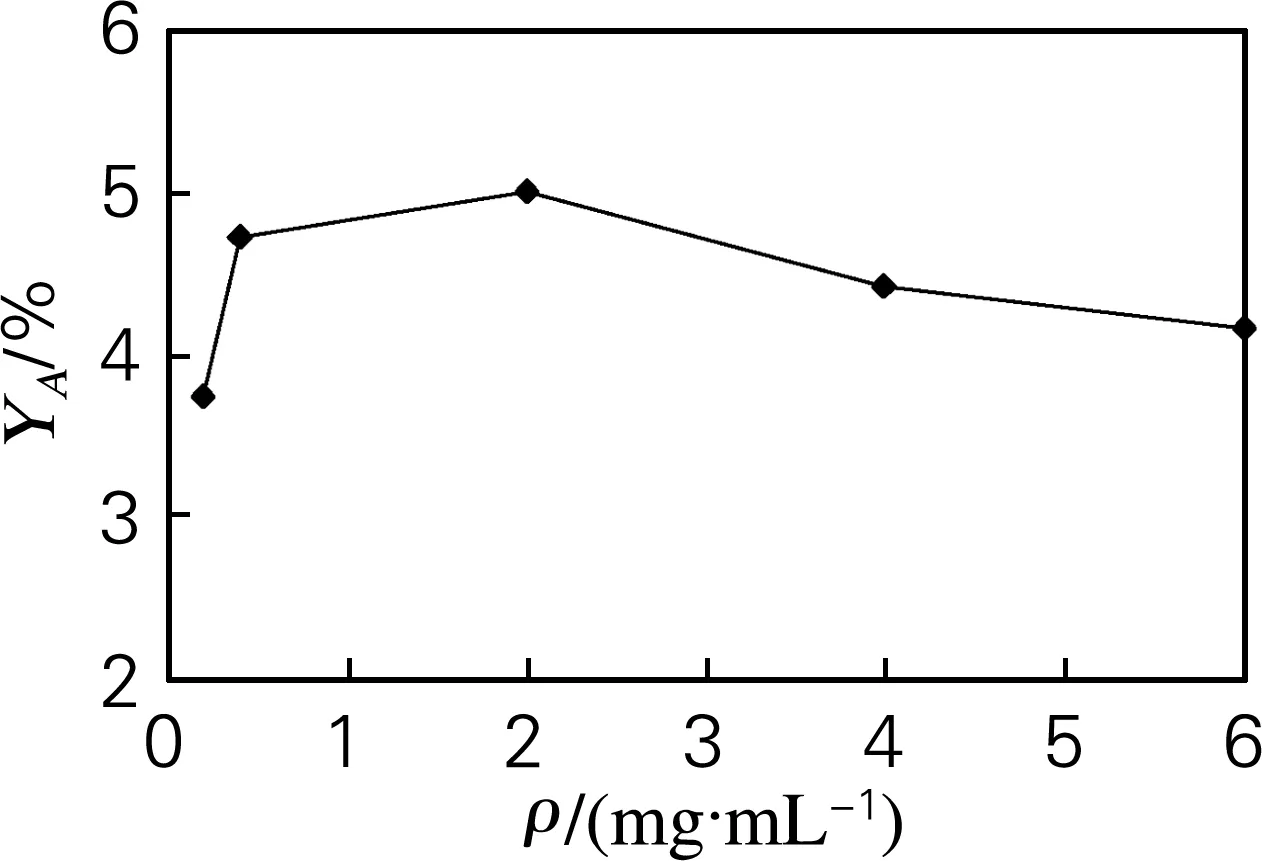
图6 物料质量浓度对转化合成丹酚酸A的影响
3.7 转化合成丹酚酸A的正交试验分析
通过表2、3可以看出,影响转化生成丹酚酸A的因素主次顺序为B、A、D、C,即反应温度、反应时间、物料质量浓度、pH。最佳工艺条件为B2A3D2C3,即反应时间4 h,反应温度120 ℃,pH 5,物料质量浓度5 mg/mL。

表2 正交试验因素水平表
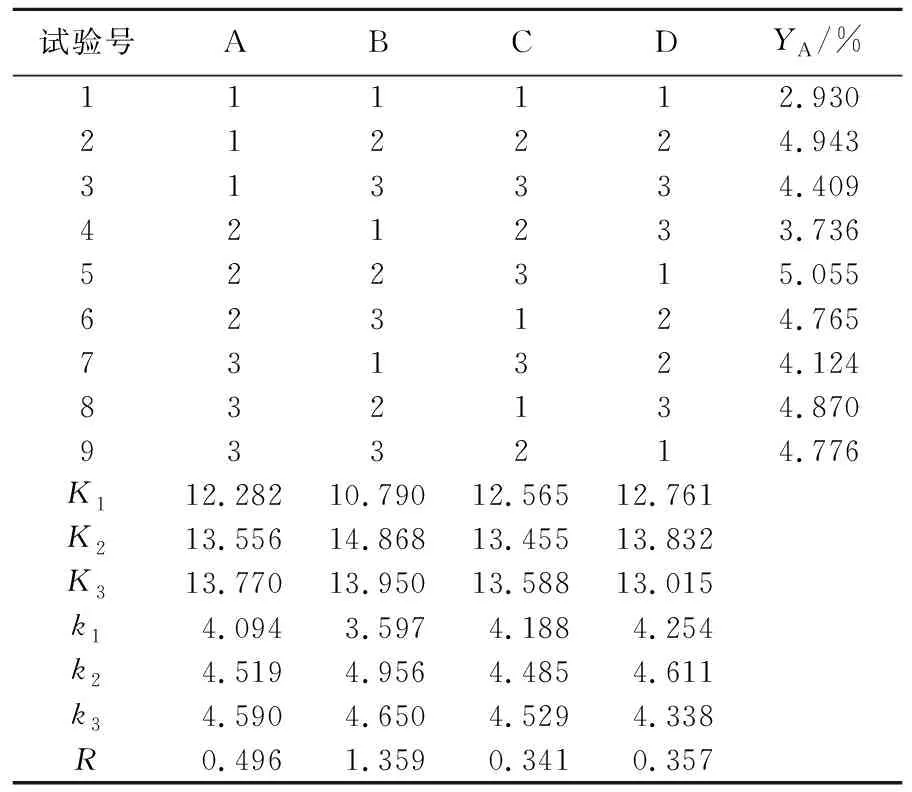
表3 正交试验结果分析
4 结 论
在酸性条件下,经高温高压处理丹酚酸提取物获取丹酚酸A是一种可行的制备方法。最佳工艺条件:反应时间4 h,反应温度120 ℃,pH 5,物料质量浓度5 mg/mL,其中反应温度和反应时间对丹酚酸A的生成影响较大。
[1] 曲桂武. 丹参总酚酸的制备工艺及质量标准研究[D].青岛:中国海洋大学, 2004.
[2] 杜冠华,张均田. 丹参现代研究概况与进展[J]. 医药导报, 2004, 23(6):355-360.
[3] 顾娟. 丹参中酚酸类物质的提取与纯化[D].成都:成都理工大学, 2006.
[4] 宋延平,孔令姗,吴静,等. 丹酚酸A与丹酚酸B改善大鼠心肌缺血作用比较[J]. 中国中医药信息杂志, 2007, 14(9):36-38.
[5] 商洪才,曹洪波,汪洋,等. 丹参酚酸A、B对大鼠局灶性脑缺血损伤保护效应比较[J]. 中药药理与临床, 2007, 23(3):15-17.
[6] WANG Shou-bao, YANG Xiu-ying, TIAN Shuo, et al. Effect of salvianolic acid A on vascular reactivity of streptozotocin-induced diabetic rats [J]. Life Sciences, 2009, 85(13/14):499-504.
[7] WU Zhi-ming, WEN Tao, TAN Yu-fen, et al. Effects of salvianolic acid A on oxidative stress and liver injury induced by carbon tetrachloride in rats [J]. Basic & Clinical Pharmacology & Toxicology, 2007, 100(2):115-120.
