离子液体的制备与性质表征*
——介绍一个综合化学实验
2011-09-25张海波夏春兰谢音王聪玲龚楚清龚林波
张海波 夏春兰 谢音 王聪玲 龚楚清 龚林波
(武汉大学化学与分子科学学院 湖北武汉 430072)
在传统的有机反应中,易挥发的有机溶剂(the volatile organic compounds,VOCs) 能很好地溶解有机化合物,常被用做反应介质。但有机溶剂的挥发性、毒性、易燃性和难以回收又会成为对环境有害的因素。因此,传统有机溶剂的替代研究是绿色化学领域的一个极其重要的部分,无溶剂有机反应(solvent-free organic reaction)、干反应(dry media)、用水作介质的反应、超临界流体介质中的反应将成为洁净合成的重要途径。 除此之外,离子液体(ionic liquid)被广泛应用来替代传统的有机溶剂,并已在有机合成、化学分离、电化学等领域显示出令人满意的效果。可以说,离子液体因绿色化学的兴起而成名,因明天的化学理想——绿色和可持续的化学而成为热点。将这一研究内容引入本科生综合实验,可以使学生较早地接触前沿科学,更好地了解现代化学的发展方向,有利于高素质人才培养。本实验内容设计为两部分:① 离子液体的合成;② 离子液体性质的表征。
1 实验目的
① 了解离子液体的含义及其在有机合成中的应用。
② 熟悉1-甲基-3-丁基咪唑溴盐的制备方法和阴离子交换方法。
③ 熟悉离子液体的性质及其表征手段。
2 实验原理
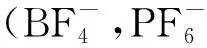
离子液体是一种新型的溶剂和催化剂,对有机、金属有机、无机化合物有很好的溶解性。由于离子液体没有蒸气压,可以用于高真空下的反应;同时又无味、不燃,在作为环境友好的溶剂方面有很大的潜力。离子液体具有极性,可溶解作为催化剂的金属有机化合物,替代具有高的对金属配位能力的极性溶剂如乙腈等。溶解在离子液体中的催化剂,同时具有均相和非均相催化剂的优点。催化反应有高的反应速度和高的选择性,产物可通过静置分层或蒸馏分离出来。留在离子液体中的催化剂可循环使用。
最近,离子液体在有机合成中受到广泛的关注,如 Fridel-Crafts 烷基化和酰基化,Diels-Alder 反应,Heck 反应,Suzuki 反应,Mannich 反应和醛酮缩合反应等[5]。
离子液体也被用于萃取特殊的化合物,如代替HF溶解油母岩[6],从天然产物中萃取多肽[5]。据文献报道[6],离子液体还可用于核废料的回收处理。离子液体的溶解性可通过变化阴离子或阳离子中烷基链的长短而改变。因此,人们称离子液体为“可设计合成的溶剂”。多数离子液体的合成采用两步法,该方法具有以下优点:① 大量廉价的卤代烷可以作为烷基化的原料;② 在一定温度下这类反应可以平稳地进行完全,而且,所制得的卤代盐能够很容易地通过阴离子交换来得到其他阴离子的盐。以1-甲基-3-丁基咪唑氟硼酸盐和 1-甲基-3-丁基氟磷酸盐为例,合成路线如图1所示。其中反应第1步是原子经济性反应,投入的原料全部转化为产物,符合当前绿色化学的要求。由于第1步反应过程中随反应进行会有强烈的放热,离子液体的色泽会变深,因此反应温度不宜超过80℃。
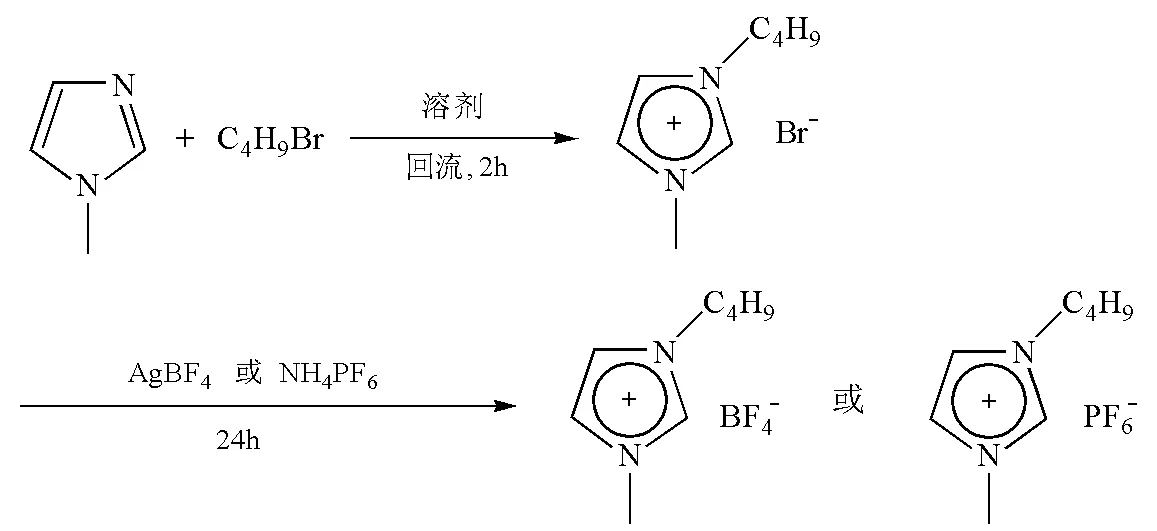
图1 离子液体的合成路线
3 实验仪器及药品
(1) 丙酮的提纯:在圆底烧瓶中,加入0.5g高锰酸钾、100mL丙酮,回流直至紫色不再消失为止,再换成蒸馏装置,用无水氯化钙干燥,从中蒸出丙酮(收集55~56℃馏份)。
(2)N-甲基咪唑的重蒸:加入氯化钙干燥剂,减压蒸馏出N-甲基咪唑。
(3) 硝酸银溶液的配制:在避光条件下,称量1.0192g的AgNO3,用去离子水溶解,然后稀释至100mL,得浓度为6.00×10-3mol/L的溶液,于棕色瓶中保存,备用。
(4) 以下试剂未加处理直接使用:甲醇(分析纯),乙醇(分析纯),乙腈(分析纯),四氯化碳(分析纯),乙醚(分析纯),氯仿(分析纯),二氯甲烷(分析纯),丙酮(分析纯),乙酸乙酯(分析纯),氯代正丁烷(分析纯),乙酸乙酯(分析纯), 1,1,1-三氯乙烷(分析纯),氟硼酸银(分析纯),六氟磷酸铵(分析纯)。
(5)仪器:50mL 圆底烧瓶、磁力搅拌器、恒压滴液漏斗、球型回流冷凝管、旋转蒸发仪、恒温槽、循环水多用真空泵、电热真空干燥箱、超声波清洗器、UV-2010型紫外可见光分光光度计(UV)、红外光谱仪(IR)、WRS-1B数字熔点仪、DDS-11A型电导仪、Varian Mercury VX-300M型核磁共振仪。
4 实验步骤
4.1 1-甲基-3-丁基咪唑溴盐([BMIm]Br)的制备
在50mL 圆底烧瓶中加入6.0g(0.072mol)1-甲基咪唑,加入20mL 1,1,1-三氯乙烷做溶剂,在磁力搅拌下,用恒压滴液漏斗缓慢滴加正溴丁烷10.2g(0.072mol),约40min滴完,溶液变浑浊,将滴液漏斗撤下,换上球型回流冷凝管,加热回流2h,反应完毕。用旋转蒸发仪将1,1,1-三氯乙烷蒸出,得到1-甲基-3-丁基咪唑的溴盐,为淡黄色黏稠状液体。称量,计算产率。
4.2 1-甲基-3-丁基咪唑氟硼酸盐([BMIm]BF4)的制备
在50mL圆底烧瓶中加入4.5g(0.02mol)1-甲基-3-丁基咪唑溴盐、3.9g(0.038mol)氟硼酸银和10mL甲醇,在磁力搅拌下,进行阴离子交换,室温反应2~3h。反应完毕后,低温滤去无机物溴化银,用旋转蒸发仪将甲醇蒸出,得到1-甲基-3-丁基咪唑氟硼酸盐,为无色或淡黄色液体。称量,计算产率。
4.3 1-甲基-3-丁基咪唑氟磷酸盐([BMIm]PF6)的制备
在50mL圆底烧瓶中加入4.5g(0.02mol)1-甲基-3-丁基咪唑溴盐、3.3g(0.02mol)氟磷酸铵和10mL水,在磁力搅拌下,进行阴离子交换,在室温下搅拌反应1h。反应液分为两相,倾出轻相,并反复水洗重相,直到洗涤水(去离子水)中用AgNO3滴定无沉淀物生成。分液后,重相置于真空干燥箱中,在80℃干燥至无失重,得无色黏稠液体。称量,计算产率。
4.4 实验注意事项
(1) 要注意控制搅拌速度和滴加速度,使两种原料缓慢混合均匀。
(2) 滴完后,迅速换上球型冷凝管回流,1,1,1-三氯乙烷的沸点为73~76 ℃,应控制回流速度不宜过快。
(3) 将旋转蒸发仪的水浴温度缓慢上升至80℃,0.1MPa下旋蒸40min,将1,1,1-三氯乙烷完全蒸出。
(4) 得到的离子液体为红棕色黏稠状液体,可以不经处理直接作为催化剂和溶剂应用于有机化合物的合成。
(5) 阴离子交换也可采用氟硼酸铵,反应过程需要2天左右;溴化银为贵金属盐,需要回收。
5 性质表征
5.1 纯度分析
5.1.1 中间体[BMIm]Br的纯度分析
由于在N-烷基咪唑与原料氯代正丁烷反应生成离子液体中间体[BMIm]Br的体系中,只有目标产物离子液体中间体[BMIm]Br含有游离的Br-,所以可以用硝酸银溶液检测产物中的Br浓度,进而得到产物的纯度。
5.1.2 离子液体[BMIm]BF4与[BMIm]PF6的纯度分析
在溶剂丙酮中,离子液体中间体[BMIm]Br与含有目标阴离子的盐(AgBF4、NH4PF6)通过置换反应而合成离子液体,此反应条件温和,无其他副反应。将产物AgBr、NH4Br分离后,最终目标产物离子液体可能还含有未反应的原料[BMIm]Br和无机盐,所以可以用硝酸银溶液来滴定离子液体中的Brˉ,以此检测离子液体的纯度。对于离子液体[BMIm]BF4,可直接滴定其水溶液得到离子液体的纯度;对于离子液体[BMIm]PF6,可滴定洗涤离子液体的去离子水,观察是否有絮状沉淀产生,从而检测离子液体的纯度。
5.2 离子液体的结构表征与性能研究的方法及条件
采用紫外、红外、核磁共振光谱来表征所合成的化合物的结构。所有样品在进行测定前都经过干燥处理。紫外谱图由日立UV-2010型紫外可见分光光度计绘出,采用甲醇为溶剂,将样品溶解后,在1cm石英比色皿中进行测试,扫描波长范围200~700nm。红外谱图由PE Spectrum one B型红外光谱仪给出。采用KBr压片法制备试样,测定波数范围4000~400cm-1,用于确定化合物的官能团。采用红外光谱对离子液体中的咪唑环、烷基、阴离子等官能团进行表征。核磁共振谱图由Varian Mercury VX-300M型核磁共振仪给出,以D2O、DMSO-D6为溶剂,通过谱图中吸收峰的组数、化学位移值以及峰面积的积分曲线,确定分子中氢原子的种类和含量,从而确定离子液体的结构。取少量合成的离子液体,在室温下测定其24h内的吸水性;测定离子液体在部分溶剂中的溶解性及部分溶质在离子液体中的溶解性。摩尔电导率由上海电磁仪器有限公司的DDS-11A型电导仪测定。
5.2.1 紫外光谱解析
在溶剂有好的溶解性并保证较高透过率的条件下,离子液体更适合紫外可见光测量。溶剂不仅起到溶解离子液体作用,同时减少了这些低黏度高导电性离子的聚合。实验中以甲醇作为溶剂,配制样品溶液浓度的体积分数为10%,在25℃分别测定[BMIm]Br、[BMIm]BF4、[BMIm]PF6样品溶液的紫外吸收光谱。结果表明3个样品在210nm出现吸收峰,其中[BMIm]PF6的吸收峰最强。[BMIm]Br在250nm透过率迅速增加,[BMIm]BF4和[BMIm]PF6的透过率在240nm迅速增加,都有一个明显的剪切点(cut off point),并且随着氯化物浓度的增加,剪切点有向短波迁移的趋势。这被认为是阳离子与阴离子发生了交互作用。
5.2.2 红外光谱解析
5.2.3 核磁谱图解析
分别以D2O和DMSO-D6为溶剂,对[BMIm]Br、[BMIm]BF4和[BMIm]PF6进行了核磁共振分析,产物的结构得到了进一步证实。
5.2.4 吸水性实验
在室温下,取少量[BMIm]Br、[BMIm]BF4、[BMIm]PF6,放入烧杯中,使其在空气中尽量铺展,间隔一段时间称重。结果表明[BMIm]Br质量随时间增加很明显,24h后增重超过10%,[BMIm]BF4质量随时间增加不是很明显,24h后增重2.5%,[BMIm]PF6几乎不增重。这说明室温下[BMIm]BF4在空气中放置具有一定的吸水性,而[BMIm]PF6在空气中放置几乎不吸水。
5.2.5 溶解性实验
取少量[BMIm]BF4、[BMIm]PF6于试管中,加入不同的溶剂和不同物质,观察现象。结果可以看出,[BMIm]BF4、[BMIm]PF6均可以与极性溶剂混溶,而不能与一些非极性或极性小的溶剂混溶。无机盐一般不易溶于N-烷基咪唑类的离子液体中。通过溶解性实验,可使学生了解离子液体对一些有机溶剂和无机盐的溶解性。
5.2.6 电导率测定
用DD11A型电导率仪,电极为DSJ-10型铂黑电极,测定了离子液体在25℃下的电导率,[BMIm]BF4、[BMIm]PF6的电导率分别为0.174S/m(文献值[5]:0.173S/m)、0.148S/m(文献值[5]:0.146S/m)。从电导率测定结果来看,这两种离子液体的电导率数量级均远大于H2O,只比浓H2SO4小一个数量级,说明二者在所测定的温度下均以离子形式存在。
5.2.7 黏度测定
6 思考和讨论
① 何为离子液体?在有机合成中有哪些应用?
② 与常见的有机溶剂相比,离子液体有什么优势?
③ 阴离子交换反应后如何判断产物纯度,怎样才能使反应更加完全?
参 考 文 献
[1] 邓友全.离子液体——性质、制备与应用.北京:中国石化出版社,2006
[2] 张锁江,吕兴梅.离子液体——从基础研究到工业应用.北京:科学出版社,2006
[3] Welton T.ChemRev,1999,99:2071
[4] 乐长高,谢宗波.离子液体的合成及其在有机合成中的应用.北京:科学普及出版社,2010
[5] 李汝雄.绿色溶剂离子液体的合成与应用.北京:化学工业出版社,2005
[6] Wasserscheid P,Welton T.Ionic Liquids in Synthesis.2nd ed.Weinheim:WILEY-VCH Verlags GmbH & Co,2008
