外源性野生型p53基因对sw1990细胞调控基因表达的影响
2011-09-18朱春晖吕农华
朱春晖,谢 勇,吕农华
南昌大学第一附属医院消化研究所南昌330006
(2010-09-19收稿 责任编辑 赵秋民)
随着生活水平的提高和饮食结构的改变,我国胰腺癌发病率逐年上升,3 a生存率不足10%,5 a生存率低于5%[1]。p53作为基因组卫士,是目前已知的与肿瘤相关性最高的抑癌基因。2000年首次提出了 p53 基因 网 络 的概 念[2],p21waf1/cip1、bax、mdm2、puma及pten是该基因网络中的关键基因,它们除了发挥各自的功能外,同时相互作用以调节细胞的正常生理活动。作者通过将野生型p53质粒导入胰腺癌sw1990细胞中,观测细胞内调控基因的mRNA及蛋白表达情况,探讨利用野生型p53质粒治疗胰腺癌的可能性及其可能机制。
1 材料与方法
1.1 材料 人正常胰腺组织6例,为江西省肿瘤医院手术标本。获取的每例标本快速置于冰上称重,切割成100 mg左右的组织块,分装于液氮罐中保存,并送病理活检,所有研究对象均签署知情同意书。胰腺癌sw1990细胞株由上海第二军医大学长海医院屠振兴教授惠赠。重组质粒p53-GFP为美国印第安纳大学卢华教授惠赠。LipofectamineTM2000(美国Invitrogen公司),质粒小提试剂盒(Tiangen公司)、Trizol、M-MLV、dNTP(Promega 公司),各种抗体(Santa Cruz公司),荧光试剂盒(Pierce公司),DMEM(Gibco公司),胎牛血清(杭州四季青公司),琼脂糖(Amresco公司),其余试剂为国产分析纯。
1.2 sw1990细胞培养 使用含体积分数为10%胎牛血清的DMEM培养液,置37℃、体积分数为5%CO2培养箱中孵育培养sw1990,0.5 g/L胰蛋白酶溶液消化贴壁生长的成纤维细胞并传代[3]。
1.3 sw1990细 胞 和 正 常 胰 腺 组 织 中 p53、p21waf1/cip1、bax、puma、pten 及 mdm2 mRNA 表达的RT-PCR检测 按Trizol试剂盒说明提取总RNA。PCR上下游引物序列见表1。PCR产物用20 g/L琼脂糖凝胶电泳分离检测。用 Bandscan图像分析软件进行吸光度积分值分析,以目的基因与βactin(内参照)的吸光度积分值之比作为各目的基因mRNA的相对表达量。
1.4 sw1990细胞和正常胰腺组织中 P53、BAX、PTEN及磷酸化AKT(p-AKT)蛋白表达的Western blot检测 收集细胞和组织,提取蛋白并定量[4]。样品经凝胶电泳分离,电转移后,膜封闭 1 h,加入封闭液稀释的一抗[一抗分别按1∶400(P53)、1∶400(BAX)、1∶200(PTEN)、1∶200(p-AKT)稀释],结合2 h。加封闭液稀释的二抗[山羊抗鼠lgG(按1∶1 000稀释);Actin山羊抗兔lgG(按1∶1 000稀释)],反应 1.5 h。ECL显色,胶片曝光,显影、定影,扫描,读取各条带的斑点密度值,获得目的蛋白相对表达量。
1.5 重组质粒p53-GFP转染sw1990细胞 将sw1990细胞接种于6孔细胞培养板内,每孔细胞数2×105个,加4 mL培养液培养。待细胞培养板孔内的细胞覆盖率达70%时,于转染前2 h吸出培养液,用PBS液洗涤细胞2次,每孔加入2 mL不含血清的DMEM液。分别将重组质粒p53-GFP及空白质粒pEGFP-N1溶于不含胎牛血清、不含抗生素的DMEM中,使其终浓度为25μmol/L,同时将10μL LipofectamineTM2000加入不含胎牛血清、不含抗生素的DMEM中,室温孵育5 min后将质粒溶液加入,室温孵育20~25 min后,将上述混合液分别加入各组培养孔内,2 mL/孔,轻摇混匀;空白组加入无质粒无脂质体且不含血清、不含抗生素的DMEM 2 mL,转染后6 h,除去培养液,PBS液洗2遍,各孔加含体积分数为10%胎牛血清的DMEM 2 mL/孔,继续培养24 h,在荧光显微镜下观察转染效率,并收集成功转染p53-GFP质粒并表达野生型P53的带抗性基因的sw1990(sw1990/p53)细胞进行下列实验。

表1 PCR上下游引物序列及反应条件
1.6 转染细胞中 p53、p21waf1/cip1、bax、puma、pten和mdm2 mRNA及相应蛋白的表达 具体步骤同1.3 和 1.4。
1.7 统计学处理 采用SPSS 16.0进行分析,应用两独立样本的t或t’检验比较不同组别和因素中p53、p21waf1/cip1、bax、puma、pten 和 mdm2 mRNA 和相应蛋白表达的差异,检验水准α=0.05。
2 结果
2.1 sw1990细胞与正常胰腺组织中增殖调控基因mRNA及相应蛋白的表达 见表2和表3。
2.2 稳定转染重组质粒p53-GFP的sw1990细胞及未处理细胞中增殖调控基因mRNA及相应蛋白的表达 见表4和表5。

表2 sw1990细胞与正常胰腺组织中p53、p21waf1/cip1、bax、puma、pten 和 mdm2 mRNA 的表达

表3 sw1990细胞与正常胰腺组织中 P53、BAX、PTEN、p-AKT 的表达
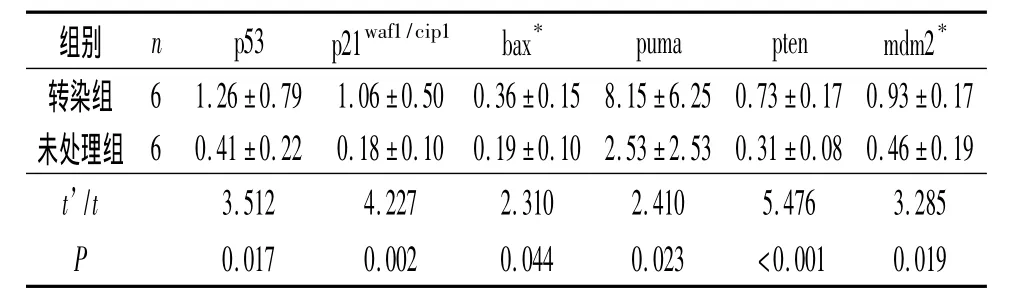
表4 转染组与未处理组p53、p21waf1/cip1、bax、puma、pten 和 mdm2 mRNA 表达的比较

表5 转染组与未处理组中P53、BAX、PTEN和p-AKT表达的比较
3 讨论
正常情况下细胞的增殖和凋亡处于一个动态平衡,当细胞受到紫外线照射、离子辐射、化疗药物、蛋白激酶抑制剂及异常细胞生长信号等作用时,增殖凋亡相关基因表达失衡,信号传导通路发生异常,细胞不受监控地异常增殖并恶性转化,导致肿瘤的发生。享有分子警察之称的p53及其下游基因p21waf1/cip1、bax、puma、pten 及 mdm2 在其中发挥着重要作用。该实验研究表明,与正常胰腺组织相比,sw1990细胞中 p53、p21waf1/cip1、bax、puma和 pten mRNA 低表达,mdm2 mRNA 高表达,与徐刚等[2]研究结果一致。
sw1990细胞稳定转染重组质粒p53-GFP后,上述基因mRNA及蛋白表达升高,说明外源性野生型p53导入后,P53聚集在细胞内并转位至核,形成有生物学活性的四聚体,P53蛋白表达水平及其与DNA的亲和力增高,并促进共激活因子的招募和组蛋白的乙酰化[4]。有活性的P53与靶基因的 P53反应元件结合,可激活包括细胞周期抑制蛋白(P21Wafl[5]、14-3-3 δ 以 及 BTG)、促 凋 亡 蛋 白(BAX[6]、APAFl[7]、PUMA[8-9]、P53AIPI[10]、PIDD[11]和NOXA[12])及DNA修复相关蛋白(核苷酸还原酶P53R)在内的下游调节蛋白,从而引起细胞周期阻滞、生长增殖抑制。
p53能直接结合 pten的上游序列形成 P53/PTEN复合物,该复合物以一种不依赖磷酸酶活性的机制增强p53的转录活性及其蛋白稳定性,从而延长P53的半衰期,使P53蛋白稳定化[13-14]。与此同时,PTEN还能通过PI3K/Akt信号通路抑制Akt的活化,从而阻止MDM2 Ser166磷酸化及核转位,并使之降解[15-16];PTEN也可直接作用于 mdm2的启动子抑制其基因转录,降低MDM2蛋白水平[17]。
总之,该实验结果显示,重组人野生型p53基因的导入可能通过调节相关基因的表达,从而抑制胰腺癌sw1990细胞的增殖,这为野生型p53基因治疗胰腺癌提供了体外实验依据。
[1] Jemal A,Siegel R,Ward E,et al.Cancer statistics,2008[J].CA Cancer JClin,2008,58(2):71
[2]徐刚,刘占举,崔静,等.p53和bcl-2在胰腺癌组织中的表达及意义[J].河南科技大学学报:医学版,2007,25(1):5
[3] Kaina B.DNA damage-triggered apoptosis:critical role of DNA repair,double strand breaks,cell proliferation and signaling[J].Biochem Pharmacol,2003,66(8):1547
[4] Hofmann TG,Moller A,Sirma H,et al.Regulation of p53 activity by its interaction with homeodomain-interacting protein kinase-2[J].Nat Cell Biol,2002,4(1):1
[5] Pan ZQ,Reardon JT,Li L,et al.Inhibition of nucleotide excision repair by the cyclin-dependent kinase inhibitor p21[J].JBiol Chem,1995,270(37):22008
[6] Cory S,Adams JM.The Bc1-2 family:regulators of the cellular life-or-death switch[J].Nat Rev Cancer,2002,2(9):647
[7] Bomer C.The Bcl-2 protein family:sensors and checkpoints for life-or-death decisions[J].Mol Immunol,2003,39(11):615
[8] Nakano K,Vousden KH.PUMA,a novel proapoptotic gene is induced by p53[J].Mol Cell,2001,7(3):683
[9] Yu J,Zhang L,Hwang PM,et al.PUMA induces the rapid apoptosis of colorectal cancer cell[J].Mol Cell,2001,7(3):673
[10]Oda K,Arakawea H,Tanaa T,et al.p53AIPI,a potential mediator of p53 dependent apoptosis,and its regulation by Ser462 phosphorylated p53[J].Cell,2000,102(6):849
[11]Shimizu S,Narita M,Tsujimoto Y.Bcl-2 family proteins regulate the release of apoptogenic cytochrome Cby the mitochondrial channel VDAC[J].Nature,1999,399(6735):483
[12]Oda E,Ohki R,Murasawa H,et al.Noxa,a BH3-only member of the Bcl-2 family and candidate mediator of p53-induced apoptosis[J].Science,2000,288(5468):1053
[13]Gericke A,Munson M,Ross AH.Regulation of the PTEN phosphatase[J].Gene,2006,347:1
[14]Weng L,Brown J,Eng C.PTEN induces apoptosis and cell cycle arrest through phosphoinositol-3-kinase/Akt-dependent and independent pathways[J].Hum Mol Genet,2001,10(3):237
[15]Dinulescu DM,Ince TA,Quade BJ,et al.Role of K-ras and Pten in the development of mouse models of endometriosis and endometrioid ovarian cancer[J].Nat Med,2005,11(1):63
[16]Maknio K,Day CP,Wang SC,et al.Upregulation of IKKα/IKKβby integrin-linked kinase is required for HER2/nueinduced NF-κB antiapoptotic pathway[J].Oncogene,2004,23(21):3883
[17]Weng LP,Brown JL,Baker KM,et al.PTEN blocks insulinmediate EST-2 phosphorylation through MAP kinase,independently of the phosphoinositide 3-kinase pathway[J].Hum Mol Genet,2002,11(15):1687
