两种多囊卵巢综合征大鼠模型造模方法的比较*
2011-09-18贾莉婷刘艳丽马葆靖李肖甫赵德华张秋菊郭瑞莹宋晓妍荣守华
贾莉婷,刘艳丽,马葆靖,张 展,李肖甫,赵德华,张秋菊,郭瑞莹,宋晓妍,荣守华
1)郑州大学第三附属医院检验科 郑州450052 2)郑州大学第三附属医院保健部郑州450052
(2010-12-27收稿 责任编辑 赵秋民)
多囊卵巢综合征(polycystic ovary syndrome,PCOS)是育龄期妇女常见的内分泌疾病,其发病率在育龄妇女中为5% ~10%[1],发病机制至今尚未明确。现多采用动物模型[2-4]研究PCOS的病因、发病机制及临床诊断和治疗策略,但模型选择的正确与否直接影响研究结果。来曲唑建模法和脱氢表雄酮(dehydroepiandrosterone,DHEA)建模法是国内外使用较多的2种造模方法:来曲唑通过抑制雄激素向雌激素转化的限速酶芳香化酶的活性,导致体内雄激素的增高,动物选用6周龄SD雌鼠(相当于女性育龄期);DHEA是胆固醇合成雄激素的中间产物,直接导致雄激素的水平增高,动物选用23日龄SD雌鼠(相当于女性青春前期)。目前对PCOS模型的评价多限于动情周期、卵巢形态和组织学以及血清激素水平等几个方面。作者采用来曲唑建模法和DHEA建模法,在上述评价指标基础上,加入雄激素受体(androgen receptor,AR)和黄体生成素受体(luteinizing hormone receptor,LHR)这2个指标,评价2种模型的差异。
1 材料与方法
1.1 实验动物 分别选用6周龄和23日龄清洁级SD雌性大鼠各60只,均采用随机数字表分为实验组、溶剂对照组和空白对照组,每组20只[购于河南省实验动物中心,许可证号SCXK(豫)2005-0001]。清洁级饲养,环境温度20~24℃,湿度40% ~60%,每天光照10 h,自由饮水,喂以颗粒饲料。
1.2 PCOS模型的建立
1.2.1 来曲唑法 将来曲唑溶于10 g/L羧甲基纤维素(CMC)中,实验组大鼠灌胃来曲唑1 mg/(kg·d),溶剂对照组灌胃10 g/L CMC,均于上午9时连续灌服21 d,空白对照组正常饲养。
1.2.2 DHEA法 将 DHEA溶于0.2 mL甘油中,实验组大鼠皮下注射DHEA 60 mg/(kg·d),溶剂对照组皮下注射0.2 mL甘油,均于上午10时连续皮下注射21 d,空白对照组正常饲养。
1.3 大鼠动情周期及体质量检测 每天对大鼠进行阴道涂片,巴氏染色后观察动情周期的变化;每3 d测量大鼠的体质量并记录,绘制大鼠体质量的增长变化曲线。
1.4 大鼠血清性激素,卵巢体积、相对质量及组织学检查 实验组在最后一次应用来曲唑和DHEA 24 h(并禁食12 h)后,对大鼠称量后行乙醚麻醉,快速心脏取血法致死(对照组选取在动情间期),取血清置-20℃冻存备用,应用放射免疫法测定黄体生成素(LH)、卵泡刺激素(FSH)、雌二醇(E2)、孕酮(P)和睾酮(T),试剂盒购自天津九鼎医学生物工程有限公司。取双侧卵巢,观察卵巢形态学变化、称量,用游标卡尺测量卵巢长、宽和厚度,计算卵巢体积[5];根据大鼠体质量和卵巢体质量计算卵巢相对质量[6]。一侧卵巢置于体积分数为10%甲醛溶液中固定,另一侧卵巢用PBS冲洗后-80℃冻存备用。以卵巢最大平面作为待检平面行石蜡包埋,每个石蜡块分别以4μm厚度切片2次,行HE染色。
1.5 大鼠卵巢组织中AR、LHR蛋白的检测 加入蛋白裂解液研磨大鼠卵巢组织,低温高速离心后取上清,采用考马斯亮蓝染料结合法检测蛋白浓度。100 g/L SDS-PAGE分离蛋白质,经20 V 1 h将蛋白质转移到硝酸纤维素膜上,用50 g/L脱脂奶粉封闭。AR多克隆抗体(SC-816)、LHR多克隆抗体(SC-25828)均购自美国Santa Cruz公司,抗体均按1∶200稀释;内参为β-actin(购自北京博奥森生物公司),抗体按1∶400稀释。经增强化学发光法显影,用Biosens Digital System分析目的条带灰度值,以目的条带与β-actin灰度值比值作为目的蛋白的相对表达量。
1.6 大鼠卵巢组织中AR、LHR蛋白的定位 应用SP法检测卵巢组织中AR、LHR蛋白的定位表达,一抗同免疫印迹法,抗体按1∶100稀释。
1.7 统计学处理 采用SPSS 16.0进行分析,应用单因素方差分析和LSD-t检验分析各组大鼠实验前后体质量增加量、卵巢体积、卵巢相对质量、血清性激素水平、AR和LHR蛋白相对表达量的差异,检验水准 α =0.05。
2 结果
2.1 PCOS模型大鼠动情周期观察 来曲唑造模的实验组大鼠在灌胃12 d后全部失去规律性动情周期,阴道涂片的细胞学特征为大量的白细胞,均处于动情间期时相;DHEA造模的实验组大鼠动情周期变化极不规律;各对照组均保持规律的动情周期。
2.2 各组大鼠实验前后体质量增加量、卵巢体积和卵巢相对质量比较 见表1。
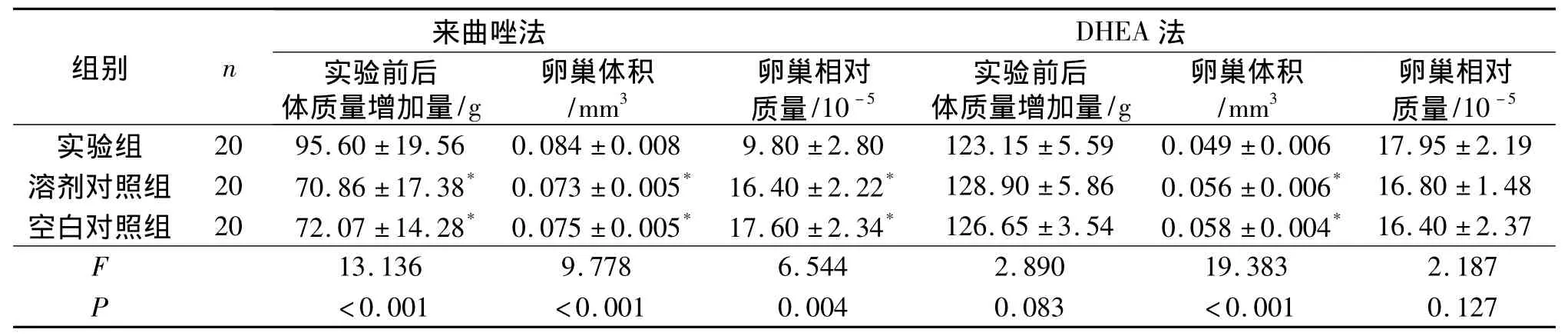
表1 各组大鼠实验前后体质量增加量、卵巢体积和卵巢相对质量比较
2.3 各组大鼠卵巢形态学、组织学观察 来曲唑造模的实验组大鼠卵巢表面较苍白、包膜增厚,可见大量囊状卵泡形成;DHEA造模的实验组大鼠卵巢表面苍白,囊状卵泡凸起不明显;各对照组大鼠卵巢红润。来曲唑造模的实验组大鼠卵巢颗粒细胞层减至2~3层,间质细胞增生明显,卵泡内卵母细胞多数缺失,稀见排卵前卵泡和黄体,可见大量囊状扩张卵泡;DHEA造模的实验组卵巢颗粒细胞层减少的程度没有来曲唑造模的实验组减少的显著,白膜增厚和间质增生不明显;各对照组卵巢颗粒细胞呈多层,多为8~9层。见图1。
2.4 各组大鼠血清性激素水平比较 见表2、3。
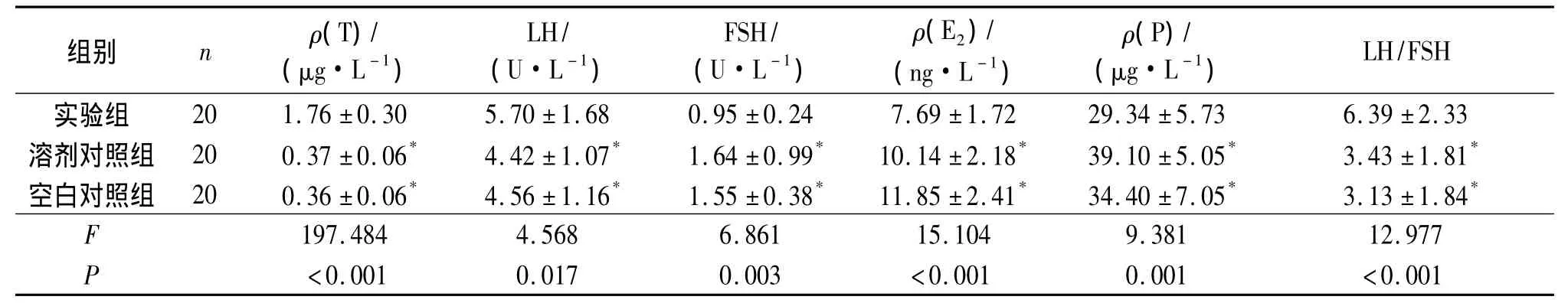
表2 来曲唑造模各组大鼠血清性激素水平比较

表3 DHEA造模各组大鼠血清性激素水平比较
2.5 大鼠卵巢组织中AR、LHR的表达情况 见图2、3及表4。AR主要表达于卵巢颗粒细胞的胞核,呈棕黄色着色,2种造核方法的实验组表达量高于对照组。LHR表达于卵巢颗粒细胞的胞质及内、外膜层细胞的胞质,来曲唑造模的实验组表达量高于对照组,DHEA造模的实验组表达量略低于对照组。

图2 各组大鼠卵巢组织AR(A)、LHR(B)的表达 (SP,×400)1:来曲唑造模的实验组大鼠;2:DHEA造模的实验组大鼠;3:对照组大鼠。

图3 来曲唑法(上)和DHEA法(下)大鼠卵巢中AR、LHR表达的Western blot检测A:实验组;B:溶剂对照组;C:空白对照组。

表4 各组大鼠卵巢组织中AR、LHR蛋白相对表达量比较
3 讨论
依据PCOS的诊断标准[3],结合该研究结果,从以下几方面比较2种模型:来曲唑造模的实验组每次所测定体质量均大于对照组,且实验组体质量增长量明显高于对照组,这与PCOS患者多表现肥胖相符;DHEA造模的实验组大鼠体质量增长量稍低于对照组,该法不适合于研究肥胖患者。2种方法造模的实验组大鼠失去规律的动情周期,提示无排卵。2种造模方法大鼠卵巢均发生了多囊状改变,来曲唑造模的实验组大鼠卵巢形态学和组织学变化较DHEA造模的实验组大鼠更为典型,更适合于卵巢形态学的研究。
来曲唑和DHEA均可诱导一种高雄激素的状态。来曲唑造模的实验组大鼠P水平下降,提示不排卵,和人PCOS一致[7]。在PCOS中,血清LH升高是由P或E2所介导的LH负反馈[8]。来曲唑通过减少下丘脑-垂体轴E2的产生增强了LH分泌,是一种双重效应。PCOS患者血清LH、LH/FSH异常升高,促进卵泡内膜细胞以及间质细胞合成过多雄激素,导致窦卵泡募集亢进,最后卵泡发育停滞,来曲唑造模的实验组充分证明了这点。但来曲唑造模的实验组大鼠E2水平下降,不适合研究雌激素水平较高的PCOS;而DHEA造模的实验组大鼠血清E2水平明显增高,适合于雌激素水平较高的PCOS患者研究。
AR是一种配体依赖性的反式转录调节蛋白。PCOS病理状态下,体内的高雄激素环境可引起胞质内AR的核内输入,使核内AR水平提高,与免疫组化结果一致。AR一旦被雄激素激活便能识别靶因子上专一的DNA序列并与之结合,从而调控该基因转录,表达新的蛋白质,最终使得细胞的功能发生改变,靶器官卵巢则出现多囊状卵泡的形成。2种造模方法的实验组大鼠AR均高水平,表明高水平的T和AR结合后参与了多囊状卵泡的形成。文献[9-10]通过给雌性大鼠持续应用来曲唑,导致大鼠出现排卵障碍、卵巢多囊样变,卵巢中AR表达量增加,与该实验结果相符。血清中LH与卵泡膜细胞LHR结合,激活腺苷酸环化酶系统而刺激甾体激素的合成,参与女性生殖过程,如受精卵着床、性腺发育及功能活动的调节。PCOS患者血清LH升高可通过诱导卵泡膜细胞表达LHR增加,LHR在PCOS患者卵泡颗粒细胞中表达增加可认为导致颗粒细胞发生分化、卵泡发育停滞,持续性无排卵的一个指标。Jakimiuk等[11]报道PCOS患者的颗粒细胞和卵泡膜细胞中LHR mRNA的高表达,与作者的实验结果相一致。总之,两模型结果表明大鼠卵巢中AR、LHR参与了多囊状卵巢形成,可作为PCOS模型蛋白质水平的评价指标。
综上所述,无论从传统的动情周期、解剖学、组织学、血清学等方面,还是从增加的蛋白质水平比较,来曲唑造模法模型大鼠病理生理特征更接近于人类PCOS特征,是研究该病较为理想的动物模型,且较DHEA皮下注射法对大鼠创伤性小,操作简便。
[1] Yavasoglu I,Kucuk M,Coskun A,et al.Polycystic ovary syndrome and prolactinoma association[J].Inter Med,2009,48(8):611
[2]胡颜霞,张展,贾莉婷,等.来曲唑诱导多囊卵巢综合征大鼠模型的研究[J].中国妇幼保健,2006,21(7):957
[3]任伟慧,贾莉婷,张展,等.来曲唑诱导的多囊卵巢综合征大鼠卵巢组织中角质细胞生长因子的表达[J].郑州大学学报:医学版,2008,43(3):532
[4]郭洪胜,安长新,陈东.来曲唑诱导多囊卵巢综合征大鼠卵巢组织中FSH受体的表达及其意义[J].吉林大学学报:医学版,2009,35(6):1048
[5] Aytan H,Caglar P,Uygur D,et al.Effect of the immunomodulator leflunomide on the induction of endometriosis in an experimental rat model[J].Fertil Steril,2007,87(3):698
[6] Kafali H,Iriadam M,Ozardali I,et al.Letrozole-induced polycystic ovaries in the rat:a new model for cystic ovarian disease[J].Arch Med Res,2004,35(2):103
[7] Meenakumari KJ,Agarwal S,Krishna A,et al.Effects of metformin treatment on luteal phase progesterone concentration in polycystic ovary syndrome[J].Braz J Med Biol Res,2004,37(11):1637
[8] Abbott DH,Dumesic DA,Franks S.Developmental origin of polycystic ovary syndrome-a hypothesis[J].J Endocrinol,2002,174(1):1
[9] Manneras L,Cajander S,Holmang A,et al.A new rat model exhibiting both ovarian and metabolic characteristics of polycystic ovary syndrome[J].Endocrinology,2007,148(8):3781
[10]Zurvarra FM,Salvetti NR,Mason JI,et al.Disruption in the expression and immunolocalisation of steroid receptors and steroidogenic enzymes in letrozole-induced polycystic ovaries in rat[J].Reprod Fertil Dev,2009,21(7):827
[11]Jakimiuk AJ,Weitsman SR,Navab A,et al.Luteinizing hormone receptor,steroidogenesis acute regulatory protein,and steroidogenic enzyme messenger ribonucleic acids are overexpressed in thecal and granulosa cells from polycystic ovaries[J].JClin Endocrinol Metab,2001,86(3):1318
