磁性可见光催化剂BiVO4/Fe3O4的制备及催化活性
2011-09-15威王姣朱毅郭佳杨骏张渊明
晏 威王 姣朱 毅郭 佳杨 骏张渊明*,
(1暨南大学化学系,广州 510632)
(2暨南大学生态学系,广州 510632)
磁性可见光催化剂BiVO4/Fe3O4的制备及催化活性
晏 威1王 姣1朱 毅1郭 佳2杨 骏1张渊明*,1
(1暨南大学化学系,广州 510632)
(2暨南大学生态学系,广州 510632)
采用超声法将磁基体Fe3O4和BiVO4复合,制备了易于固液分离的磁性可见光催化剂BiVO4/Fe3O4。采用X射线衍射(XRD)、傅立叶转换红外光谱(FTIR)、紫外-可见漫反射光谱(DRS)、透射电子显微镜(TEM)和磁学性质测量系统(MPMS)对产物进行了表征,并以亚甲基蓝为目标降解物,考察了BiVO4/Fe3O4的可见光催化活性。当BiVO4与Fe3O4质量比为5∶1时,BiVO4/Fe3O4的催化活性最高,反应经过5 h,对亚甲基蓝的降解率达到92.0%,而单独使用BiVO4为催化剂,降解率仅为72.5%。这表明Fe3O4不仅起到磁基体的作用,还起到助催化剂的作用。BiVO4/Fe3O4在外加磁场的作用下很容易被分离,撤消外加磁场后,通过搅拌又可重新分散。BiVO4/Fe3O43次回收后的降解率仍高于80%。
BiVO4/Fe3O4;磁性分离;超声法;可见光催化剂
近年来,半导体光催化技术由于在去除空气中的有毒气体和降解水中有机污染物等方面有非常广阔的应用前景,而逐渐引起了广泛的关注[1]。至今,已研究过的光催化剂中,TiO2因具有优良的光电性能、光催化活性、化学稳定性、无毒且价格低廉等优点,而最为常用[2-3]。但从实际来看,一个具有实际应用价值的半导体光催化剂不仅应具有化学稳定性、光照稳定性、选择性和高效性,还必须具有较宽的光谱响应和光匹配性能。TiO2的光化学性能虽然较稳定,但其带隙较大(3.2 eV)[4],只对仅占太阳能4%的紫外光有响应,对占太阳能43%的可见光没有响应,这就大大限制了TiO2的实际应用。因此,研究窄带隙能对可见光响应的催化剂成为人们关注的焦点[5]。
目前,开发窄带隙可见光催化剂主要有两种思路。一种是通过掺金属离子或非金属离子对TiO2进行修饰改性,如Asahi等[6]和Khan等[7-8]报道的掺氮TiO2(TiO2-xNx)和掺碳TiO2(TiO2-xCx),可以减小带隙宽度,将光响应范围拓展至可见光区。然而,掺杂容易破坏晶体结构,引入大量缺陷和复合中心,并且产生不连续的杂质能级,阻碍光生空穴的迁移,从而导致整体的光催化活性降低[9-10]。另一种思路是设计新型的未掺杂可见光响应单相半导体光催化剂,如:BiVO4、Bi2WO6和 CaBi2O4等。其中,BiVO4是一种稳定的半导体光催化剂,禁带宽度相对较窄,接近太阳光谱中心,在可见光下降解有机污染物的催化活性较高[11-15],因此,作为一种理想的可见光催化剂而得到广泛研究。
然而,BiVO4作为一种多相催化剂,在反应完成后难以从反应体系中分离,易流失且分离成本较高[16]。为了解决这个问题,研究者们将BiVO4负载在玻璃纤维、硅胶等不同载体上,制备出了很多负载型复合BiVO4光催化剂。虽然负载化解决了回收的难题,但是其光催化效率却明显降低[17]。如何制备容易回收且具有良好光催化活性的BiVO4可见光催化剂成为了该领域的一个挑战。
受最近一些将TiO2负载在磁性颗粒上的报道的启发[18-20],我们采用超声法将Fe3O4与BiVO4复合,制备了BiVO4/Fe3O4复合磁性光催化材料,并以亚甲基蓝为目标降解物,考察了BiVO4/Fe3O4的可见光催化活性和重复使用效率。用这种方法制备的BiVO4/Fe3O4催化剂既容易回收又保持着高的催化活性:磁性使其能够通过施加外磁场作用来回收催化剂,而不需要进一步的处理;而适量的Fe3O4不仅可作为复合催化剂的磁基体,而且还可和许多过渡金属氧化物一样,作为电子捕获剂抑制电子空穴对复合,提高光催化活性,起助催化剂的作用;同时,所采用的超声法能增大颗粒的比表面,有利于提高光催化活性。
1 实验部分
1.1 试剂和仪器
所有试剂五水硝酸铋(Bi(NO3)3·5H2O),偏钒酸铵(NH4VO3),硝酸(HNO3),氢氧化钠(NaOH),铁粉(Fe),氯化铁(FeCl3),氨水(NH3·H2O),亚甲基蓝(MB)和无水乙醇(C2H5OH)均为分析纯,且均购于上海国药集团化学试剂有限公司。实验用水为蒸馏水。
样品的物相表征采用X射线衍射仪(MSALXD2,Cu靶 Kα 辐射,λ=0.154 18 nm,弯晶石墨单色器,射线管电压 36 kV,电流 20 mA,扫描范围 2θ=10°~80°,扫描速率为 8°·min-1,步宽为 0.02°)测定。样品的形貌和结构通过透射电子显微镜(PHILIPS TECNAI-10,加速电压100 kV)来表征。不同样品的红外光谱测定采用傅立叶变换红外光谱仪(NICOLET 6700,光谱纯KBr压片,扫描范围为2 000~400 cm-1)。采用紫外-可见漫反射光谱仪(SHIMADZU UV25,对比基准物为BaSO4,测量范围200~800 nm)测定样品的吸收光谱。BET比表面积的确定采用比表面测定仪(MICROMETRICS TRISTRA 3000,低温氮气吸附,吹扫气体为氦气)。样品的磁性性能通过磁性测量系统(QUANTUM DESIGN XL-7,超导磁体,液氮控温,射频SQUID)来表征。
1.2 BiVO4/Fe3O4的制备
1.2.1 磁基体 Fe3O4的制备
将Fe粉和FeCl3以质量比为1∶8的比例溶于蒸馏水中,在强烈的磁力搅拌下,将1.5 mol·L-1的NH3·H2O缓慢滴加到上述铁溶液中,水浴温度控制在80℃,当pH值升高至6~7时,铁盐水解产生大量的Fe3O4晶体,继续滴加NH3·H2O至pH值达到9~10,直至铁盐水解趋于完全,90℃水浴加热1 h,磁力沉降,蒸馏水洗涤不溶物4次,真空干燥。
1.2.2 BiVO4的制备
将 10.0 mmol NH4VO3和10.0 mmol Bi(NO3)3·5H2O分别溶于20.0 mL 2.0 mol·L-1的NaOH 和20.0 mL 4.0 mol·L-1的 HNO3溶液中,混合两种溶液后形成橘黄色溶液,用2.0 mol·L-1的NaOH溶液调节pH值至4,磁力搅拌0.5 h。转移所得的前驱体溶液于100 mL的聚四氟乙烯不锈钢高压釜中,180℃下加热2 h,冷却至室温,离心分离,去离子水洗,无水乙醇洗几次,得到亮黄色沉淀,80℃下干燥4 h。所制得的BiVO4的产率是96%。
1.2.3 磁性光催化剂BiVO4/Fe3O4的制备
将不同质量比的BiVO4和Fe3O4混合,研磨,分散于含有10 mL无水乙醇的40 mL去离子水中,室温下搅拌悬浮液30 min,超声1 h,离心分离,用去离子水和无水乙醇洗几次,60℃下干燥。
1.3 光催化活性的测定
选择亚甲基蓝作为模拟污染物,来测定BiVO4/Fe3O4混合粒子的光催化活性。室温下,往温度控制的玻璃夹层反应器中加入100 mL 10 mg·L-1的亚甲基蓝溶液和0.1 g复合光催化剂BiVO4/Fe3O4,避光、搅拌30 min,以确保催化剂达到吸附平衡,然后按一定的流速通入空气,磁力搅拌使催化剂悬浮。采用250 W反射镝灯为光源,距15 cm照射反应体系,使用400 nm滤光片滤掉紫外光。每隔一定时间,磁力沉降,取上层清液,在最大吸收波长664 nm处测定其吸光度。
在低浓度范围内吸光度A与浓度C之间有很好的线性关系,且遵循朗伯-比耳定律,以降解率r来衡量亚甲基蓝的降解程度:

式中A0、A、C0和C分别是溶液的初始吸光度、降解后的吸光度、初始浓度和降解后的浓度。
2 结果与讨论
2.1 分析与表征
图1是所制样品的XRD图。其中,图1a是样品Fe3O4的XRD图,图中的特征峰表明所制备的Fe3O4是立方尖晶石相。图1b是超声60 min后的BiVO4的XRD图,图中显示,BiVO4具有光催化活性较高的单斜白钨矿结构,同时伴有四方锆石相,其特征峰与单斜白钨矿相(PDF No:14-0688)和四方锆石相(PDF No:14-0133)的特征峰保持一致。图1c~g是不同质量比的复合BiVO4/Fe3O4粒子的XRD图,BiVO4的晶相同样是单斜白钨矿相与四方锆石相的混合相,说明磁性粒子Fe3O4的引入没有影响BiVO4的晶相,并且Fe3O4的衍射峰非常弱,这可能是因为Fe3O4的结晶度较差,与BiVO4复合后被BiVO4的强峰所掩盖。

图1 Fe3O4、BiVO4和不同质量比的复合光催化剂BiVO4/Fe3O4的XRD图Fig.1 XRD pattens of Fe3O4,BiVO4and BiVO4/Fe3O4composite photocatalystwithdifferent mass ratios
样品的BET比表面和孔结构通过低温氮气吸附测定,列于表1。如表所示,BiVO4/Fe3O4系列催化剂的平均孔径大小相近,比表面随着BiVO4含量的增加而降低,并且都比纯BiVO4的比表面大。这可能是因为比表面较大的Fe3O4磁性粒子的引入和超声的作用[21-25],使得光催化剂的比表面增加。

表1 Fe3O4、BiVO4和不同质量比的BiVO4/Fe3O4的比表面及孔参数Table 1 BET surface area and pore parameters of Fe3O4,BiVO4and BiVO4/Fe3O4withdifferent mass ratios
复合催化剂的形貌和结构通过TEM来表征。图2是BiVO4/Fe3O4粒子的TEM图。BiVO4/Fe3O4粒子的形貌呈类球形,且其平均直径大约是40~60 nm。Fe3O4作为一种磁性材料,比非磁性材料的BiVO4能吸引更多的吸附电子,因此,在复合光催化剂BiVO4/Fe3O4的TEM图中,Fe3O4是深色的,而BiVO4呈亮色[26]。

图2 BiVO4/Fe3O4(5∶1)复合催化剂的TEM图Fig.2 TEM image of BiVO4/Fe3O4(5∶1)composite particle
Fe3O4粒子和BiVO4/Fe3O4复合光催化剂的磁性能通过磁性测试系统技术来表征。图3是Fe3O4粒子和BiVO4/Fe3O4复合催化剂的磁滞回线,表2是矫顽力(Hc)、饱和磁强度(Ms)与剩余磁强度(Mr)等磁性参数的值。与Fe3O4粒子相比,BiVO4/Fe3O4复合催化剂的饱和磁强度与剩余磁强度降低明显,主要是因为单位质量的样品中的Fe3O4含量减少。磁性样品的Hc值是由磁畴中磁偶极子的强度和数量决定的[27],低的Hc和Mr值表明BiVO4/Fe3O4在室温下表现出超顺磁性,因此,它们能够通过外加磁场很容易地从悬浮态体系中分离出来。同时,低的Hc值也表明,通过外加磁场从反应溶液中分离出来的BiVO4/Fe3O4不易团聚,易于重新分散在溶液中得以重复使用[28]。

图3 Fe3O4(a)和 BiVO4/Fe3O4(5∶1)(b)的磁滞回线Fig.3 Magnetization versus applied magnetic field for Fe3O4(a)and BiVO4/Fe3O4(5∶1)(b)composite photocatalyst
表2 Fe3O4和BiVO4/Fe3O4(5∶1)复合催化剂的磁性参数Table 2 Magnetic properties of Fe3O4and BiVO4/Fe3O4(5∶1)composite photocatalyst
图4是Fe3O4、BiVO4和 BiVO4/Fe3O4复合催化剂在400~2 000 cm-1波数范围内的红外吸收光谱图。图中,589 cm-1处的吸收峰是Fe3O4的特征峰,761 cm-1处的吸收峰是BiVO4的特征峰,1 630 cm-1处的吸收峰是羟基的弯曲振动特征峰。由图可知,Fe3O4和BiVO4/Fe3O4的吸收谱图中都存在-OH的弯曲振动吸收峰,且Fe3O4的-OH吸收峰更强,而纯BiVO4无-OH的弯曲振动吸收峰。这表明BiVO4/Fe3O4复合催化剂因为Fe3O4的引入而具有较高的表面-OH密度,从而有利于光催化活性的提高[29]。
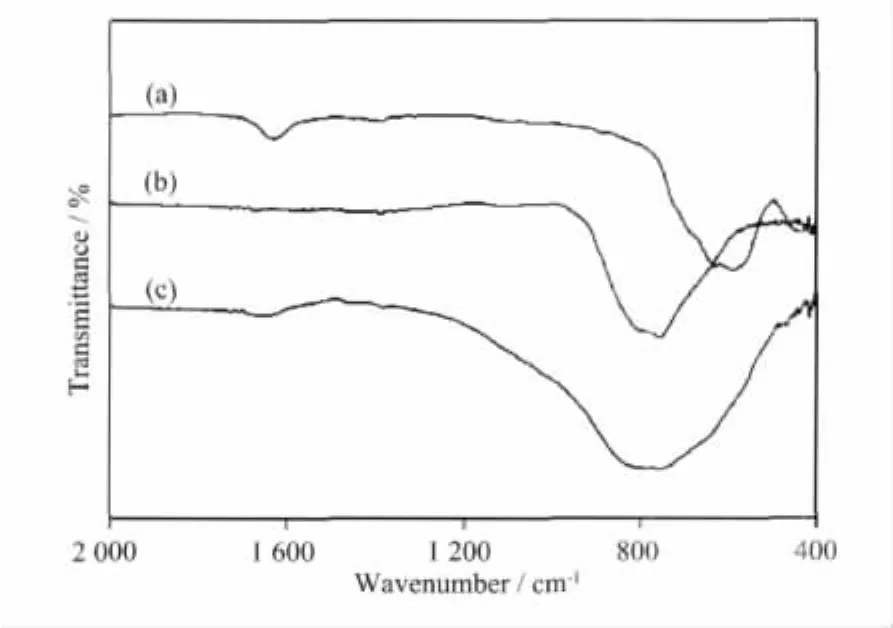
图4 Fe3O4(a)、BiVO4(b)和 BiVO4/Fe3O4(5∶1)(c)的红外谱图Fig.4 FTIR spectra of Fe3O4(a),BiVO4(b)and BiVO4/Fe3O4(5∶1)(c)
图5是Fe3O4、BiVO4和不同质量比的 BiVO4/Fe3O4可见光催化剂的紫外可见漫反射光谱图。如图5所示,Fe3O4在可见光范围有很好的吸收,BiVO4/Fe3O4的紫外吸收光谱与BiVO4相似,这表明BiVO4在BiVO4/Fe3O4复合催化剂的半导体光催化作用中起主导作用。图5还显示了,纯BiVO4在550~800 nm的范围内没有吸收,而BiVO4/Fe3O4在此范围有明显的吸收,且随着BiVO4含量的减少吸收范围扩大。这表明,吸收峰红移是由于在金属离子与BiVO4的价带和导带之间存在电荷转移跃迁所致[30]。

图5 不同样品的紫外可见漫反射光谱图Fig.5 UV-Vis DRS spectra of different samples
2.2 BiVO4/Fe3O4对亚甲基蓝的光催化降解
为了测试BiVO4/Fe3O4的光催化性能,在光催化反应器中对亚甲基蓝模拟污染物进行降解试验。图6是Fe3O4、BiVO4和不同质量比的BiVO4/Fe3O4催化剂在可见光下对亚甲基蓝的降解。不加催化剂的空白实验表明亚甲基蓝在光照5 h后,脱色率没有明显变化,这说明亚甲基蓝在可见光照射下几乎不能被光解。只有磁性粒子Fe3O4存在的条件下,亚甲基蓝几乎不能被降解(曲线a)。在BiVO4存在下,亚甲基蓝的浓度明显降低,降解率到达72.5%(曲线b)。由图可知,质量比为 5∶1,7∶1 与 9∶1 的复合催化剂的光催化活性均高于纯BiVO4,并且当BiVO4与Fe3O4的质量比为5∶1时,复合催化剂对亚甲基蓝的降解率达到最高的92.0%(曲线e)。这表明磁性粒子Fe3O4起到助催化剂的作用,并且其含量对催化剂活性也有影响。在Fe3O4的含量低于最佳量时,具有更低导带的Fe3O4能吸引光诱导电子,降低电子-空穴复合速率,从而提高光催化活性,而在高于最佳量时,Fe3O4作为电子-空穴复合中心,降低电荷分离的有效性,从而导致光催化活性降低[31]。
为研究超声的作用,我们测试了质量比为5∶1的简单混合催化剂BiVO4/Fe3O4的光催化活性。结果表明,简单混合催化剂对亚甲基蓝的降解率只有48.2%,远低于BiVO4/Fe3O4(5∶1)复合催化剂92.0%的降解率。原因是超声的独特作用增大了光催化剂的比表面,从而提高了光催化活性[21-25]。

图6 Fe3O4、BiVO4和不同质量比的BiVO4/Fe3O4光催化剂对亚甲基蓝的降解Fig.6 Photocatalytic degradation of MB over Fe3O4,BiVO4and BiVO4/Fe3O4photocatalyst with different mass ratios
2.3 BiVO4/Fe3O4的分离与回收
图7是用外加磁场分离光催化剂BiVO4/Fe3O4的过程。磁性光催化剂BiVO4/Fe3O4悬浮液的浓度是1.0 g·L-1,在磁铁的作用下,它几乎可以完全沉积,撤掉磁铁后,它又可以重新分散在溶液中。这表明,BiVO4/Fe3O4非常容易分离回收和重复使用。

图7 BiVO4/Fe3O4(5∶1)的分离效果Fig.7 Separation of BiVO4/Fe3O4(5∶1)particles
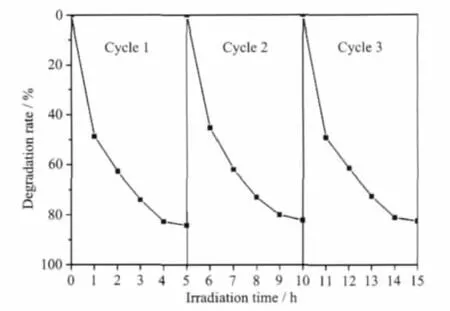
图8 循环使用的BiVO4/Fe3O4复合催化剂对亚甲基蓝的降解率Fig.8 Degration rate of MB with recycled composite catalyst BiVO4/Fe3O4
图8是循环使用的BiVO4/Fe3O4对MB的降解。由图可知,重复使用的BiVO4/Fe3O4的光催化活性没有明显变化,连续使用3次的降解率仍高于80%。这表明,通过磁性分离得到的BiVO4/Fe3O4光催化剂不仅稳定性好,而且还可以保持较高的催化活性。
3 结 论
通过超声法制备了一种易于固液分离的磁性可见光催化剂BiVO4/Fe3O4。这种磁性光催化剂具有很高的光催化活性和较好的重复使用效果。Fe3O4不仅起到磁基体的作用,还起到助催化剂的作用。光催化剂BiVO4/Fe3O4因具有易回收和高催化活性2个特点,在有机污染物光降解中将有应用价值。
[1]Xu S H,Feng D L,Li D X,et al.Chin.J.Chem.,2008,26(5):842-846
[2]Xu J J,Ao Y H,Fu D G,et al.J.Phys.Chem.Solids,2008,69(8):1980-1984
[3]Li G S,Zhang D Q,Yu J C.Chem.Mater.,2008,20(12):3983-3992
[4]Ge L.Mater.Lett.,2008,62(6):926-928
[5]Zhou L,Wang W Z,Liu S W,et al.J.Mol.Catal.A:Chem.,2006,252(1):120-124
[6]Asahi R,Morikawa T,Ohwaki T,et al.Science,2001,293(5528):269-271
[7]Sakthivel S,Kisch H.Angew.Chem.Int.Ed.,2003,42(41):4908-4911
[8]Khan S,Al-Shahry M,Ingler W B.Science,2002,297(5590):2243-2245
[9]Zhang X,Ai Z H,Jia F L,et al.Mater.Chem.Phys.,2007,103(1):162-167
[10]Kudo A,Nagayoshi H.Catal.Lett.,1998,52(2):109-111
[11]Sun S M,Wang W Z,Zhou L,et al.Ind.Eng.Chem.Res.,2009,48(4):1735-1739
[12]Zhang L,Chen D R,Jiao X L.J.Phys.Chem.B,2006,110(6):2668-2673
[13]Jiang H Q,Endo H,Natori H,et al.Mater.Res.Bull.,2009,44(4):700-706
[14]Chatchai P,Murakami Y,Kishioka S Y,et al.Electrochim.Acta,2009,54(4):1147-1152
[15]Ke D D,Peng T Y,Ma L,et al.Appl.Catal.A:Gen.,2008,350(1):111-117
[16]Beydoun D,Amal R.J.Phys.Chem.B,2000,104(18):4387-4396
[17]LI Xin-Jun(李新军),LI Fang-Bo(李芳柏),GU Guo-Bang(古国榜),et al.J.Nonferr.Metal.Soc.(Zhongguo Youse Jinshu Xuebao),2001,11(6):971-976
[18]Ao Y H,Xu J J,Fu D G,et al.Nanotechnology,2008,19(2):405-604
[19]Chung Y S,Park S B,Kang D W.Mater.Chem.Phys.,2004,86(2):375-381
[20]Chen F,Xie Y D,Zhao J C,et al.Chemosphere,2001,44(5):1159-1168
[21]Ho W K,Yu J C.J.Mol.Catal.A-Chem.,2006,247(2):268-274
[22]Pol V G,Motiei M,Gedanken A,et al.Chem.Mater.,2003,15(6):1378-1384
[23]Pol V G,Reisfeld R,Gedanken A.Chem.Mater.,2002,14(9):3920-3924
[24]Gedanken A,Tang X H,Wang Y Q.Chem.Eur.J.,2001,7(21):4546-4552
[25]Zhu J J,Koltypin Y,Gedanken A.Chem.Mater.,2000,12(1):73-78
[26]Fu W Y,Yang H B,Li M H,et al.Mater.Lett.,2006,60(23):2723-2727
[27]Sun X M,Li Y D.Angew.Chem.Int.Ed.,2004,43(6):597-601
[28]Ao Y H,Xu J J,Fu D G,et al.Sep.Purif.Technol.,2008,61(3):436-441
[29]Martra G,Coluccia S,Marchese L,et al.Catal.Today,1999,53(4):695-702
[30]Li F B,Li X Z,Hou M F,et al.Appl.Catal.A:Gen.,2005,285(2):181-189
[31]CHEN Jin-Yuan(陈金媛),PENG Tu-Zhi(彭图治).Acta Chim.Sinica(Huaxue Xuebao),2004,62(20):2093-2097
Preparation and Photocatalytic Properties of Magnetically Separable Visible-Light Photocatalyst BiVO4/Fe3O4
YAN Wei1WANG Jiao1ZHU Yi1GUO Jia2YANG Jun1ZHANG Yuan-Ming*,1
(1Department of Chemistry,Jinan University,Guangzhou 510632,China)
(2Department of Ecology,Jinan University,Guangzhou 510632,China)
A magnetically separable visible-light photocatalyst BiVO4/Fe3O4was prepared by ultrasonic method.Magnetite Fe3O4permits easy recovery after photocatalytic degradation process by magnetic force.The as-prepared composites were characterized by X-ray diffraction(XRD),UV-Visible diffuse reflectance spectra(DRS),Fourier transform infrared spectroscopy (FTIR),transmission electron microscopy (TEM)and magnetic property measurement system(MPMS).The photocatalytic activities were evaluated by degradation of methylene blue(MB)aqueous solution under visible light(λ>400 nm).Photocatalyst with BiVO4/Fe3O4mass ratio of 5∶1 showed the highest degradation rate up to 92.0%in 5 h,while the degradation rate with BiVO4was 72.5%.The results indicate that Fe3O4acts not only as magnetic particles but also as a promoter.The photocatalyst can be easily separated by an external magnetic field and re-dispersed into aqueous solution by stirring after removal of external magnetic field.The photocatalyst can be reused three times without considerable loss of activity and the photocatalyst still has a degradation rate of 80%in 5 h.
BiVO4/Fe3O4;magnetically separable;ultrasonic method;visible-light photocatalyst
O643.36;O641.81+1;O641.51+1;O641.53+2
A
1001-4861(2011)02-0287-06
2010-08-24。收修改稿日期:2010-09-27。
国家自然科学基金(No.20676050)资助项目。
*通讯联系人。E-mail:tzhangym@jnu.edu.cn,Tel:020-85225036
