Li4Ti5O12/(Cu+C)复合材料的制备及电化学性能
2011-09-15蒋志军刘开宇陈云扬苏耿赵立姣
蒋志军刘开宇*,陈云扬苏 耿赵立姣
(1中南大学化学化工学院,长沙 410083)
(2中南大学粉末冶金国家重点实验室,长沙 410083)
Li4Ti5O12/(Cu+C)复合材料的制备及电化学性能
蒋志军1刘开宇*,1陈云扬1苏 耿2赵立姣1
(1中南大学化学化工学院,长沙 410083)
(2中南大学粉末冶金国家重点实验室,长沙 410083)
以Li4Ti5O12,Cu(CH3COO)2·H2O和C6H12O6为前驱体,化学沉积与热分解结合合成锂离子电池负极材料Li4Ti5O12/(Cu+C)。采用X-射线衍射(XRD)、扫描电子显微镜(SEM)、恒流充放电、循环伏安和电化学阻抗方法表征样品的结构、形貌和电化学性能。结果表明,Li4Ti5O12表面包覆的Cu与C提高了Li4Ti5O12电极材料的导电率,其循环性能和倍率性能得到有效地改善。在0.5C、1C和3C倍率下,经过50次充放电循环,放电比容量分别为168.2、160、140.6 mAh·g-1,其容量保持率分别为88.7%、84.4%、71.2%。电化学阻抗测试表明,表面包覆的Cu与C使其电荷转移阻抗大幅度减少。
Li4Ti5O12/(Cu+C);锂离子电池;表面包覆
尖晶石钛酸锂(Li4Ti5O12)作为锂离子电池负极材料以其独特的性能吸引了众多研究者[1-5]。Li4Ti5O12的理论嵌锂电位较正(1.55 V,vs Li/Li+),这可以避免SEI膜及锂枝晶的生成[6];在充放电时,伴随锂离子的脱出和嵌入,晶体结构保持高度的稳定性,体积变化小于1%,被称为“零应变”材料[7];这些特性使得Li4Ti5O12具有更好电化学性能和安全性。与目前商品化的碳材料如石墨、中间相碳微球(MCMB)等相比,Li4Ti5O12更适合作为动力型锂离子电池负极材料[8]。
然而,Li4Ti5O12是一种绝缘体材料(电导率小于10-13S·cm-1)[9],导致其大电流倍率性能差。为提高材料的电子导电性,人们进行了大量的研究[10-15],目前研究主要集中在掺杂[16-19]和表面修饰[20-23]。Ji等[18]采用金属 Mg对 Li4Ti5O12进行掺杂;Huang等[20]在Li4Ti5O12颗粒表面化学沉积一层铜,合成出了Li4Ti5O12/Cu复合材料,都在很大程度上提高了Li4Ti5O12的倍率性能。最近,Wang等[21]在TiO2颗粒表面包覆一层聚苯胺做为前驱体,固相合成了Li4Ti5O12/C复合材料;王蔚等[22]以Li4Ti5O12/C为前驱体,与AgNO3混合煅烧合成了Li4Ti5O12/(Ag+C)复合材料,都使其电化学性能获得了很大改善,也为这类材料的包覆手段提供了新的思路。
本文以 Li4Ti5O12,Cu(CH3COO)2·H2O 和 C6H12O6为前驱体,化学沉积与热分解法相结合成功制备了Li4Ti5O12/(Cu+C)复合材料,采用XRD和SEM对材料进行了表征,并研究了包覆材料对Li4Ti5O12材料电化学性能的影响。
1 实验部分
1.1 材料的制备
所使用的化学药品均为分析纯。按化学计量比准确称取锐钛型TiO2粉末和Li2CO3(考虑到高温下锂的挥发,使锂源过量5wt%)粉末,以乙醇为分散剂,装入玛瑙罐中进行球磨混料20 h后80℃干燥12 h,取出用刚玉舟盛放入管式炉进行煅烧。在空气气氛中,先以5℃·min-1升温到750℃恒温预烧4 h,再以5℃·min-1升温到850℃恒温20 h,反应完成后随炉冷却至室温。取出样品研细放入干燥器备用,所得样品为白色粉末。
按照Li4Ti5O12与Cu质量比为99:1的比例,分别称取上述合成的4g Li4Ti5O12和0.127g Cu(CH3COO)2·H2O,先用50 mL的去离子水溶解Cu(CH3COO)2·H2O,在电磁搅拌下倒入称量好的Li4Ti5O12,再加入2 g C6H12O6,恒温70℃,继续搅拌8 h后冷却静置,倒去上层清液,120℃干燥12 h后即得前驱体。前驱体在400℃的氩气中煅烧4 h得到Li4Ti5O12/(Cu+C)复合材料。
1.2 材料的物相表征
采用Simens D-500X射线衍射仪进行XRD测试。Cu靶Kα1线,石墨单色器,电压为36 kV,电流为 30 mA,扫描范围 2θ=10°~80°,扫描速度为 4°·min-1,波长 λ=0.15406 nm。采用 JSM-6610 扫描电镜(管电压30 kV)对样品形貌进行观察。
1.3 电极制备
以 N-甲基-2-吡咯烷酮(NMP)为溶剂,按 80∶10∶10的质量比分别称取自制的粉体、导电剂乙炔黑、粘接剂聚偏氟乙烯(PVDF),制成浆料后在铝箔上涂片,120℃下真空干燥 12 h,将涂好的电极片用冲子冲出直径10 mm的圆片,制成工作电极。
1.4 材料的电化学性能测试
以所制备的电极为正极,金属锂(纯度>99.9%,天津中能锂业有限公司)为对电极,微孔聚丙烯膜(celgard2400)为隔膜,1 mol·L-1LiPF6的碳酸乙烯酯(EC)/碳酸二甲酯(DMC)(VEC∶VDMC=1∶1)溶液(深圳新宙邦科技股份有限公司),在干燥、充满氩气的手套箱中组装成CR2025型纽扣电池。
采用Land电池测试系统 (武汉金诺电子公司)进行恒流充放电测试,充放电截止电压分别为2.5和0.8 V。采用PARSTAT2273型电化学综合测试系统(美国Princeton公司)进行循环伏安和电化学阻抗测试,EIS频率范围为10 mHz~100 kHz,振幅为5 mV;所有测试均在298 K下进行。
2 结果与讨论
2.1 材料的物理表征
2.1.1 材料的 XRD 分析
图1分别给出了Li4Ti5O12和Li4Ti5O12/(Cu+C)试样的XRD图,从图中可以看出,试样Li4Ti5O12和Li4Ti5O12/(Cu+C)的衍射峰与 JCPDS卡片(No.26-1198)衍射峰吻合,表现为 2θ=8.37°、35.60°、43.27°、47.38°、57.23°、62.86°、66.09°时出现的几个强的特征峰,说明产物的主相均是具有尖晶石结构的Li4Ti5O12,此外,从图上看不到标识碳的衍射峰,这是由于碳含量较少的缘故;考虑到试样Li4Ti5O12/(Cu+C)是在氩气气氛中合成的,且煅烧的温度较低,但XRD图(b)中没有观察到Cu单质的特征峰,这是由于Cu单质的特征峰与那些Li4Ti5O12的特征峰叠加及其含量很低[13]。
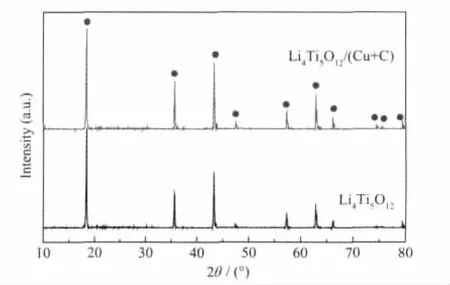
图1 Li4Ti5O12和 Li4Ti5O12/(Cu+C)的 XRD 图Fig.1 XRD patterns of Li4Ti5O12and Li4Ti5O12/(Cu+C)
2.1.2 材料的形貌分析
图2是Li4Ti5O12和Li4Ti5O12/(Cu+C)试样的扫描电镜图。从图上可以看出,Li4Ti5O12由形貌单一的粒子组成,颗粒大小一致,分散性较好,平均粒径为0.5 μm,而 Li4Ti5O12/(Cu+C)颗粒粒径稍有增长,颗粒菱角较为光滑,粉末颗粒之间有一定程度的团聚,粒径在 0.5~2.5 μm 之间。

图2 (a)Li4Ti5O12和(b)Li4Ti5O12/(Cu+C)的SEM 图Fig.2 SEM images of(a)Li4Ti5O12and(b)Li4Ti5O12/(Cu+C)
2.2 电化学性能表征
2.2.1 恒流充放电测试
图3是Li4Ti5O12粉末和Li4Ti5O12/(Cu+C)复合材料的纽扣电池在 2.5~0.8 V 电压范围内,0.1 C 倍率下的首次充放电曲线。从图我们可知两种材料的放电曲线都在1.55 V左右都有一个非常明显的平台,对应于电极活性物质正常的可逆反应[24],即电极活性物质由尖晶石型Li4/3Ti5/3O4转化为岩盐型Li7/3Ti5/3O4。此外,Li4Ti5O12/(Cu+C)复合材料的放电曲线平台较长,其首次放电比容量为 189.6 mAh·g-1,而未包覆Li4Ti5O12电极材料的首次放电比容量为179.9 mAh·g-1。这主要归因于Li4Ti5O12/(Cu+C)颗粒表面的导电物质Cu和C,Cu与C的存在有利于增加颗粒之间电子的传导速率而从而提高材料电导率,进而减小材料电极极化程度,提高活性物质的脱/嵌锂深度。

图3 Li4Ti5O12和Li4Ti5O12/(Cu+C)在0.1C倍率下的首次充放电曲线Fig.3 Initial discharge-charge curves of Li4Ti5O12and Li4Ti5O12/(Cu+C)at 0.1C rate
图4为 Li4Ti5O12和 Li4Ti5O12/(Cu+C) 在 0.5C、1C和3C倍率下的循环放电容量曲线。由图4分析可得,随着放电倍率的增加,Li4Ti5O12的放电比容量由0.5C的165.7 mAh·g-1降低到 3C的92.2 mAh·g-1,保持率为55.6%;而Li4Ti5O12/(Cu+C)的放电比容量由 0.5C的173.7 mAh·g-1降低到 3C的140.6 mAh·g-1,保持率为 80.9%;同时,Li4Ti5O12/(Cu+C)电极材料在0.5C、1C和3C倍率下循环50次后,容量保持率分别为 88.7%、84.4%及 71.2%,其放电比容量分别为 168.2、160、140.6 mAh·g-1,较 Li4Ti5O12的放电比容量分别提高了 8.6、23.6、47.4 mAh·g-1。可见,包覆材料中的导电物质Cu与C使Li4Ti5O12的倍率性能和循环性能得到了很大的提高,表明Cu与C的包覆改善了Li4Ti5O12材料的电化学性能,减少了电池的极化作用。
从改善Li4Ti5O12电化学性能角度出发,提高材料的电导率可以改善Li4Ti5O12的充放电性能,Wang等[21]已证实,碳表面包覆Li4Ti5O12可以形成导电网络,进而提高材料的导电率;另外,Huang等[20]通过电镀法在Li4Ti5O12颗粒材料表面镀上一层铜,显著改善了材料的倍率性能,本文在Li4Ti5O12颗粒表面同时包覆Cu与C,也提高了材料的倍率性能,且合成工艺较为简单可控。

2.2.2 循环伏安测试
图5为Li4Ti5O12和Li4Ti5O12/(Cu+C)的循环伏安图。扫描速度为 0.6 mV·s-1,电位范围为 2.5~0.8 V。从图中可以看出,在1.4和1.7 V附近出现了一对明显的还原/氧化峰,对应锂离子在正极Li4Ti5O12中的嵌入和脱嵌,即纽扣电池的放电和充电过程;此外,试样 Li4Ti5O12/(Cu+C)的峰电位差 ΔEP较Li4Ti5O12的小,峰面积明显增大,表明Cu与C的共同包覆增加了Li4Ti5O12的整体电导率,使Li4Ti5O12电化学反应的极化程度减小,从而改善其可逆性。这与前述的充放电测试结果相一致。
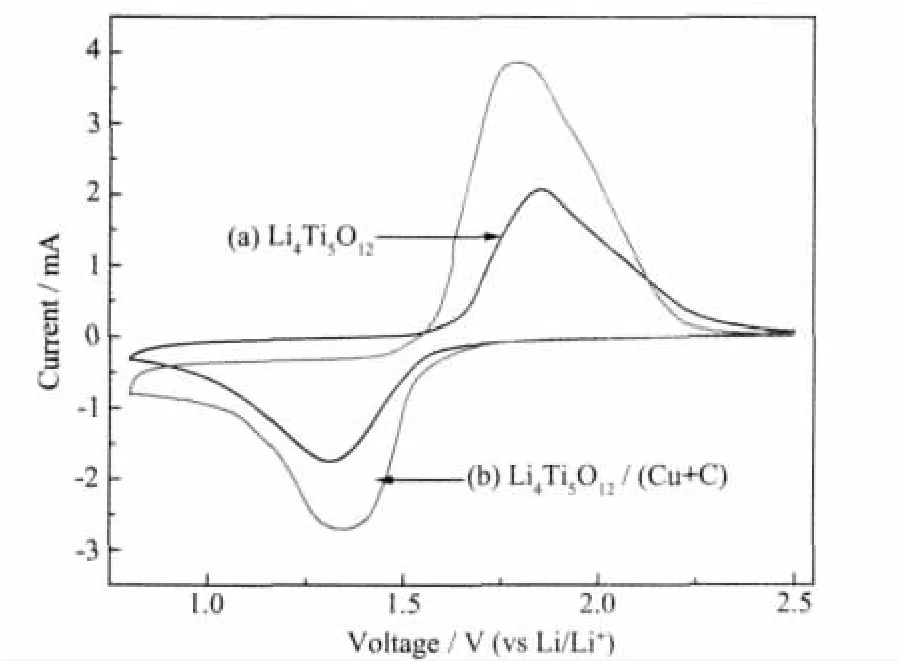
图5 Li4Ti5O12和Li4Ti5O12/(Cu+C)在扫描速度为0.6 mV·s-1的循环伏安曲线Fig.5 CV curves of Li4Ti5O12and Li4Ti5O12/(Cu+C)at scanning rate of 0.6 mV·s-1
图6考察了试样Li4Ti5O12和Li4Ti5O12/(Cu+C)在不同扫速下的循环伏安特性。由图可见,在该电极中,随着扫描速率的增大,峰电位差ΔEP也随之变大,同时峰电流也增大,氧化峰和还原峰电位分别向正、负方向偏移,表明电化学极化随扫描速率增加而增大。从图6还可以看出,电极的电化学反应都不是完全可逆反应,因为氧化/还原峰电位差ΔEP都大于59 mV。但从图形表观上看,氧化峰、还原峰2个峰形状比较对称,也不是完全不可逆的。对氧化峰峰值电流ip与扫描速率v的方根之比作图,如图7所示。可以看出,峰值电流随扫描速率v的增大而增大。因此,Li4Ti5O12和Li4Ti5O12/(Cu+C)材料电极的电化学反应都属于准可逆过程。

图6 Li4Ti5O12和Li4Ti5O12/(Cu+C)在不同扫描速度下的循环伏安曲线Fig.6 CV curves of Li4Ti5O12and Li4Ti5O12/(Cu+C)at different scanning rates of 0.1,0.25,0.4 and 0.6 mV·s-1
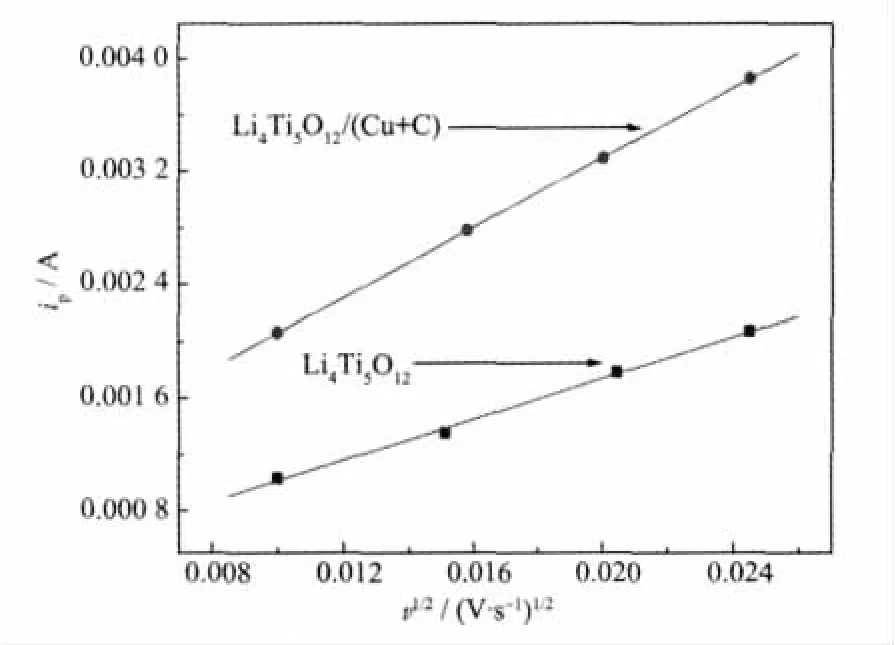
图7 Li4Ti5O12和Li4Ti5O12/(Cu+C)电极氧化峰值电流与扫描速度的方根之比Fig.7 Anodic peak current for Li4Ti5O12and Li4Ti5O12/(Cu+C)eleotrode of ipvs v1/2of scan rate
对于准可逆体系,峰电流和扫速平方根有[25]:

其中,ip为电位扫描峰值电流 (A);n=1,A为电极面积(cm2),C0为锂离子嵌出前后离子浓度差(mol·cm-3),在Li4/3Ti5/3O4中每个晶胞中有8个锂离子,晶胞体积为5.843×10-22cm3,则晶胞中锂离子的浓度为C=0.02274 mol·cm-3,循环电位在1.5 V左右Li4/3Ti5/3O4中嵌入一个锂离子形成Li7/3Ti5/3O4,而晶胞体积基本不变[26],得 C1=0.04548 mol·cm-3,而 Li4/3Ti5/3O4与Li7/3Ti5/3O4相互间是可逆的[24],因此C0=0.02274 mol·cm-3;v为峰电位扫描速率(V·s-1),D0为反应的扩散系数,α为电子转移系数,nα为速率决定步骤中的电子转移数。
若anα等于0.5,对ip和v1/2进行线性拟合,相应数值代入式(2),由此可得Li4Ti5O12和Li4Ti5O12/(Cu+C)材料电极的锂离子扩散系数D0分别为4.3×10-10、1.2×10-9cm2·s-1,与 Li4Ti5O12相比,Li4Ti5O12/(Cu+C)材料电极的D0有所提高,表明Li4Ti5O12颗粒表面的包覆材料Cu与C并没有阻碍锂离子的迁移。
2.2.3 电化学阻抗测试
图8是各试样组装成纽扣电池在0.1C倍率下循环3次后测试的交流阻抗谱,测试的开路电压为1.54 V。从图8及其内嵌图可以观察到,电化学阻抗谱图由高、中频区的一个半圆弧和低频区接近45°的一条直线组成。可以明显看出,两种材料在同一电压范围具有相似的阻抗特征。高、中频区的半圆弧对应于电荷转移阻抗和电极/溶液界面的双电层电容;它与横轴Z′的交点表示的是溶液的本体电阻;低频区接近45°的直线代表Warburg阻抗,这是由Li+在电极材料中的扩散引起的[27]。从图中可以清楚的看到,试样Li4Ti5O12/(Cu+C)的半圆弧远小于未包覆的,说明Cu与C的包覆可以大幅度减小Li4Ti5O12材料的电荷转移阻抗,即降低电极反应过程的阻力。结合充放电测试结果,由此看出,Cu与C的包覆可提高材料Li4Ti5O12的导电率,最终改善材料Li4Ti5O12的电化学性能。
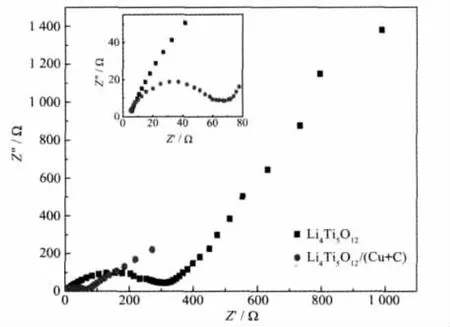
图8 Li4Ti5O12和Li4Ti5O12/(Cu+C)电极的电化学阻抗谱图Fig.8 EIS of Li4Ti5O12and Li4Ti5O12/(Cu+C)electrodes
3 结 论
以 Li4Ti5O12,Cu(CH3COO)2·H2O 和 C6H12O6为 前驱体,采用化学沉积与热分解相结合的方法,制备了Li4Ti5O12/(Cu+C)复合材料。恒电流充放电结果表明,Li4Ti5O12/(Cu+C)复合电极材料具有更好的循环性能和倍率性能,在0.5C、1C及3C倍率下,经过50次充放电循环,容量保持率分别为88.7%、84.4%及71.2%,其放电比容量分别为 168.2、160、140.6 mAh·g-1,较Li4Ti5O12的放电比容量分别提高了 8.6、23.6、47.4 mAh·g-1。电化学阻抗结果表明,Li4Ti5O12/(Cu+C)复合材料具有较低的电荷转移阻抗。
[1]Ohzuku T,Ueda A,Yamamoto N,et al.J.Power Sources,1995,54(1):99-102
[2]Panero S,Reale P,Ronci F,Scrisati B,et al.Phys.Chem.Chem.Phys.,2001,3(5):845-847
[3]Ouyang C Y,Zhong Z Y,Lei M S.Electrochem.Commun.,2007,9(1):1107-1112
[4]Shu J.J.Solid State Electrochem.,2009,13(10):1535-1539
[5]Tao Y,Rui C,Ke W,et al.Ceram.Int.,2009,35(5):1757-1768
[6]Prosini P P,Mancini R,Petrucci L,et al.Solid State Ionics,2001,144(1/2):185-192
[7]Wang D,Xu H Y,Gu M,et al.Electrochem.Commun.,2009,11(1):50-53
[8]Yao X L,Xie S,Chen C H,et al.Electrochimica.Acta,2005,50(20):4076-4081
[9]Chen C H,Vaughey J T,Jansen A N,et al.J.Electrochem.Soc.,2001,148(1):A102-A104
[10]Huang S H,Wen Z Y,Zhu X J,et al.J.Electrochem.Soc.,2005,152(7):A1301-A1305
[11]HE Ze-Qiang(何则强),LIU Wen-Ping(刘文萍),XIONG Li-Zhi(熊利芝),et al.Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2007,23(4):733-737
[12]SU Yue-Feng(苏岳 锋),WU Feng(吴锋),ZANG Ge(臧戈),et al.Chinese J.Acta Phys.-Chim.Sin.(Wuli Huaxue Xuebao),2008,24(6):1002-1006
[13]DU Chen-shu(杜晨树),YANG Hua-bin(杨化滨),ZHOU Zuo-Xiang(周作祥),et al.Chin.J.Electrochem.(Dian Huaxue),2008,14(3):238-242
[14]Tang Y F,Yang L,Qiu Z,et al.J.Mater.Chem.,2009,19(33):5980-5984
[15]Kang X H,Utsunomiya H,Achiha T,et al.J.Electrochem.Soc.,2010,157(4):A437-A442
[16]Qi Y L,Huang Y D,Jia D Z,et al.Electrochimica.Acta,2009,54(21):4772-4776
[17]Capsoni D,Bini M,Massarotti V,et al.J.Phys.Chem.C,2009,113(45):19664-19671
[18]Ji S Z,Zhang J Y,Wang W W,et al.Mater.Chem.Phys.,2010,123(2/3):510-515
[19]LI Xing(李星),QU Mei-Zhen(瞿关臻),YU Zuo-Long(于作龙).Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2010,26(2):233-239
[20]Huang S H,Wen Z Y,Lin B,et al.J.Alloys Compd.,2008,457(1/2):400-403
[21]Wang Y G,Liu H M,Wang K X,et al.J.Chem.Mater.,2009,19(37):6789-6795
[22]WANG Wei(王蔚),CAO Gao-Shao(曹高劭),YE Jing-Ya(叶静雅),et al.Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2009,25(12):2151-2155
[23]Cai R,Yu X,Liu X Q,et al.J.Power Sources,2010,195(24):8244-8250
[24]Shen L F,Yuan C Z,Luo H J,et al.J.Mater.Chem.,2010,20(33):6998-7004
[25]Milne N A,Maria S K,Luca V.J.Phys.Chem.C,2009,113(30):12983-12995
[26]Ohzuku T,Ueda A,Yamamoto N.J.Electrochem.Soc.,1995,142(5):1431-1435
[27]Huang J J,Jiang Z Y.Electrochimica.Acta,2008,53(26):7756-7759
Synthesis and Electrochemical Performance of Li4Ti5O12/(Cu+C)Composite Electrode Material
JIANG Zhi-Jun1LIU Kai-Yu*,1CHEN Yun-Yang1SU Geng2ZHAO Li-Jiao1
(1College of Chemistry&Chemical Engineering,Central South University,Changsha 410083,China)
(2State Key Laboratory of Powder Metallurgy,Central South University,Changsha 410083,China)
Li4Ti5O12/(Cu+C)composite as anode material for lithium-ion batteries was synthesized by chemical deposition combined with thermal decomposition of a mixture of Cu(CH3COO)2·H2O,C6H12O6and Li4Ti5O12.The structure,morphology and electrochemical performance of samples were characterized by X-ray diffractometry(XRD),scanning electron microscopy(SEM),galvanostatic charge-discharge test,cyclic voltammeter(CV)and electrochemical impedance spectroscopy(EIS).The results showed that surface coating of Cu and C on Li4Ti5O12particle improved its electronic conductivity and therefore enhanced the performance of the circulation and rate capability.The discharge capacity of the composite were 168.2,160 and 140.6 mAh·g-1at 0.5C,1C and 3C rate after 50 cycles,and the corresponding capacity retention were 88.7%,84.4%and 71.2%,respectively.EIS test proved that surface coating of Cu and C on Li4Ti5O12particle could decrease its charge transfer resistance greatly.
Li4Ti5O12/(Cu+C);Li-ion batteries;surface coating
614.111;O614.47+1;TM912.9
A
1001-4861(2011)02-0239-06
2010-06-27。收修改稿日期:2010-10-29。
国家自然科学基金(No.21071153;20976198),湖南省科技计划重点项目(No.2008GK2008),中南大学研究生学位论文创新基金(No.1114-713360010)资助。
*通讯联系人。E-mail:kaiyuliu@263.net,Tel:13548590751
