MT1-MMP基因敲除细胞的诱导多能干细胞系的构建*
2011-09-14王彦霞马海英魏文娟卢晓梅金玉楠于艳秋
王彦霞, 马 玲, 马海英, 魏文娟, 卢晓梅, 金玉楠, 于艳秋
(中国医科大学基础医学院病理生理教研室,辽宁沈阳110001)
诱导多能干细胞(induced pluripotent stem cells,iPSCs)是一类新型的干细胞,它有着与胚胎干细胞(embryonic stem cells,ESCs)相同的特征,具有自我更新、无限增殖以及向3个胚层分化的能力。ESCs属于全能干细胞,是来源于哺乳类动物囊胚的内细胞团,具有无限增殖而保持其多能性的能力,尤其在特定因素的影响或诱导下,可向多种细胞或组织分化[1,2]。通过将核转移到卵母细胞中[3]或成体细胞与ESCs相融合[4],使成体细胞重新编程为具有多能性的细胞。但无论是ESCs还是重新编程的细胞在移植到病人体内都会发生免疫排斥反应,并且在获得ESCs时,不免会产生损坏胚胎的道德问题。最早建立iPSCs系是在2006年,研究人员利用逆转录病毒介导,将Oct3/4、Sox2、c-Myc及Klf4四个外源基因转入鼠成纤维细胞中,使成体细胞重新编程为具有多向分化潜能的干细胞,并命名该类细胞为 iPSCs[5,6]。在 2007年,美国Thomson实验室首次用Oct4、Sox2、Nanog及Lin28 4个基因转染,将人成纤维细胞重新编程为iPSCs[7]。到目前为止,国内外许多实验室完成了多种类型成体细胞向iPSCs的重新编程,同时iPSCs也可向多种组织类型细胞分化,如iPSCs能够定向分化为胰岛素分泌细胞、神经细胞、肝细胞和心肌细胞[8-11]等。膜型基质金属蛋白酶(membrane-type matrix metalloproteinases,MT-MMPs)可降解各种细胞外基质,通过控制细胞的黏附和细胞骨架的构建,调节细胞的迁移、生长、分化和存活[12]。它们依靠疏水性的C-末端锚定在细胞膜上,在细胞表面发挥水解作用[13]。MT1-MMP是最先被发现而且是最重要的,又称为MMP-14。MT1-MMP在血管与软骨、骨的形成中起着主要作用,特别是肿瘤中的血管。活化的MT1-MMP能降解细胞外各种基质大分子,包括Ⅰ、Ⅱ和Ⅲ型胶原、纤连蛋白、纤维蛋白等。在血管的形成过程中,内皮细胞首先侵入到主要由Ⅰ型胶原组成的间质性基质中,细胞外基质降解酶包括基质金属蛋白酶(matrix metalloproteinases,MMPs)在血管的形成中都起着重要作用,它们与细胞表面的结合位点结合后,依赖纤溶酶过程和/或MT1-MMP过程激活后而发挥作用。本实验是用转基因的方法将逆转录病毒介导的Oct3/4、Sox2、c-Myc及Klf4四个外源基因转入正常和MT1-MMP基因缺失鼠成纤维细胞中,使之重新编程为iPSCs,有利于我们进一步对MT1-MMP基因和iPSCs作用的研究。
材料和方法
1 材料
1.1 细胞来源 pMXs-Oct3/4、-Sox2、-c-Myc和 -Klf4质粒,Plat- E 包装细胞系,Fbx15βgeo/βgeo鼠成纤维细胞,MT1 -MMP基因敲除鼠成纤维细胞和SNL饲养细胞等均由香港大学周中军教授馈赠。
1.2 主要试剂 DMEM(低糖)、胎牛血清(FBS)、0.25%trypsin-EDTA、L-谷氨酰胺、非必需氨基酸、青链霉素、OPTI-MEM、IMDM心肌诱导培养基和β-巯基乙醇均购自Gibco。羊抗鼠Flk-1/KDR多克隆抗体、rHuVEGF165和rHubFGF购自 R&D Systems Inc.。PBS购自福州迈新公司。Lipofectamine 2000和DNA质粒提取试剂盒均购自Invitrogen。海美溴氨购自Sigma。明胶购自华美生物公司。鼠抗鼠或人SSEA-1单克隆抗体购自BioLegend。鼠抗鼠或人Oct3/4单克隆抗体、兔抗鼠troponin I多克隆抗体、山羊抗小鼠IgGPE、山羊抗兔IgG-PE和兔抗山羊 IgG-PE均购自 Santa Cruz。碱性磷酸酶试剂盒和DAPI均购自江苏碧云天公司。
2 方法
2.1 细胞准备 从液氮中各取出1管SNL、Plat-E、WT和MT1-MMP基因敲除细胞,放入37℃水浴锅中,使之快速解冻,然后将细胞悬液转移到离心管中,1 000 r/min离心5 min,弃上清,用含10%FBS的DMEM培养基重悬细胞,将细胞转移到提前铺好明胶的60 mm培养皿中,放在37℃、5%CO2、饱和湿度条件下培养,等细胞长到约80% -90%融合进行传代。SNL细胞用丝裂霉素处理后,作为饲养细胞;Plat-E用于包装pMXs-Oct3/4、-Sox2、-c-Myc和-Klf4 4种质粒;WT和MT1-MMP基因敲除细胞准备被转染。
2.2 质粒扩增和包装成病毒 将分别携带有pMXs-Oct3/4、-Sox2、-c-Myc和-Klf4 4种质粒的大肠杆菌,加入到LB培养基中放入37℃摇床中过夜,第2 d用DNA提取试剂盒按说明书提取pMXs-Oct3/4、-Sox2、-c-Myc和-Klf4 4种质粒。
2.3 细胞转染 Plat-E包装细胞系传代后,以密度8×108cells/L细胞数接种于100 mm的培养皿中,加入OPTIMEM、Lipofectamine 2000和含有 pMXs-Oct3/4、-Sox2、-c-Myc和-Klf4的质粒过夜,第2 d 20 mL注射器吸取上清液,用0.45 μm滤器将上清液过滤到15 mL离心管中,再加入10 μL 8 g/L的海美溴氨。传代后的WT和MT1-MMP基因敲除细胞以密度8×107cells/L细胞数接种于100 mm的培养皿中,加入 pMXs-Oct3/4、-Sox2、-c-Myc和 -Klf4质粒包装成病毒的上清液,放入37℃、5%CO2、饱和湿度条件下培养,第2 d再转染1次,每天换液,2 d后传到铺有饲养细胞的培养皿中,隔天换液。
2.4 iPSCs的鉴定
①光镜下观察形态变化 在光学倒置显微镜下观察WT和MT1-MMP基因敲除细胞形态和转染后的克隆形成情况。当克隆足够大时,采集克隆,将克隆细胞传代,观察传代后iPSCs的形态。
②碱性磷酸酶染色 按碱性磷酸酶试剂盒说明书进行操作,将iPSCs以3×107cells/L密度接种于35 mm的培养皿中,第2 d弃去培养基,PBS洗2遍。4%多聚甲醛固定30 min,PBS洗3遍(每遍5 min),加入碱性磷酸酶染色液,10 min后显微镜下观察拍照。
③免疫细胞化学染色 iPSCs用免疫细胞化学染色法检测ESCs特异性标志SSEA-1和Oct3/4表达情况。将iPSCs弃去培养基,PBS洗2遍,4%多聚甲醛固定30 min,PBS洗3遍(每遍5 min)。0.2%Triton X-100打孔30 min,PBS洗3遍。5%FBA封闭样本20 min,滴加Ⅰ抗,置于湿盒,4℃孵育过夜,第2 d PBS洗3遍。滴加Ⅱ抗,37℃孵育30 min,PBS洗3遍。DAPI染核4 min,PBS洗3遍荧光显微镜下观察拍照。
2.5 体外iPSCs诱导分化和鉴定 用含20%FBS的IMDM心肌细胞诱导分化培养基,以及含有50 μg/L rHuVEGF和10 μg/L rHubFGF的内皮细胞分化培养基,iPSCs以密度8×107cells/L应用悬滴法(“hanging drop”)培养,即将细胞悬液以20 μL/滴,接种于盛有10 mL PBS的100mm培养皿的皿盖上,置37℃、5%CO2的孵箱中悬滴培养4 d后,iPSCs形成肉眼可见大小均一的拟胚体(embryonic bodys,EBs)。从单个悬滴中吸出形成的悬浮EBs,转入至预先以0.1%明胶包被的24孔培养板中(1-2个/孔),隔天换1次新鲜诱导液,放入37℃、5%CO2、饱和湿度条件下培养。分化约12 d后,向心肌细胞分化的一些EBs中,出现有节律跳动的心肌合胞体。心肌细胞出现跳动后,用免疫细胞化学染色法分别检测心肌细胞特异性标志物肌钙蛋白I和内皮细胞特异性标志物Flk-1表达情况。
结 果
1 WT和MT1-MMP基因敲除鼠成纤维细胞和Plat-E细胞形态
从液氮中各取出1管WT和MT1-MMP基因敲除鼠成纤维细胞和Plat-E细胞,快速解冻后,将这些细胞转移到提前铺好明胶的60 mm培养皿中,细胞长到约80% -90%融合后传代培养,可见2种成纤维细胞呈长梭形,见图1A、B,以及Plat-E细胞,见图1C。

Figure 1.The morphology of WT(A),MT1-MMP-deficient(B)mouse fibroblasts and Plat-E cells(C)(×200).图1 WT和MT1-MMP基因敲除鼠成纤维细胞和Plat-E细胞形态
2 ESCs样克隆形成、iPSCs形态和碱性磷酸酶染色
在光学倒置显微镜下观察WT和MT1-MMP基因敲除细胞形态和转染后的克隆形成情况,可见有明显的ESCs样克隆形成,见图2A、D。当克隆足够大时,采集克隆,将克隆细胞传代,观察传代后iPSCs的形态,传代的iPSCs种在饲养细胞上,iPSCs与ESCs相似,呈集落式生长,见图2B、E。将传第3代的iPSCs进行碱性磷酸酶染色观察,可见iPSCs被碱性磷酸酶染成蓝紫色,见图2C、F。

Figure 2.The morphology of ESC-like clone(A,D)(×100),iPSCs(B,E)(×200)and AP staining(C,F)(×200).A,B,C and D,E,F:cells derived from WT and MT1-MMP-deficient mouse fibroblasts,respectively.图2 ESCs样克隆形成、iPSCs形态和碱性磷酸酶染色
3 用免疫细胞化学染色检测ESCs特异性标志物SSEA-1和Oct3/4表达情况
传第3代的iPSCs用免疫细胞化学染色法检测ESCs特异性标志SSEA-1和Oct3/4表达情况,可见2种iPSCs都明显表达ESCs特异性标志物SSEA-1和Oct3/4,见图3。
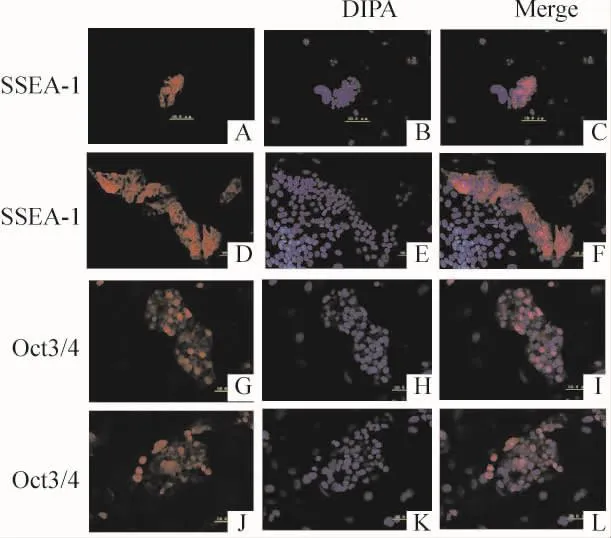
Figure 3.Immunocytochemical analysis of WT-iPSCs(A -C,G-I)and MT1-MMP-deficient-iPSCs(D-E,JL).Expression of the pluripotency markers SSEA -1(A-F)and Oct3/4(G-L)was detected(×400).图3 免疫细胞化学染色检测ESCs特异性标志物SSEA-1和Oct3/4表达情况
4 体外iPSCs诱导分化培养EBs
从单个悬滴中吸出成形的悬浮EBs,转入至预先以0.1%明胶包被的24孔培养板中(1-2个/孔),光镜下观察拟胚体,可见2种细胞被重新编程为iPSCs后,都可形成EBs,而且MT1-MMP基因敲除-iPSCs形成的EBs与WT-iPSCs形成的EBs形态一致,见图4。
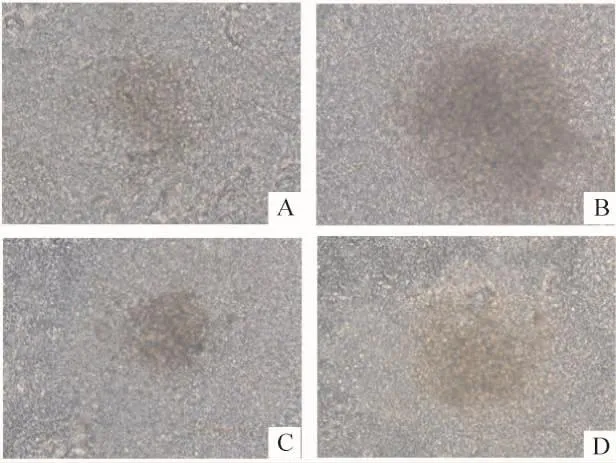
Figure 4.The morphology of EBs derived from WT-iPSCs(A,C)and MT1-MMP-deficient-iPSCs(B,D)(×200).A,B:EBs induced to differentiate into EC-sC;C,D:EBs induced to differentiate into cardiomyocytes.图4 体外iPSCs诱导分化培养
5 已经形成的EBs肌钙蛋白I和Flk-1免疫细胞化学染色结果
将已经形成的EBs接种于提前铺好明胶的35 mm的小皿中,贴壁后用免疫细胞化学检测肌钙蛋白I和Flk-1的表达,可见MT1-MMP基因敲除-iPSCs形成的EBs能够表达肌钙蛋白I和Flk-1,与WT-iPSCs形成的EBs的表达情况一致,见图5。
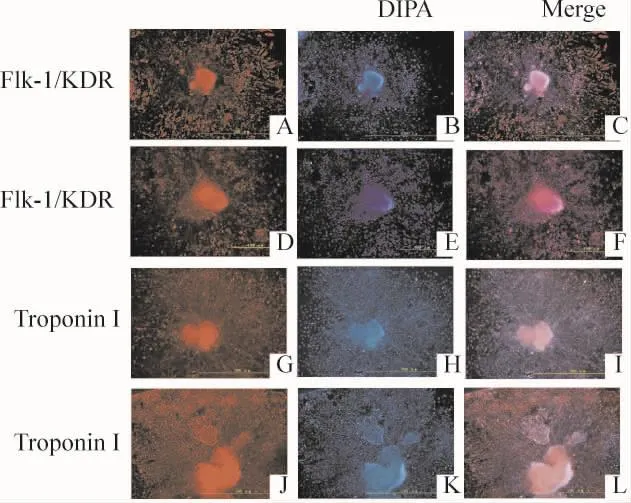
Figure 5.Immunocytochemical staining of EBs derived from WT-iPSCs(A-C,G-I)and MT1-MMP-deficientiPSCs(D-F,J-L)induced to differentiate into ECs and cardiomyocytes(×400).Expression of the markers Flk-1/KDR(A-F)and troponin I(G-L)was detected.图5 2种iPSCs诱导分化为内皮和心肌细胞的EBs进行免疫细胞化学染色
6 单个内皮和心肌细胞肌钙蛋白I和Flk-1免疫细胞化学染色结果
将已经分化好的EBs用胰酶消化,吹打形成单个细胞后,接种于提前铺好明胶的35 mm的小皿中,贴壁后用免疫细胞化学检测肌钙蛋白I和Flk-1的表达,可见MT1-MMP基因敲除-iPSCs形成的EBs,吹打形成单个细胞后,也能够表达肌钙蛋白I和Flk-1,与WT-iPSCs的表达情况一致,见图6。
讨 论
目前iPSCs已经广泛被研究。2006年,研究人员将逆转录病毒介导的Oct3/4、Sox2、c-Myc及Klf4 4个外源基因转入鼠成纤维母细胞中,使成体细胞重新编程为具有多向分化潜能的干细胞[5,6],即 iPSCs。通过 DNA 基因芯片分析,iPS细胞去甲基化状态与 ES细胞几乎相同[6]。iPSCs有着与ESCs相同的特性,但还具有ESCs没有的优点,iPSCs在临床应用中不涉及免疫和道德问题,而且可以根据病人及他们的病因不同,制备出以病人和/或疾病为特异性的iPSCs。现已有实验室将iPSCs定向分化而来的造血前体细胞,移植给致死量照射处理后的小鼠,结果发现不仅重建了小鼠的造血系统,而且将红细胞形态由原先的镰刀状修正为圆盘状[14],这就说明了iPSCs将来可以运用于临床的疾病治疗中。
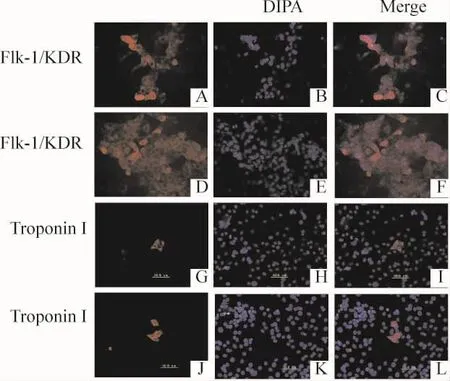
Figure 6.Immunocytochemical staining of single cells derived from WT-iPSCs(A-C,G-I)and MT1-MMP-deficient-iPSCs(D -E,J-L)induced to differentiate into ECs and cardiomyocytes(×400).Expression of the markers Flk-1/KDR(A-F)and troponin I(G -L)was detected.图6 EBs吹打为单个内皮和心肌细胞进行肌钙蛋白I和Flk-1免疫细胞化学染色
本实验通过逆转录病毒介导的Oct3/4、Sox2、c-Myc及Klf4四个外源基因转入到正常鼠的成纤维细胞中,将其重新编程为iPSCs,而且在国内外首次将MT1-MMP基因缺失鼠的成纤维细胞重新编程为iPSCs。对已形成的2种iPSCs,本实验中所用的检测方法是根据ESCs所具有的特性进行的。首先用碱性磷酸酶染色,碱性磷酸酶显色是免疫组化显色的一种,是对iPSCs进行初步的一种检测。ESCs中有许多多能的基因,如 SSEA - 1、Oct3/4、Sox2、Klf4、c - Myc、Nanog 及Lin28等,本实验选取了SSEA-1和Oct3/4这2种多能的基因进行免疫荧光染色,并且将这2种多能的细胞向心肌和内皮细胞分化,以验证重新编程的iPSCs含有与ESCs有着相似的多能特性。基质金属蛋白酶是一类具有锌指结构的内肽酶家族,它能降解细胞外基质,因此它在组织重塑,肿瘤发展和血管形成中起着重要的作用。MT-MMPs是一种固有的跨膜蛋白,它含有MMPs所有特征性的蛋白结构域,MTMMPs有6种亚型。与正常小鼠相比,MT1-MMP基因缺失的小鼠,可以表现出胶原代谢的缺陷,血管新生的反应延迟,并且由于血管形成缺陷,继发引起骨化中心受损,从而导致骨形成障碍[15]。从MT1-MMP基因敲除鼠取下的血管,进行体外培养可以看到血管出芽生长缺陷,而从普通小鼠取下的血管,则可以看到血管正常出芽生长[16]。此外,MT1-MMP可能调节癌细胞诱导其血管生成的能力,表达MT1-MMP的肿瘤细胞生成迅速,并且能形成含血管丰富的肿瘤,MT1-MMP在肿瘤中的过表达进一步支持了它的亲血管活性[13]。因此,MT1-MMP在新生血管中起着必不可少作用。
无论是正常细胞还是肿瘤细胞,细胞外的蛋白成分似乎对其微环境起着决定作用。MT-MMPs是细胞膜上重要的一类亚家族,它们与多种酶相联系,调节着细胞外基质。MT1-MMP主要作用是调节血管形成和裂解基质成分,它与膜和胞浆内分子相互作用,控制着一些细胞的功能[12]。因此,MT1-MMP发挥作用的信号转导路线需要被进一步研究。本次实验将MT1-MMP基因敲除鼠的成纤维细胞重新编程为iPSCs,经过一系列的检测发现该iPSCs与正常鼠成纤维细胞重新编程为iPSCs有着相似的特征,它可以表达ESCs特异性的抗体SSEA-1和Oct3/4,将其诱导可以向心肌和内皮细胞分化。MT1-MMP基因敲除鼠血管、骨和软骨形成障碍,根据我们研究发现将其重新编程为iPSCs后,它可以在体外分化为内皮细胞。但是基因缺失在一定程度上是否可以重建;将MT1-MMP基因敲除鼠的iPSCs回输到MT1-MMP基因缺失鼠内,血管再生、骨和软骨生成情况是否有改善,还有待我们进一步研究。这就给我们新的启发,从某些基因缺陷所致疾病的病人身上取得一些成体细胞,将其重新编程为iPSCs,然后再重新输入到病人体内,那么他们的基因缺陷能否可以修正,病情能否有所改善,这些都是我们要进一步研究的问题。
[1]Thomson JA,Itskovitz-Eldor J,Shapiro SS,et al.Embryonic stem cell lines derived from human blastocysts[J].Science,1998,282(5391):1145- 1147.
[2]胡智兴,耿菊敏,梁道明.肝细胞生长因子促进人胚胎干细胞向神经前体细胞分化[J].中国病理生理杂志,2010,26(4):730 -736.
[3]Wilmut I,Schnieke AE,McWhir J,et al.Viable offspring derived from fetal and adult mammalian cells[J].Cloning Stem Cells,2007,9(1):3- 7.
[4]Cowan CA,Atienza J,Melton DA,et al.Nuclear reprogramming of somatic cells after fusion with human embryonic stem cells[J].Science,2005,309(5739):1369 -1373.
[5]Takahashi K,Yamanaka S.Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors[J].Cell,2006,126(4):663 - 676.
[6]Okita K,Ichisaka T,Yamanaka S.Generation of germline- competent induced pluripotent stem cells[J].Nature,2007,448(7151):313- 317.
[7]Yu J,Vodyanik MA,Smuga- Otto K,et al.Induced pluripotent stem cell lines derived from human somatic cells[J].Science,2007,318(5858):1917- 1920.
[8]Tateishi K,He J,Taranova O,et al.Generation of insulin-secreting islet-like clusters from human skin fibroblasts[J].J Biol Chem,2008,283(46):31601 -31607.
[9]Okano H.Strategies toward CNS-regeneration using induced pluripotent stem cells[J].Genome Inform,2009,23(1):217- 220.
[10]Gai H,Nguyen DM,Moon YJ,et al.Generation of murine hepatic lineage cells from induced pluripotent stem cells[J].Differentiation,2010,79(3):171 - 181.
[11]Mauritz C,Schwanke K,Reppel M,et al.Generation of functional murine cardiac myocytes from induced pluripotent stem cells[J].Circulation,2008,118(5):507 -517.
[12]Zucker S,Pei D,Cao J,et al.Membrane type - matrix metalloproteinases(MT-MMP)[J].Curr Top Dev Biol,2003,54:1 -74.
[13]Hotary KB,Allen ED,Brooks PC,et al.Membrane type I matrix metalloproteinase usurps tumor growth control imposed by the three - dimensional extracellular matrix[J].Cell,2003,114(1):33- 45.
[14]Hanna J,Wernig M,Markoulaki S,et al.Treatment of sickle cell anemia mouse model with iPS cells generated from autologous skin[J].Science,2007,318(5858):1920- 1923.
[15]Zhou Z,Apte SS,Soininen R,et al.Impaired endochondral ossification and angiogenesis in mice deficient in membrane - type matrix metalloproteinase I[J].Proc Natl Acad Sci USA,2000,97(8):4052-4057.
[16]Chun TH,Sabeh H,Ota I,et al.MT1-MMP– dependent neovessel formation within the confines of the three - dimensional extracellular matrix[J].J Cell Biol,2004,167(4):757- 767.
