SnoN对高糖诱导大鼠原代肾小管上皮细胞纤维连接蛋白合成的影响*
2011-09-14刘瑞霞王圆圆石明隽张国忠
刘瑞霞, 郭 兵, 王圆圆, 肖 瑛, 石明隽, 张国忠
(贵阳医学院病理生理学教研室,贵州贵阳550004)
我们前期研究发现,核转录共抑制因子SnoN(Ski-related novel protein N)在糖尿病肾病(diabetic nephropathy,DN)肾小管-间质纤维化发病过程中可能起着重要作用[1-3]。但在 DN 发病中,有关SnoN与肾小管-间质纤维化之间存在怎样的关系,与肾小管-间质纤维化的哪些成份有关,国内外尚未检索到相关的报道。纤维连接蛋白(fibronectin,FN)是细胞外基质(extracellular matrix,ECM)的主要成份,而ECM的过度沉积是DN肾小管-间质纤维化的基本病理改变。因此,我们通过动态观察SnoN和FN在高糖培养大鼠原代肾小管上皮细胞(renal tubular epithelial cells,RTECs)中的表达变化;并通过siRNA技术敲低肾小管上皮细胞中SnoN的表达,再观察FN的表达情况,初步探讨SnoN与DN肾小管-间质纤维化发病的关系。
材料和方法
1 材料
1.1 主要试剂 低糖DMEM培养基和胰蛋白酶(HyClone);胎牛血清(fetal bovine serum,FBS)(Gibco);转铁蛋白(Sigma);抗 SnoN、SnoN siRNA、siRNA transfection reagent、fluorescein - conjugated control siRNA、siRNA transfection medium、siRNA dilution buffer、SnoA/N(m)-PR和抗上皮性钙黏蛋白(E-cadherin)(Santa Cruz);抗角蛋白-18(cytokeratin-18,CK-18)、抗 α-平滑肌肌动蛋白(α-smooth muscle actin,α -SMA)、抗 FN、抗 β -actin、DAB、浓缩型SABC-FITC免疫检测试剂盒、生物素标记羊抗兔IgG和生物素标记羊抗小鼠IgG(博士德);总RNA提取试剂盒、蛋白质marker、2×Taq PCR Master Mix和600 bp DNA marker(天根);PVDF膜和3 mm Whatman滤纸(Millipore);RevertAidTMFirst Strand cDNA SynthesisKit(Fermentas);ECL显色剂(Pierce)。
1.2 动物 雄性 Sprague-Dawley(SD)大鼠,清洁级,鼠龄20 d,由贵阳医学院实验动物中心提供。
2 方法
2.1 大鼠原代RTECs培养 SD大鼠股动脉放血处死后无菌取肾,分离、剪碎肾皮质,80目、100目网筛分离肾小管节段;加入0.25% 胰蛋白酶,37℃水浴消化25 min;不含血清的培养基终止消化,生理盐水洗3次,离心弃上清;加入含有10%FBS的低糖DMEM培养液,接种于25 cm2培养瓶中,置37℃、5%CO2孵育箱培养。72 h后全量更换培养液,生长近融合时以1∶2传代,经鉴定为RTECs后继续培养,实验采用第3代细胞。
2.2 实验分组 细胞生长融合至约90%时,换无血清DMEM培养基培养24 h,使细胞生长同步。将细胞分为(1)对照组:DMEM+2%FBS培养;(2)高渗组:19.5 mmol/L D-mannitol+DMEM+2%FBS培养;(3)高糖组:19.5 mmol/L D-glucose+DMEM+2%FBS 培养;每组设 30 min、2 h、12 h、24 h、48 h、72 h和96 h 7个时点进行观察。
2.3 siRNA转染及分组 第3代肾小管上皮细胞按2×108/L浓度接种于含10%FBS、无抗生素的低糖DMEM培养液的6孔细胞培养板中,使得在转染当天细胞达到60% -80%融合;分为:(1)对照组:DMEM(含糖5.5 mmol/L)+2%FBS培养;(2)高糖组:19.5 mmol/L D-glucose+DMEM+2%FBS培养;(3)control siRNA组:转染 control siRNA,24 h后换为19.5 mmol/L D-glucose+DMEM+2%FBS培养;(4)SnoN siRNA组:转染SnoN siRNA,24 h后换为19.5 mmol/L D-glucose+DMEM+2%FBS培养。转染步骤按试剂盒操作说明进行,重复3次实验。
2.4 免疫荧光和免疫细胞化学 细胞爬片经4%多聚甲醛固定,0.5%Triton X-100打孔,3%H2O2去除内源性过氧化物酶,血清封闭后,分别加入抗CK-18(1∶100),E - cadherin(1∶200),FN(1∶50)和SnoN(1∶300)抗体,4℃孵育过夜。免疫荧光细胞化学加入生物素化Ⅱ抗(1∶100),37℃孵育40 min;滴加 SABC -FITCⅢ抗(1∶100),37 ℃孵育30 min,LEICA DMLS荧光显微镜观察并采集图像。免疫细胞化学加入生物素化Ⅱ抗(即用型),室温下孵育40 min;滴DAB显色。PBS代替Ⅰ抗,作阴性对照。
2.5 Western blotting 加裂解液裂解细胞,离心取上清,BCA法测蛋白浓度。加样缓冲液变性蛋白,上样,经SDS-PAGE垂直凝胶电泳后,电转移至聚偏二氟乙烯 (polyvinylidene difuoride,PVDF)膜。5%脱脂奶粉室温封闭2 h,含0.05%Tween 20的TBS(TBST)冲洗后,用特异性抗体进行孵育,Ⅰ抗浓度如下:SnoN(1∶400)、FN(1∶100)、CK -18(1∶200)、E -cadherin(1∶200)、α - SMA(1∶100)和 β - actin(1∶400);4℃过夜。经TBST冲洗后加入辣根过氧化物酶标记的Ⅱ抗,室温孵育90 min。TBST冲洗,ECL显影曝光,Bio-Rad凝胶成像系统进行图像采集,Quantity One 4.6软件分析各阳性条带的积分灰度值,设内参照β-actin,计算各目标蛋白的相对表达量。
2.6 RT-PCR 采用Trizol试剂盒提取细胞RNA,琼脂糖凝胶电泳鉴定RNA的完整性,核酸蛋白仪测定RNA的浓度和纯度。取3 μg逆转录合成cDNA,进行半定量PCR反应。PCR引物序列:SnoN(500 bp)上游引物5’-GAAAACCTCCAGTCTAAGTTCTCCTTAGTT-3',下游引物 5’-ATGAAGCTGGTCTGAAGTACACCTTGAACA-3';相应 β-actin(306 bp)上游引物 5'-TGGCATTGTGATGGACTC -3',下游引物 5'-CCGATAGTGATGACCTGAC-3'。FN(255 bp)上游引物 5'-GGACACTATGCGGGTCACTT-3',下游引物 5'-TCAAAACCAGTTGGGGAGTC -3';相应β-actin(490 bp)上游引物5'-GAAATCGTGCGTGACATTAAG -3',下游引物 5'-CTAGAAGCATTTGCGGTGGA-3'。PCR产物经1.5%琼脂糖凝胶电泳,Bio-Rad凝胶成像系统扫描,Quantity One 4.6软件分析各条带积分吸光度值,mRNA的相对表达量用目标mRNA/β-actin的积分吸光度值表示。
3 统计学处理
结 果
1 大鼠原代RTECs的鉴定
倒置显微镜下可见,体外培养的原代RTECs长势良好,第3 d即形成明显集落,形态呈典型的多边鹅卵石样,见图1。用上皮细胞的标志性蛋白E-cadherin和CK-18及间质细胞的标志性蛋白α-SMA对实验所用3代细胞进行鉴定。免疫荧光和Western blotting结果均显示,3代细胞E-cadherin和CK-18蛋白表达阳性,见图2,且几乎看不到α-SMA蛋白表达,见图3,说明培养细胞为大鼠原代RTECs。
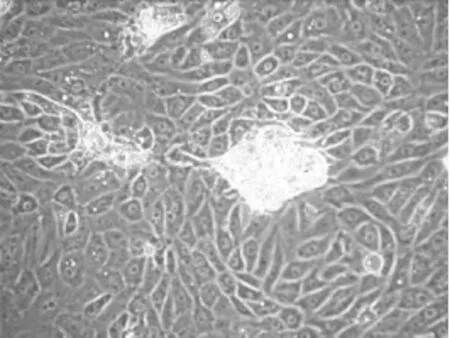
Figure 1.The third day of primary culture(×400).图1 原代培养第3 d

Figure 2.Expressions of E -cadherin and CK -18 in primary cultured RTECs(SABC,×400).NC:negative control.图2 E-cadherin和CK-18在原代培养RTECs中的表达
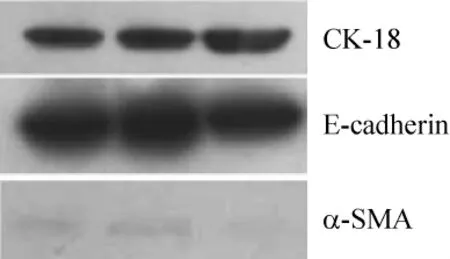
Figure 3.Expressions of E -cadherin,CK -18 and α -SMA in primary cultured RTECs.图3 E-cadherin、CK-18和α-SMA在原代培养RTECs中的表达
2 不同处理组RTECs中SnoN蛋白表达
用高糖及甘露醇刺激大鼠原代RTECs 30 min-96 h,免疫荧光细胞化学和Western blotting检测SnoN蛋白表达。结果显示,RTECs胞浆和胞核均有SnoN表达,见图4;高糖刺激2 h SnoN蛋白表达减少(P<0.05),且呈时间依赖性;甘露醇刺激72 h出现SnoN蛋白表达减少,但仍显著高于高糖组(P<0.01),见图5。
3 FN蛋白和mRNA在不同处理组RTECs中的表达
免疫细胞化学染色结果显示,FN蛋白在RTECs中主要表达于细胞质,见图6。
Western blotting结果表明,与正常糖对照组相比,高糖培养原代RTECs 30 min FN蛋白表达即显著增多,持续至高糖培养96 h;高渗培养12 h出现FN蛋白表达增多,但仍显著低于高糖组,见图7。
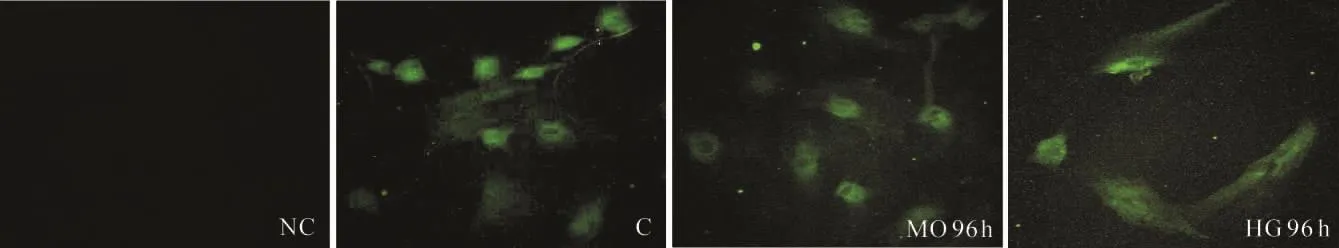
Figure 4.Expression of SnoN protein in primary cultured RTECs after incubated with normal-glucose,mannitol and high-glucose medium(SABC,×400).NC:negative control;C:control;MO:mannitol;HG:high glucose.图4 不同条件培养原代RTECs中SnoN蛋白表达

Figure 5.Expression of SnoN protein in primary cultured RTECs after incubated with normal-glucose,mannitol and high-glucose medium at different time points.*P < 0.05,**P <0.01 vs control;##P <0.01 vs mannitol.图5 SnoN蛋白在不同处理组原代RTECs中的表达
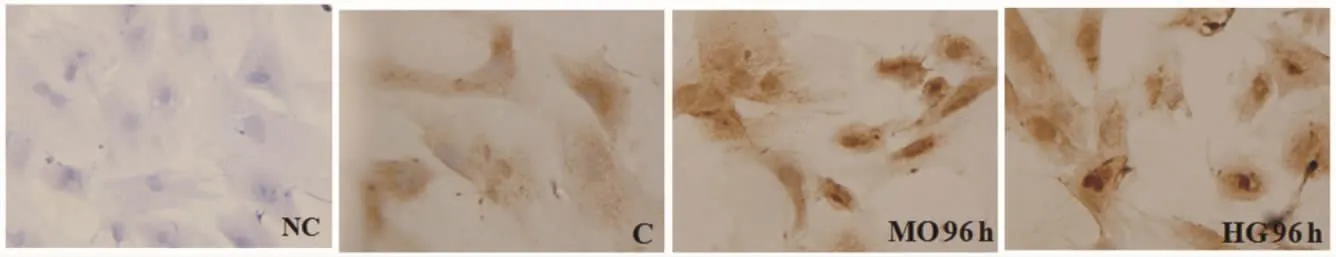
Figure 6.Expression of FN protein in primary cultured RTECs after incubated with different conditions(SABC,×400).NC:negative control;C:control;MO:mannitol;HG:high glucose.图6 不同条件培养原代RTECs中FN蛋白表达
RT-PCR结果显示:高糖培养原代RTECs 30 min即能促进FN mRNA表达,并随高糖培养时间延长,FN mRNA表达持续增多;高渗处理2 h出现FN mRNA表达增多,但从24 h起各时点仍显著少于高糖培养组,见图8。
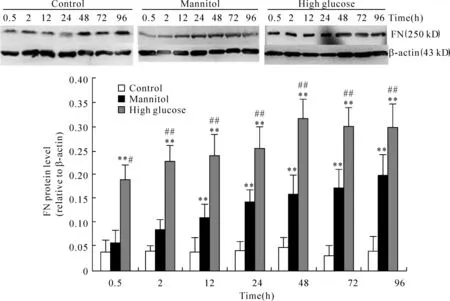
Figure 7.Expression of FN protein in primary cultured RTECs after incubated with normal-glucose,mannitol and high-glucose medium at different time points.**P < 0.01 vs control;##P <0.01 vs mannitol.图7 FN蛋白在不同处理组原代RTECs中的表达
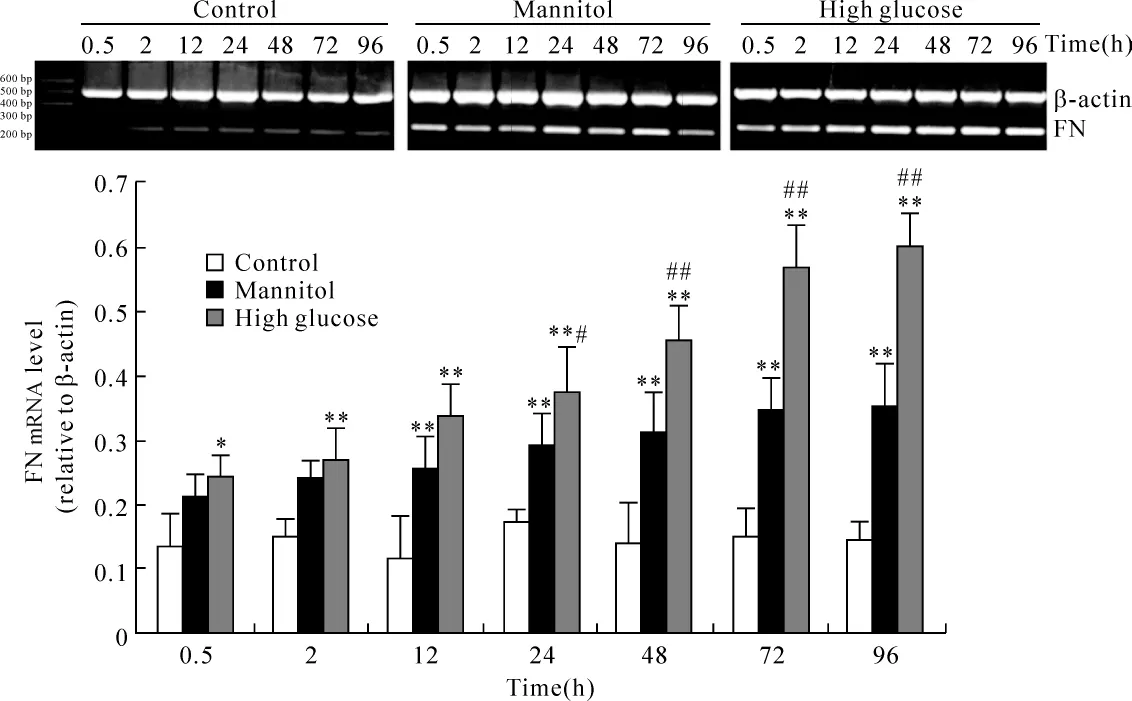
Figure 8.Expression of FN mRNA in primary cultured RTECs after incubated with normal-glucose,mannitol and high-glucose medium at different time points.*P <0.05,**P <0.01 vs control;#P <0.05,##P <0.01 vs mannitol.图8 FN mRNA在不同处理组原代RTECs中的表达
4 siRNA 转染效率检测
转染绿色荧光标记control siRNA的肾小管上皮细胞内可见绿色荧光表达,并位于细胞核位置,提示siRNA已转染至细胞内,见图9。
RTECs转染 control siRNA和 SnoN siRNA后,control siRNA转染组SnoN蛋白和mRNA与未转染RTECs相比差异无显著;与未转染 RTECs相比,SnoN siRNA转染组SnoN蛋白和mRNA水平分别下降48.63%和54.41%,见图10。
5 转染SnoN siRNA对高糖培养RTECs SnoN蛋白表达的影响
RTECs成功转染SnoN siRNA后给予高糖条件培养,分别于培养30 min、2 h、12 h、24 h 和 48 h 收集细胞蛋白,Western blotting检测各时点SnoN蛋白的表达。结果显示,随高糖培养时间延长SnoN蛋白表达减少,至48 h时几乎检测不到SnoN蛋白表达,见图11。
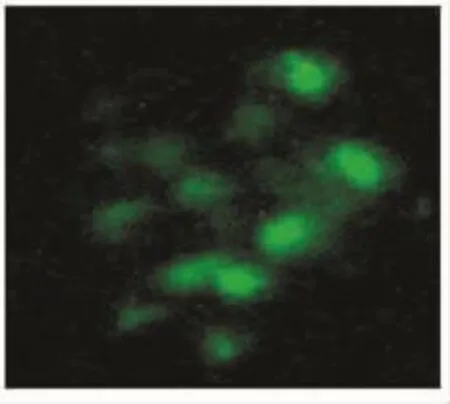
Figure 9.Fluorescein-conjugated control siRNA was used to transfect the primary cultured RTECs.图9 转染fluorescein conjugated control siRNA的原代RTECs
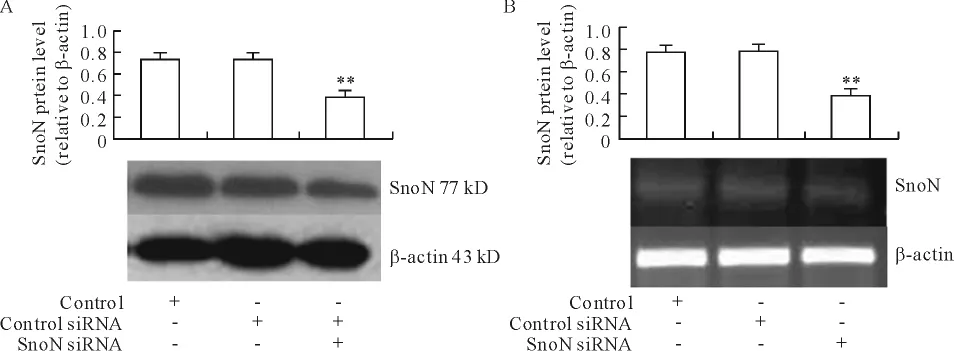
Figure 10.The protein(A)and mRNA(B)levels of SnoN in RTECs transfected by SnoN siRNA.±s.n=3.**P<0.01 vs control.图10 肾小管上皮细胞转染SnoN siRNA后SnoN蛋白(A)和mRNA(B)表达水平
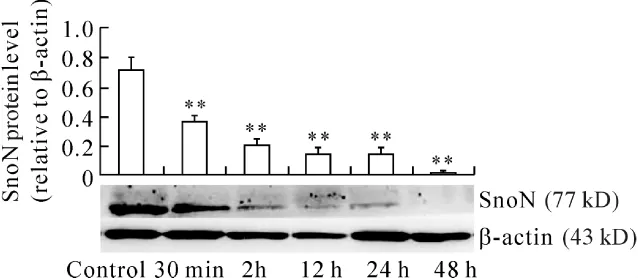
Figure 11.Expression of SnoN protein in RTECs transfected by SnoN siRNA as incubated with high glucose.±s.n=3.**P <0.01 vs control group.图11 高糖培养转染SnoN siRNA RTECs中SnoN蛋白的表达
6 SnoN siRNA转染对高糖培养RTECs FN蛋白表达的影响
Western blotting结果表明,高糖显著上调RTECs中FN蛋白表达,转染SnoN siRNA后高糖诱导的FN蛋白表达进一步增多,与单纯高糖培养相比增加68.53%,见图12。
讨 论
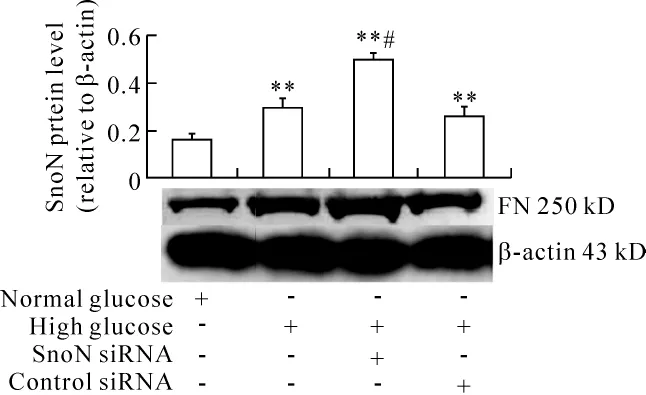
Figure 12.Expression of FN protein in RTECs transfected by SnoN siRNA as incubated with high glucose.±s.n=3.**P < 0.01 vs control;#P < 0.05 vs high glucose.图12 高糖培养转染SnoN siRNA RTECs中FN蛋白的表达
随着对肾间质纤维化机制研究的加深,RTECs在其中的作用日益被重视。目前已证明,RTECs的转分化、增生及凋亡等均参与了肾间质纤维化过程。因此,研究RTECs形态和功能的异常变化,对阐明肾间质纤维化发病机制有重要作用。当前,国内外对于RTECs的研究大多采用细胞株,但进行生物学研究时,原代培养的RTECs更能反应其在体内的生长特性。本研究参考国内外文献报道[4,5],并在本课题组前期培养基础上加以改进,原代细胞呈明显的上皮细胞生长特性,E-cadherin和CK-18蛋白表达阳性,且未见 α-SMA蛋白表达,表明大鼠原代RTECs培养成功。
我们用高糖处理原代培养的RTECs,并用相同浓度的甘露醇作为对照,以排除渗透压的影响。动态观察结果发现,SnoN和FN蛋白均有表达于肾小管上皮细胞,与正常糖对照组相比,高糖培养2 h起肾小管上皮细胞中SnoN蛋白表达开始减少,且呈时间依赖性,至96h时只有少量表达。我们的体外研究还发现,高糖在降低SnoN蛋白表达的同时能促进FN蛋白和mRNA表达,且对SnoN蛋白和FN表达的影响显著高于渗透压对照组。以上结果提示,高糖是引起RTECs SnoN蛋白表达减少的主要原因;随着SnoN蛋白表达减少,RTECs中FN蛋白和mRNA表达增加。
有关SnoN的研究,目前多集中于其与肿瘤发生的关系上[6-9],Yang 等[10]研究报道 SnoN 蛋白表达减少在单侧输尿管梗阻(unilateral ureteral obstruction,UUO)所致肾纤维化的发生中起重要作用。我们前期的研究结果提示,SnoN蛋白表达减少在糖尿病大鼠肾小管-间质纤维化发病过程中可能起着重要作用[1-3]。但无论是在UUO还是DN肾纤维化发病过程中,SnoN蛋白表达减少是通过那些途径引起肾小管-间质纤维化的,以及其与肾间质纤维化的那些成份有关,目前仍不甚清楚。
本实验中用fluorescein conjugated control siRNA作为对照,通过荧光显微镜观察到绿色荧光主要分布于细胞核及核周区,初步推断SnoN siRNA导入细胞,并进入了细胞核。但进入细胞内的SnoN siRNA是否对SnoN基因有抑制作用,还需对转染细胞进行检测。本研究通过RT-PCR和Western blotting进行检测,显示转染 SnoN siRNA的 RTECs与正常RTECs相比,SnoN mRNA和蛋白的表达分别下降54.41%和48.63%,而转染 control siRNA不影响RTECs SnoN mRNA和蛋白表达,说明本实验siRNA技术对SnoN基因表达抑制的有效性。
用高糖培养转染SnoN siRNA的原代RTECs,结果发现随培养时间延长SnoN蛋白表达减少,至高糖培养48h时几乎检测不到SnoN蛋白表达,进一步证实了高糖能抑制RTECs SnoN蛋白表达。我们前期研究发现,随糖尿病大鼠肾组织中SnoN蛋白表达减少,对致纤维化细胞因子转化生长因子-β1的抑制作用减弱,FN蛋白表达增加,细胞基质沉积增多,肾小管-间质纤维化病变加重[2]。但在DN发生发展中SnoN是否参与了FN表达的调控,以及SnoN表达减少在肾小管-间质纤维化发生发展中的作用是否与FN有关,尚不清楚。本次实验显示,与单纯高糖培养组相比,高糖诱导的肾小管FN的表达在SnoN siRNA转染细胞中显著增多。这些结果说明SnoN表达减少参与了高糖诱导的RTECs中FN合成过程,SnoN表达下调所引起的DN肾小管-间质纤维化与RTECs中FN的表达增多有关。
由于肾小管-间质纤维化的严重性与DN预后密切相关,但DN发病机制至今尚未完全阐明,且缺乏有效的治疗措施。而本研究发现SnoN蛋白表达减少参与了高糖环境下肾小管-间质纤维化主要成份FN的合成过程,将有助于进一步阐明DN的发病机制,并为药物开发提供新的靶点。
[1]刘瑞霞,郭 兵,崔 龙,等.SnoN蛋白在糖尿病大鼠肾组织中的表达及其意义[J].中国病理生理杂志,2008,24(6):1188-1192.
[2]刘瑞霞,郭 兵,肖 瑛,等.SnoN和Smad2/3信号蛋白与糖尿病大鼠肾小管-间质纤维化的关系[J].基础医学与临床,2010,30(9):944-951.
[3]刘瑞霞,郭 兵,肖 瑛,等.糖尿病大鼠肾组织Smurf2的表达及其与SnoN蛋白降解的关系[J].中国病理生理杂志,2010,26(9):1734-1737.
[4]Weiland C,Ahr HJ,Vohr HW,et al.Characterization of primary rat proximal tubular cells by gene expression analysis[J].Toxicol In Vitro,2007,21(3):466 -491.
[5]de Graauw M,Le Dévédec S,Tijdens I,et al.Proteomic analysis of alternative protein tyrosine phosphorylation in 1,2-dichlorovinyl-cysteine-induced cytotoxicity in primary cultured rat renal proximal tubular cells[J].J Pharmacol Exp Ther,2007,322(1):89 -100.
[6]Krakowski AR,Laboureau J,Mauviel A,et al.Cytoplasmic SnoN in normal tissues and nonmalignant cells antagonizes TGF-β signaling by sequestration of the Smad proteins[J].Proc Natl Acad Sci USA,2005,102(35):12437-12442.
[7]Hsu YH,Sarker KP,Pot I,et al.Sumoylated SnoN represses transcription in a promoter - specific manner[J].J Biol Chem,2006,281(44):33008-33018.
[8]Pot I,Bonni S.SnoN in TGF - β signaling and cancer biology[J].Curr Mol Med,2008,8(4):319 -328.
[9]Bravou V,Antonacopoulou A,Papadaki H,et al.TGF-β repressors SnoN and Ski are implicated in human colorectal carcinogenesis[J].Cell Oncol,2009,31(1):41 -51.
[10]Yang JW,Zhang XH,Li YH,et al.Downregulation of Smad transcriptional corepressors SnoN and Ski in the fibrotic kidney:an amplification mechanism for TGF-β1 signaling[J].J Am Soc Nephrol,2003,14(12):3167 -3177.
