L-电压门控钙通道在糖尿病大鼠局灶性脑缺血中的变化及意义*
2011-09-14张文杰郑昭石
邢 影, 张文杰, 方 芳, 郑昭石
(1吉林大学中日联谊医院神经内科,吉林长春130033;2吉林大学白求恩医学部生理教研室,吉林长春130021)
脑缺血损伤机制之一是细胞内钙超载,研究表明引起细胞内钙超载的原因除细胞本身的变化外,还有电压门控性钙通道和N-甲基-D-天冬氨酸受体(N-methyl-D-aspartate receptor,NMDAR)依赖性钙通道的参与[1,2],然而对NMDAR拮抗剂的脑保护作用研究不尽人意[3],使学者们的视线重新回到电压门控性钙通道和寻找其它类型的离子通道上。糖尿病是脑梗死独立的危险因素之一。糖尿病基础上的脑梗死症状重、多进展,预后差,但其确切机制尚不清楚,目前相关研究较少。本研究从离子通道角度研究糖尿病加重脑梗死的可能机制,对进一步加深糖尿病合并脑梗死的认识及进一步有效地干预具有重要意义。
材料和方法
1 动物、分组及主要试剂
雄性Wistar大鼠50只,体重220-240 g,由吉林大学基础医学院动物实验中心提供。
1.1 分组 糖尿病组25只,正常组25只;根据局灶性脑缺血时间分为正常假手术组和单纯缺血1 h、3 h、6 h、24 h组,每组5只;糖尿病假手术组和糖尿病局灶性缺血1 h、3 h、6 h、24 h 组,每组 5 只;共 10组。
1.2 主要试剂 链脲佐菌素(streptozotocin,STZ)和链霉蛋白酶(pronase)购自Sigma,人工脑脊液及记录钙通道电流的细胞内、外液为自配。
2 模型建立
2.1 糖尿病大鼠模型建立 高脂饮食4周后,参考文献[4]并按照试剂说明,制备pH=4.2的柠檬酸缓冲液。按30 mg/kg称取STZ,溶于柠檬酸缓冲液中,快速腹腔注射。7 d后尾静脉取血,测空腹血糖≥16.7 mmol/L为造模成功。血糖高于30 mmol/L剔除实验,随机补充。
2.2 局灶脑缺血(middle cerebral artery occlusion,MCAO)模型的建立 MCAO模型以 Zea-Longa等[5]法为标准,选用尼龙线栓塞左侧大脑中动脉。10%水合氯醛腹腔注射麻醉,颈部正中切口,找出左颈总动脉(left common carotid artery,LCCA)并游离,沿左侧颈总动脉向头端分离颈内、外动脉。分离翼额动脉并在其根部结扎。在颈总与颈内外动脉分叉处剪一小口,用0.28 mm的尼龙线插至颅内,深约(18.0±0.5)mm,直至左侧大脑前动脉,引起局灶性脑缺血。待动物清醒后,观察神经系统症状以判断手术是否成功。参考文献[5]的5分制法进行评分。0分:无神经损伤症状;1分:不能完全伸展对侧前爪;2分:向对侧转圈;3分:向对侧倾倒;4分:不能自发行走,意识丧失;5分:死亡。分值越高,说明动物症状越严重。造模成功的判定标准:以大鼠手术麻醉清醒后出现右侧肢体瘫痪,站立不稳,提尾时向右侧转圈为模型成功的判断标准。1-3分为纳入标准,0分、4分或死亡剔除,缺少的随机补充。实验中选取脑缺血24 h的大鼠进行神经功能评分。
3 大鼠脑皮层神经元的急性分离
[6]于各时点大鼠断头取脑 ,快速移入冰冷(0-4℃)的孵育液中30-60 s,冷却后在冰盘上取左侧大脑半球缺血周围组织,以振动切片机切成400-600 μm脑薄片,取皮层置于盛有孵育液中。室温下孵育50 min,孵育过程中通入95%O2+5%CO2的混合气后,移入浓度为0.4 g/L含有pronase的消化液中,32℃ 水浴消化30 min后用孵育液洗标本3次,移入另一个盛有孵育液的干净烧杯中,依次用口径递减的3个吸管轻轻吹打,制成单细胞悬液 ,竖直静置约5 min,吸取上部细胞悬液 ,加入培养皿内,约30 min细胞贴壁后用于实验研究。
4 全细胞膜电流记录方法
自配全细胞钙通道电流所使用的浸溶液为(mmol/L):TEA - Cl 135,BaCl210,HEPES 10,葡萄糖10,pH用 TEA-OH 调整为7.4。电极溶液为(mmol/L):CsCl 130,MgCl21,EGTA 8,TEA - Cl 4,HEPES 4,ATP-Mg 4,磷酸肌酸 10,GTP -Li40.1,pH用TEA-OH调整为7.2。用两次拉制法将毛坯拉成微电极,冲灌电极液后,电阻范围为5-10 MΩ。将微电极缓缓插入浴液,接触神经元细胞,当电极尖端与细胞膜表面形成1-5 GΩ封接电阻时,用力吸破电极尖端上的膜片,形成全细胞记录。用Pclamp 6.03软件,经数/模 (1200 D/A,AXON)转换卡,通过膜片钳放大器(CEZ-2400)钳制细胞的膜电位,记录不同电压条件下的离子通道电流(从-50到+60,每次阶跃10 mV)。实验中电流的记录在全细胞方式稳定5 min后进行。并应用Pclamp 6.03软件采样处理电流信号,采样频率为1 KHz,低通滤波器滤波频率为3 kHz。细胞膜电容记录方法:钳制电压为-80 mV,通过去极化脉冲使膜去极至-90 mV,时程为10 ms,通过积分计算得到单个细胞的膜电容。糖尿病脑缺血和单纯脑缺血各钙电流曲线来自不同细胞的不同时点,从保持点位阶跃至-10 mV的最大电流。为便于比较,将不同时点的变化曲线整合于同一平面中。
5 统计学处理
应用SPSS 11.0软件包,计量资料采用均数±标准差(±s)表示,组间比较用t检验;神经功能评分的组间比较用非参数检验,所得数据用平均秩表示。
结 果
1 血糖结果
糖尿病大鼠空腹血糖为(19.70±2.38)mmol/L,符合糖尿病诊断标准。
2 神经功能评分
对糖尿病局灶脑缺血24 h及单纯缺血24 h大鼠进行神经评价,结果显示糖尿病组大鼠术后清醒较晚,肢体偏瘫程度重于单纯缺血组,2组相比差异显著(P<0.05),见表1。

表1 单纯缺血与糖尿病局灶脑缺血24 h神经功能评分Table 1.Score of nerve function of rats in DM+MCAO and MCAO groups(n=8)
3 急性分离的大鼠皮层神经元细胞形态学鉴定
将急性分离后的贴壁细胞置于倒置显微镜(O-lympus)下,可以看到典型皮层神经元表面光洁,细胞胞体多呈锥形,有2-3个树突,且有一较长的轴突,见图1。根据神经元的形态可以断定分离的细胞为皮层神经元锥体细胞,选取形态饱满的细胞用于实验。
4 大脑皮层神经元细胞电压依赖性L-型钙通道电流的鉴定
Figure 1.The cortical neurons by acute isolation under inverted microscope(×40).图1 倒置显微镜下观察急性分离的皮层神经元
使用全细胞膜片钳技术,将分离的皮层神经元细胞钳制在-50 mV,阶跃命令为+10 mV,持续时间300 ms,钙通道在去极化至-30 mV时被激活,最大内向峰值钙电流在-10 mV为(11.02±2.02)pA/pF;向浸溶液灌流10 μmol/L nifedipin后,同样方法检测分离的神经元,结果发现在-10 mV为(7.08±2.08)pA/pF,可抑制大部分电流成分;相同的实验条件向浸溶液灌流Bay K 8466 1 μmol/L,检测分离完好的其他神经元,发现在-20 mV为(20.42±3.40)pA/pF,明显激活此电流,最大峰值电流向左偏移-10 mV,表明为L-型钙通道电流,与文献报道相符合[7],见图2(图中显示原始电流曲线为 -50、-30、-10、+10、+30、+50 mV 时对应的电流,其结果来自同一大鼠的不同细胞,电流电压关系曲线表示除以膜电容后的电流值)。
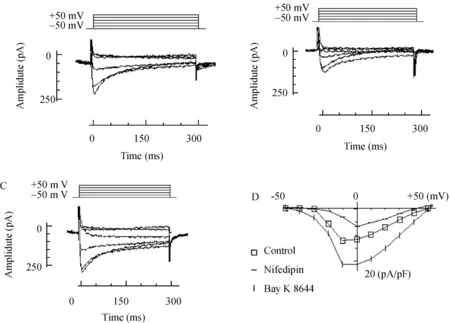
Figure 2.Primary current curves of calcium channel in cortex neurons of rats.A:control;B:nimodipine;C:Bay K 8644;D:I/V curves.图2 大鼠大脑皮层钙通道原始电流曲线
5 MCAO和DM+MCAO对大脑皮层神经元细胞L型电压依赖钙通道的影响
应用同样实验方法,实验记录了单纯缺血和糖尿病局灶脑缺血1、3、6和24 h缺血周围皮层神经元L型电压依赖钙通道电流的变化,表2所示,MCAO和DM+MCAO各组随着缺血时间延长,L-电压依赖型钙通道电流明显增高,与假手术组相比,P<0.05;其中DM+MCAO各组的L-电压依赖型钙通道电流分别高于MCAO各组(P<0.05),见图3、4。
表2 缺血各组大脑皮层神经元细胞电压依赖型钙通道电流(pA/pF)Table 2.L-type voltage-gated Ca2+channel current of cortical neurons in ischemia groups(pA/pF.±s.n=8)
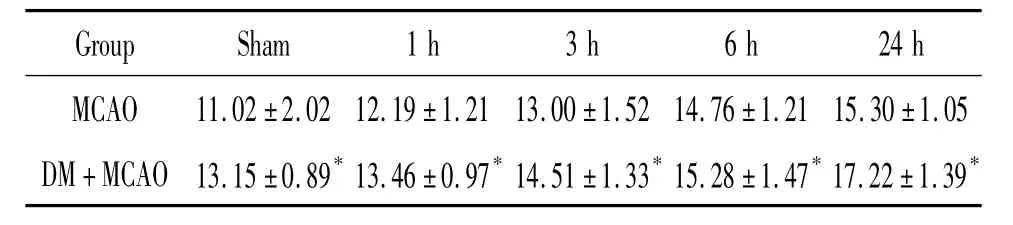
表2 缺血各组大脑皮层神经元细胞电压依赖型钙通道电流(pA/pF)Table 2.L-type voltage-gated Ca2+channel current of cortical neurons in ischemia groups(pA/pF.±s.n=8)
*P<0.05 vs MCAO.
Group Sham 1 h 3 h 6 h 24 h MCAO 11.02 ±2.02 12.19±1.2113.00 ±1.52 14.76±1.21 15.30±1.05 DM+MCAO 13.15 ±0.89*13.46±0.97*14.51 ±1.33*15.28±1.47*17.22±1.39*
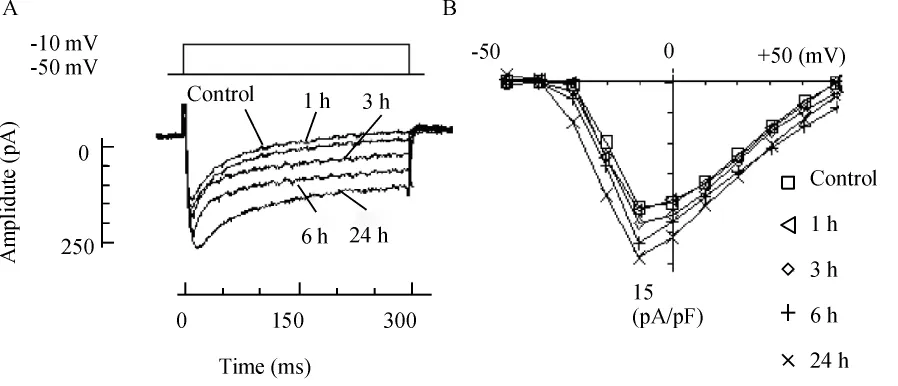
Figure 3.Influence of different time of MCAO on calcium channel of cerebral cortex in rats.A:Ca2+channel current curves during different time of MCAO;B:I/V curves.图3 单纯缺血不同时间对大鼠大脑皮层钙通道电流曲线的影响
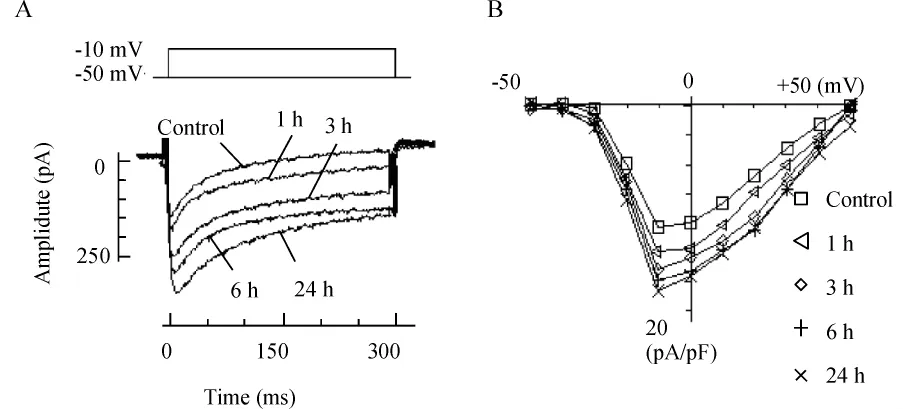
Figure 4.Influence of different time of MCAO on calcium channel of cerebral cortex in DM rats.A:Ca2+channel current curves during different time of MCAO in DM rats;B:I/V curves.图4 糖尿病大鼠局灶性脑缺血不同时间对大鼠大脑皮层钙通道电流曲线的影响
讨 论
细胞膜上分布着多种离子通道,感知细胞内外的各种变化,使通道处于开放/失活状态。L-型电压门控钙通道(L -type voltage-gated calcium channels,L-VGCCs)广泛分布于中枢神经系统,通过细胞膜上动作电位与梯度电位的变化调节钙通道,使胞外的钙离子进入细胞内,进行神经元之间信息交流,因此被认为是介导神经元钙内流的主要途径[8]。正常情况下内流的钙参与多种细胞功能调控,而L-VGCCs的过度开放可以引起细胞内的钙超载,触发Ca2+依赖的级联反应[9],加重细胞损伤。
本研究应用全细胞膜片钳技术记录了单纯局灶脑缺血不同时间缺血周边皮层神经元钙通道电流的变化,结果显示单纯局灶脑缺血各组中随着缺血时间的延长,L型电压门控钙离子通道的Ca2+电流逐渐增大,Ca2+电流I-V曲线明显下移,各组间比较P<0.05,Ca2+电流的增大加重了细胞内的钙内流,引起细胞损伤,这与文献报道相一致[10],再次证明了L-VGCCs的过度开放参与了脑缺血损伤。
应用同样方法,我们记录了糖尿病大鼠局灶脑缺血不同时间缺血周边皮层神经元钙通道电流的变化,结果显示糖尿病脑缺血各组中随着缺血时间的延长,L型电压门控钙离子通道的Ca2+电流逐渐增大,Ca2+电流I-V曲线明显下移,各组间比较P<0.05,与单纯局灶脑缺血各组相比,糖尿病脑缺血各组Ca2+电流逐渐增大,相同时点2组间比较P<0.05,说明糖尿病脑缺血时L-VGCCs通道开放明显高于单纯缺血组,且与缺血时间长短呈正相关。
Wang等[11]的一项关于缺氧条件下肺动脉细胞信号转导机制的研究中发现ROS增加可以抑制电压依赖钾通道、增加钙通道的活性;Amberg等[12]一项最新研究表明自由基的增加导致了蛋白激酶C活性的增强,使局部的L-VGCCs激活,增加钙内流,说明氧化应激损伤促进了L-VGCCs的开放。我们前期工作中证实在糖尿病局灶脑缺血时AGEs、RAGE表达增加[13],而AGEs增加的结果则使自由基生成增多[14]。因此,我们可以得出如下结论:糖尿病脑缺血时L-VGCCs过度开放、Ca2+电流增大引起细胞内钙超载加重,这可能是糖尿病脑缺血损伤加重的机制之一,原因与氧化应激损伤有关,然而氧化应激如何参与L-VGCCs过度开放则需在以后的研究中进一步明确。
[参 考 文 献]
[1]高菁华,汤 浩.钙通道的分类和几种主要钙通道的功能[J].日本医学介绍,2005,26(5):232-235.
[2]李 萌,鲁宏标,邱天竹.缺血性脑中风钙依赖性激活Raf-1/ERK的级联机制研究[J].中国病理生理杂志,2009,25(9):1752- 1755.
[3]Hoyte L,Barber PA,Buchan AM,et al.The rise and fall of NMDA antagonists for ischemic stroke[J].Curr Mol Med,2004,4(2):131 -136.
[4]Rees DA,Alcolado JC.Animal models of diabetes mellitus[J].Diabet Med,2005,22(4):359 -370.
[5]Zea - Longa EL,Weisein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without craniotomy in rats[J].Stroke,1989,20(1):84 - 91.
[6]王中峰,薛春生,肖家思.大鼠皮层神经元膜片钳单通道记录模型[J].第三军医大学学报,1997,19(3):272-274.
[7]宁 可,王正国,朱佩芳,等.新生大鼠培养神经元电压依赖性钙通道的膜片钳记录[J].第三军医大学学报,1996,18(4):367 -368.
[8]Guo ZH,Li F,Wang WZ.The mechanisms of brain ischemic insult and potential protective interventions[J].J Neurosci Bull,2009,25(3):139 -152.
[9]侯筱宇,张光毅.中枢神经系统L-型电压门控钙通道的功能调控与脑缺血[J].生理科学进展,2004,35(1):77-80.
[10]唐 瑜,罗荣敬,周乐全.脑缺血再灌注损伤对大鼠海马神经元L-型钙通道的影响[J].中国病理生理杂志,2008,24(5):1030-1033.
[11]Wang YX,Zheng YM.ROS-dependent signaling mechanisms for hypoxic Ca2+responses in pulmonary artery myocytes[J].Antioxid Redox Signal,2010,12(5):611 -623.
[12]Amberg GC,Earley S,Glapa SA.Local regulation of arterial L-type calcium channels by reactive oxygen species[J].Circ Res,2010,107(8):1002 -1010.
[13]邢 影,常 颖,王 捷,等.糖尿病大鼠局灶脑缺血AGEs及其受体的表达[J].中国老年学杂志,2009,29(5):565-566.
[14]Su J,Lucchesi PA,Gonzalez-Villalobos RA.Role of advanced glycation end products with oxidative stress in resistance artery dysfunction in type 2 diabetic mice[J].Arterioscler Thromb Vasc Biol,2008,28(8):1432 -1438.
