NKX3.1下调前列腺癌PC-3细胞中抗凋亡基因bcl-2的表达*
2011-09-14陈兆波刘春艳倪娜娜张鹏举陈蔚文崔福爱姜安丽
陈兆波, 刘春艳, 倪娜娜, 于 洋, 张鹏举, 陈蔚文, 崔福爱, 姜安丽
(山东大学医学院生物化学与分子生物学研究所,山东济南250012)
NKX3.1是前列腺特异性和雄激素调控的同源框基因[1],它与前列腺的发育、成熟[2,3]及前列腺癌的发生发展密切相关[4]。NKX3.1基因位于染色体8p21区域[5],基因全长约 4 223 bp,具有 2 个外显子,1个内含子,编码234个氨基酸,其表达产物属于核转录因子。大约80%的前列腺癌细胞会杂合缺失该区域[6,7],它的表达缺失与前列腺癌的发生发展有关,而且决定了肿瘤发生的组织特异性,这表明NKX3.1可能是一种潜在的抑癌基因[8]。研究认为NKX3.1蛋白可能是通过激活caspase凋亡途径,及诱导凋亡抑制基因bcl-2的表达,起到诱导前列腺癌细胞凋亡的作用[9],但NKX3.1在前列腺癌发生发展中的确切作用机制仍不清楚。本实验将NKX3.1真核表达载体pcDNA3.1-NKX3.1转染前列腺癌PC-3细胞,研究NKX3.1对抗凋亡基因bcl-2表达的影响及对前列腺癌细胞凋亡的作用,为进一步研究NKX3.1在前列腺肿瘤中的作用奠定基础。
材料和方法
1 主要材料
pcDNA3.1载体、Trizol试剂和质粒抽提试剂盒购于Invitrogen;Taq酶和PCR试剂盒购于大连宝生物工程公司;M-MuLV逆转录酶和快速凝胶回收试剂盒购于Fermentas;大肠杆菌JM109由本室保存;NKX3.1真核表达载体pcDNA3.1-NKX3.1由本课题组克隆构建[9];前列腺癌PC-3细胞株购于中科院上海细胞所;鼠抗人Bcl-2购于Santa Cruz,羊抗鼠IgG购于北京中衫金桥;RPMI-1640培养基购于HyClone;胎牛血清购于四季青公司;其余为国产分析纯。
2 方法
2.1 细胞培养 前列腺癌PC-3细胞生长于含有10%胎牛血清、1×105U/L青霉素及1×105U/L链霉素的RPMI-1640培养基,在37℃、5%CO2条件下培养。
2.2 细胞转染 前列腺癌PC-3细胞以5×108/L接种于50 mL培养瓶中。当细胞融合度>90%时,按照FuGENE® HD转染试剂说明将pcDNA3.1-NKX3.1载体转染 PC -3细胞(PC3-NKX3.1+),对照组将相同剂量pcDNA3.1空载体转染PC-3细胞(PC3 -NKX3.1-),每瓶以 16 μL FuGENE® HD 转染试剂+8 μg质粒DNA+4 mL 10%胎牛血清RPMI-1640培养基转染。
2.3 RT-PCR检测bcl-2 mRNA的表达 前列腺癌PC-3细胞在转染 pcDNA3.1-NKX3.1载体或pcDNA3.1空载体48 h后,用Trizol一步法提取细胞总RNA,使用随机六聚体引物和M-MuLV逆转录酶将细胞总RNA逆转录为cDNA,以cDNA为模板,PCR扩增bcl-2 mRNA片段(304 bp)。PCR引物正义链5’-GTGGAGGAGCTCTTCAGGGA -3’,反义链5’-AGGCACCCAGGGTGATGCAA-3’。内参照 β-actin正义链5’-GTGGGGCGCCCCAGGCACCA-3’,反义链 5’-CTCCTTAATGTCACGCACGATTT-3’,扩增β-actin片段550 bp。PCR反应条件相同,1.5%琼脂糖凝胶电泳检测PCR产物,凝胶成像系统采集图像。
2.4 Western blotting检测Bcl-2蛋白表达 前列腺癌PC-3细胞在转染pcDNA3.1-NKX3.1载体或pcDNA3.1空载体48 h后,用细胞裂解液(50 mmol/L Tris- HCl,pH 8.0,150 mmol/L NaCl,0.1%SDS,1%NP-40,1×蛋白酶抑制剂)收集细胞总蛋白。BCA法定量后,Ⅰ抗为1∶200稀释的鼠抗Bcl-2,Ⅱ抗为1∶2 000稀释的HRP标记的羊抗鼠IgG。以β-actin为内参照,加入ECL显色剂显色,暗室中曝光X光片观察。
2.5 EMSA检测 NKX3.1与bcl-2基因上游调控区中的NKX3.1结合元件相互作用 前列腺癌PC-3细胞在转染pcDNA3.1-NKX3.1载体或空载体48 h后,收集细胞,制备细胞核蛋白。通过分析软件MatInspector 2.2检测在 bcl-2基因启动子上游-1 146 bp至-1 153 bp处有一个NKX3.1结合元件序列(nucleotide-binding site,NBS),人工合成双拷贝NBS及互补链,NBS正义链为ATACCAAGTATTTATACCAAGTATTT(双拷贝)。以TEN缓冲液(10 mmol/L Tris,1 mmol/L EDTA,0.1 mmol/L NaCl,pH8.0)分别溶解NBS单链,等摩尔比混合2条单链,加热退火生成双链NBS,按Roche提供的DIG Gel Shift Kit说明,用末端转移酶对其进行末端地高辛标记,作为EMSA检测中的探针。设置6个反应管:(1)标记探针不加核蛋白;(2)标记探针加核蛋白;(3)标记探针加核蛋白及125倍过量的未标记的同源探针;(4)标记探针加核蛋白及125倍过量的未标记的异源探针;(5)标记探针加核蛋白及NKX3.1抗体;(6)标记探针加转染空载体的PC-3核蛋白(作为阴性对照)。室温反应20 min,然后进行8%聚丙烯酰胺凝胶电泳,电转移凝胶条带至阳离子尼龙膜,加地高辛抗体及显影底物CSPD,曝光X光胶片,观察电泳迁移率的改变。
2.6 流式细胞术检测细胞凋亡 前列腺癌PC-3细胞在转染pcDNA3.1-NKX3.1载体或pcDNA3.1空载体48 h后,用胰酶消化收集细胞,70%预冷乙醇固定,4℃冰箱放置12 h以上,按照Sub-G1法以流式细胞仪检测凋亡细胞并分析细胞的周期分布。
2.7 Hoechst 33258染色检测细胞凋亡 前列腺癌PC-3细胞在转染pcDNA3.1-NKX3.1载体或pcDNA3.1空载体48 h后,使用Hoechst 33258凋亡检测试剂盒染色,紫外灯下激发,荧光显微镜下观察细胞凋亡形态,荧光成像系统采集图像。
结 果
1 NKX3.1下调bcl-2 mRNA的表达
结果显示,与转染pcDNA3.1载体对照组相比,转染pcDNA3.1-NKX3.1载体的PC-3细胞中 bcl-2 mRNA的表达明显下降,见图1。

Figure 1.The effects of NKX3.1 on the expression of bcl- 2 mRNA in PC -3 cells.M:marker;1:PC -3(NKX3.1-);2:PC-3(NKX3.1+).±s.n=3.*P <0.05 vs PC -3(NKX3.1-).图1 NKX3.1对PC-3细胞中Bcl-2 mRNA表达的影响
2 NKX3.1下调Bcl-2蛋白的表达
结果显示,与转染pcDNA3.1载体对照组相比,转染pcDNA3.1-NKX3.1载体的PC-3细胞中Bcl-2蛋白的表达明显下降,见图2。

Figure 2.The effects of NKX3.1 on the expression of Bcl- 2 protein in PC -3 cells.1:PC -3(NKX3.1-);2:PC-3(NKX3.1+).±s.n=3.*P<0.05 vs PC-3(NKX3.1-).图2 NKX3.1对PC-3细胞中Bcl-2蛋白表达的影响
3 NKX3.1与bcl-2基因上游调控区中的NKX3.1结合元件相互作用
图3显示,转染 pcDNA3.1-NKX3.1的 PC -3细胞核提取液中具有与NBS结合的蛋白(3泳道),此结合可被同源序列竞争抑制 (4泳道),而不被异源序列竞争抑制(5泳道),并可被特异的NKX3.1抗体阻断(6泳道)。PC-3细胞不表达NKX3.1蛋白,转染pcDNA3.1空载体的PC-3核蛋白中没有与NBS的结合蛋白带(2泳道)。说明NKX3.1可与bcl-2基因上游调控区中的NKX3.1结合元件特异结合,调节bcl-2基因的表达。

Figure 3.The interaction of NKX3.1 with NKX3.1 -binding element in upstream of bcl-2 gene detected by EMSA.1:NBS probe;2:NBS probe+nucleoprotein of PC3- NKX3.1-;3:NBS probe+nucleoprotein of PC3- NKX3.1+;4:NBS probe+nucleoprotein of PC3-NKX3.1++125 - fold excess NBS unlabled;5:NBS probe+nucleoprotein of PC3 - NKX3.1++125-fold excess ARE unlabled;6:NBS probe+nucleoprotein of PC3 - NKX3.1++NKX3.1 antibody.图3 EMSA检测NKX3.1与bcl-2基因上游调控区中的NKX3.1结合元件相互作用
4 NKX3.1诱导PC-3细胞凋亡
结果显示,NKX3.1可使PC-3细胞凋亡数目明显增加,细胞凋亡数由7.00%增加至16.88%,见图4。

Figure 4.NKX3.1-induced apoptosis of PC -3 cells detected by flow cytometer.PC3 - NKX3.1+:PC - 3 cells transfected with pcDNA3.1 - NKX3.1 vector;PC3 -NKX3.1-:PC - 3 cells transfected with pcDNA3.1 vector.图4 流式细胞术检测NKX3.1对PC-3细胞凋亡的影响
PC-3细胞转染48 h后,同时使用Hoechest 33258凋亡检测试剂盒检测细胞凋亡。可发现转染pcDNA3.1-NKX3.1载体后,细胞凋亡小体数量明显增加,见图5。
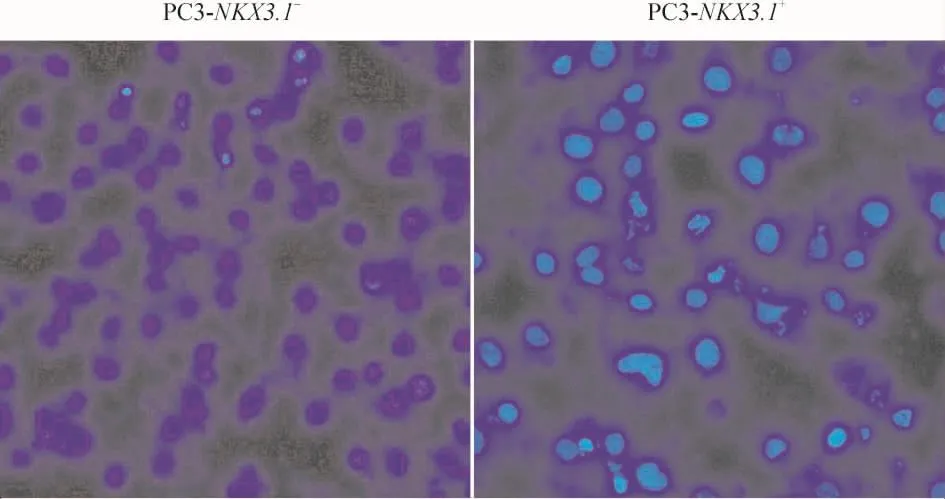
Figure 5.NKX3.1-induced apoptosis of PC -3 cells detected by Hoechst 33258 staining(×100).PC3-NKX3.1+:PC -3 cells transfected with pcDNA3.1 - NKX3.1 vector;PC3 - NKX3.1 -:PC -3 cells transfected with pcDNA3.1 vector.图5 Hoechst 33258染色检测NKX3.1对PC-3细胞凋亡的影响
讨 论
NKX3.1是前列腺特异性表达的同源盒基因,受雄性激素调节,其产物在结构与功能上属于核转录因子[10],发挥抑制前列腺上皮增生及维持分化的作用。有关NKX3.1蛋白功能的研究较少,其在前列腺癌发育和发生过程中的作用及机制并不是十分清楚。本实验选用的前列腺癌细胞株PC-3细胞是一种雄性激素非依赖性生长并且NKX3.1基因缺陷的细胞株,通过瞬时转染NKX3.1真核表达载体pcDNA3.1-NKX3.1,使 NKX3.1 在 PC -3 细胞中重新表达,在此基础上研究NKX3.1在前列腺癌中的作用,并通过流式细胞术和凋亡小体染色检测方法证明NKX3.1可促进细胞凋亡。
细胞的凋亡受多种基因的影响,是一个涉及多基因、多分子水平变化的多阶段过程,在其过程中不同功能的基因和分子对细胞所产生的影响协同调节细胞凋亡。众多研究表明bcl-2基因是抗细胞凋亡的重要基因[11,12],与肿瘤耐药和放疗耐受关系密切,其过度表达可抑制细胞凋亡,并导致细胞增殖与程序性细胞死亡失衡[13,14]。Hockenbery 等[12]认为 bcl-2基因家族在细胞凋亡调控中的作用具重要意义,而且近年研究也发现bcl-2在肿瘤中高表达可以使肿瘤的耐药性增加,增强的bcl-2表达在前列腺癌扮演重要角色。研究表明[15],在 NKX3.1与 p27KIP1缺失的前列腺癌细胞中恢复这2个基因的表达时,可明显抑制前列腺癌细胞增殖并促进细胞凋亡;实验更进一步发现NKX3.1与p27KIP1这2个基因的协同作用可以降低抗细胞凋亡基因bcl-2以及下游产物bax的表达。但是,目前NKX3.1是否可以直接影响bcl-2基因的表达尚未见文献报道。
本研究中,在瞬时转染NKX3.1表达载体后,通过RT-PCR和 Western blotting检测发现,bcl-2 mRNA和Bcl-2蛋白的表达水平明显下降。通过分析软件MatInspector2.2检测在bcl-2基因上游有一个NKX3.1结合元件序列(NBS),人工合成NBS通过EMSA检测NKX3.1与bcl-2基因上游调控区中的NKX3.1结合元件相互作用。结果显示,转染pcDNA3.1-NKX3.1的PC-3细胞核提取液中具有与NBS结合的核蛋白,并通过竞争结合实验及特异抗体阻断实验证明此结合是特异性的,而转染pcDNA3.1空载体的PC-3核蛋白中没有与NBS的结合蛋白带。说明NKX3.1与bcl-2基因上游调控区中的NKX3.1结合元件特异结合,可在转录水平上调节bcl-2基因的表达。
我们的实验结果表明NKX3.1可在转录水平下调抗凋亡基因bcl-2的表达,促进前列腺癌细胞凋亡。此结果为进一步研究NKX3.1促进细胞凋亡机制及其在前列腺癌中的作用奠定了基础。
[1]Trachtenberg J,Blackledge G.Looking to the future:advances in the management of hormone-refractory prostate cancer[J].Eur Urol Supp1,2002,1(7):44 -53.
[2]Sciavolino PJ,Abrams EW,Yang L,et al.Tissue-specific expression of murine Nkx3.1 in the male urogenital system[J].Dev Dyn,1997,209(1):127-138.
[3]Bieberich CJ,Fujita K,He WW,et al.Prostate-specific and androgen-dependent expression of a novel homeobox gene[J].J Biol Chem,1996,271(50):31779 -31782.
[4]Bhatia - Gaur R,Donjacour AA,Sciavolino PJ,et al.Roles for Nkx3.1 in prostate development and cancer[J].Genes Dev,1999,13(8):966-977.
[5]He WW,Sciavolino PJ,Wing J,et al.A novel human prostate-specific,androgen-regulated homeobox gene(NKX3.1)that maps to 8p21,a region frequently deletion in prostate cancer[J].Genomics,1997,43(1):69-77.
[6]Vocke CD,Pozzatti RO,Bostwick DG,et al.Analysis of 99 microdissected prostate arcinomas reveals a high frequency of allelic loss on chromosome 8p12 - 21[J].Cancer Res,1996,56(10):2411 -2416.
[7]Ornstein DK,Cinquanta M,Weiler S,et al.Expression studies and mutational analysis of the androgen regulated homeobox gene NKX3.1 in benign and malignant prostate epithelium[J].J Urol,2001,165(4):1329 -1334.
[8]Korkmaz KS,Korkmaz CG,Ragnhildstveit E,et al.Full-length cDNA sequence and genomic organization of human NKXA-alternative forms and regulat ion by both androgens and estrogen[J].Gene,2000,260(1 -2):25-36.
[9]刘闻闻,于春晓,崔福爱,等.人同源盒基因Nkx3.1对前列腺癌细胞的诱导凋亡作用[J].中国生物化学与分子生物学报,2006,22(12):996 -1002.
[10]Holmes KA,Song JS,Liu XS,et al.Nkx3-1 and LEF-1 function as transcriptional inhibitors of estrogen receptor activity[J].Cancer Res,2008,68(18):7380 -7385.
[11]Williams GT.Programmed cell death:apoptosis and oncogenesis[J].Cell,1991,65(7):1097 -1098.
[12]Hockenbery D,Nunez G,Milliman C,et al.Bcl-2 is an inner mitochondrial membrane protein that blocks programmed cell death[J].Nature,1990,348(6299):334-336.
[13]Green DR,Reed JC.Mitochondria and apoptosis[J].Science,1998,281(5381):1309-1312.
[14]Frei H.Cancer medicine[M].5th ed.Singapore:Harcourt Asia Pte Ltd,2001.24 -28.
[15]Wang P,Ma Q,Luo J,et al.Nkx3.1 and p27KIP1cooperate in proliferation inhibition and apoptosis induction in human androgen - independent prostate cancer cells[J].Cancer Invest,2009,27(4):369-375.
