高尔基体α-甘露糖苷酶Ⅱ在不同分化胃癌细胞和组织中的差异表达及意义*
2011-09-14杨雅莹易永芬
朱 嫦, 杨雅莹, 易永芬
(重庆医科大学病理教研室,分子医学与肿瘤研究中心,重庆400016)
胃癌是全世界范围内最常见的恶性肿瘤之一,高居癌症死因的第2位[1]。探讨胃癌侵袭和转移的相关机制并对其进行有效防治是长期以来的研究热点。细胞表面糖蛋白的糖链结构尤其是N-聚糖的改变与肿瘤的恶性生物学行为密切相关[2-4]。高尔基体α-甘露糖苷酶Ⅱ(Golgi mannosidaseⅡ,GMⅡ)是N-聚糖形成中的关键性糖苷酶之一,其被特异性抑制后肿瘤细胞的生长和转移明显降低,因此GMⅡ可能成为抗癌治疗的重要靶点[5-7]。GMⅡ在胃癌中的作用和意义国内外文献均少见报道,本研究通过RT-PCR、免疫组织化学和Western blotting等方法分别检测GMⅡ基因和蛋白在不同分化胃癌细胞系和组织中的表达,初步探讨GMⅡ与胃癌的关系,为进一步研究GMⅡ在胃癌发生和发展中的作用奠定基础。
材料和方法
1 材料
1.1 主要试剂 RPMI-1640培养基干粉、DEPC水和DMSO购自Sigma。小牛血清、胰蛋白酶购自Hy-Clone。SP免疫组化试剂盒及DAB染色试剂盒购自北京中杉金桥生物技术公司。Trizol购自Invitrogen。RT-PCR试剂盒和DNA marker购自宝生物工程大连有限公司。蛋白裂解液、BCA蛋白质定量试剂盒和蛋白marker购自碧云天生物技术公司。PVDF膜购自Millipore。MAN2A1(人GMⅡ基因)羊抗人多克隆抗体购自Santa Cruz。化学发光试剂盒购自天根生物技术有限公司。兔抗人β-actin多抗、HRP标记兔抗羊IgG和HRP标记羊抗兔IgG购自北京中杉金桥生物技术公司。
1.2 组织和细胞来源 收集2008年10月-2010年10月重庆医科大学附属第一医院胃癌患者手术切除标本,所有病例术前均未接受放化疗。其中癌组织38例,正常癌旁胃黏膜组织30例(癌旁5cm以上)。其中高分化胃癌8例、中分化胃癌18例和低分化胃癌12例。手术标本取材后立即放入液氮罐保存,组织标本均经甲醛固定,石蜡包埋,每例蜡块4 μm厚连续切片做免疫组化,所有病例均经过病理学诊断证实。永生化的人胃黏膜上皮细胞系(GES-1)购自第四军医大学细胞库,高分化(MKN-28)、中分化(SGC-7901)和低分化(BGC-823)胃癌细胞系均为重庆医科大学基础医学院分子医学与肿瘤研究中心冻存。
2 方法
2.1 细胞培养及爬片制备 以上4种细胞均接种在含10%小牛血清、1×105U/L青霉素、1×105U/L链霉素的 RPMI-1640培养液中,37℃、5%CO2温箱中培养,待细胞长到90%时进行传代培养,将对数生长期细胞用0.25%胰蛋白酶消化,加含10%小牛血清的RPMI-1640培养液终止消化,接种于6孔板中(内置无菌载玻片),待细胞长至80%时后吸出培养液,加4%多聚甲醛固定30 min,PBS洗2遍后4℃保存备用。
2.2 免疫组化检测GMⅡ蛋白的表达 组织石蜡切片:常规脱蜡至水,用3%H2O2作用10 min以阻断内源性过氧化物酶干扰,枸橼酸钠缓冲液15 min抗原修复,PBS洗后血清封闭30 min,滴加1∶50 GMⅡ多克隆抗体4℃孵育过夜,PBS清洗5 min×3次后加生物素化的 II抗,抗37℃孵育30 min,PBS清洗5 min×3次后DAB显色,苏木素复染,脱水,中性树胶封片,PBS代替I抗做阴性对照,每张切片至少观察5个随机高倍视野,按照阳性细胞所占比例记分:≤5% 为0分;6% -24%为1分;25% -50%为2分;>50%为3分。同时根据染色强度记分为:无着色为0分;淡黄色为1分;黄色或深黄色为2分;褐色或深褐色为3分。两项指标的积分相加结果:≤1分为阴性,>1为阳性。细胞爬片:除无抗原修复外处理方法同石蜡切片,拍片后采用Image-Pro Plus 6.0图像分析软件计算视野累积吸光度值(IA),以吸光度值代表GMⅡ的相对含量。
2.3 RT-PCR检测GMⅡmRNA的表达 按Trizol试剂盒说明提取各组组织和细胞的总RNA。琼脂糖凝胶电泳和紫外分光光度仪测定RNA的质量、浓度及纯度。按RT-PCR试剂盒说明合成cDNA第1链GMⅡ引物序列如下:上游引物 5'-GTTTATTGTCGAAAGTCTCACACC -3',下游引物 5'- CACCTCAACTGGATTCGG -3',扩增产物长度为126 bp;βactin上游引物5'-GCACCCAGCACAATGAAG -3',下游引物 5'-GCCAATCTCATCTTGTTTTC -3',扩增产物长度为356 bp,引物由上海生工合成。PCR反应条件如下:95℃预变性 2 min,94℃ 30 s,56℃30 s,72℃ 1 min,共30个循环,72℃ 10 min。结束后取反应产物5 μL进行1.5%琼脂糖凝胶电泳。采用Quantity One软件分析电泳条带的灰度值,以βactin为内参照,以各条带与内参照的灰度值的比值表示GMⅡmRNA的相对含量。
2.4 Western blotting检测GMⅡ蛋白的表达 提取各组组织和细胞的总蛋白,BCA法测定蛋白浓度,样品和上样缓冲液以4∶1混合变性,SDS-PAGE电泳后电转到PVDF膜上,脱脂奶粉封闭1 h,加入GMⅡ抗体(1∶300)和 β -actin抗体(1∶400),4 ℃孵育过夜,HRP标记 II抗(1∶1 000)孵育1 h,TBST洗脱3次,ECL化学发光显影,采用Quantity One软件测定条带的吸光度值,以β-actin为内参照,以各条带与内参照的吸光度的比值表示GMⅡ蛋白的相对含量。
3 统计学处理
结 果
1 免疫组化检测GMⅡ蛋白在胃癌组织中的表达
GMⅡ阳性染色位于胞浆,为均匀一致的棕黄色颗粒。30例正常胃组织中阳性染色为53%(16/30),8例高分化胃癌组织中的阳性染色为63%(5/8),18例中分化胃癌组织的阳性染色为83%(15/18),12例低分化胃癌组织的阳性染色为100%(12/12),各组之间比较差异显著(P<0.05),见表1、图1。
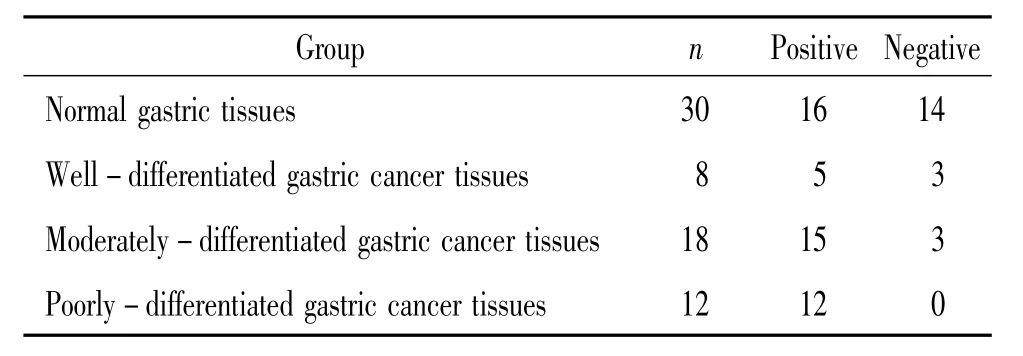
表1 高、中、低分化胃癌组和正常胃黏膜组织组中GMⅡ的表达情况Table 1.The expression of GMⅡin well-differentiated,moderately differentiated and poorly-differentiated gastric cancer tissues and normal gastric tissues
2 免疫组化检测GMⅡ蛋白在胃癌细胞系中的表达
正常胃黏膜上皮细胞系GES-1和3种胃癌细胞系MKN-28、SGC -7901、BGC-823染色平均吸光度分别为0.18±0.02、0.21±0.01、0.27±0.04、0.29±0.06,各组间差异显著(P<0.05,n=3)。GMⅡ在低分化胃癌细胞系BGC-823中表达最高;而在正常胃黏膜上皮细胞系GES-1中表达最低,见图2。
3 RT-PCR检测GMⅡmRNA在胃癌细胞系中的表达
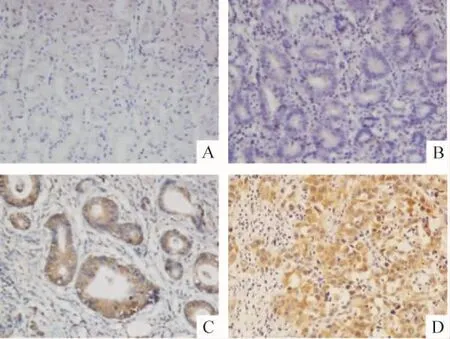
Figure 1.The positive expression of GMⅡ protein by immunohistochemistry in four gastric tissues(SP,×400).A:human normal gastric tissues;B:well-differentiated gastric cancer tissues;C:moderately-differentiated gastric cancer tissues;D:poorly-differentiated gastric cancer tissues.图1 免疫组化检测GMⅡ在胃组织中的阳性表达

Figure 2.The positive expression of GMⅡ protein detected by immunohistochemistry in four gastric cell lines(SP,×400).A:GES-1;B:MKN-28;C:SGC-7901;D:BGC -823.图2 免疫组化检测GMⅡ在4种细胞系中的阳性表达
GMⅡmRNA在正常胃黏膜上皮细胞系GES-1与3种不同分化的胃癌细胞系中均呈阳性表达。与GES-1相比,3种胃癌细胞系MKN-28、SGC-7901和BGC-823中GMⅡmRNA的表达水平显著增加,并且在低分化胃癌细胞系BGC-823中表达最高;而在高分化胃癌细胞系MKN-28中表达最低。各组之间比较差异显著(P<0.05),见图3。
4 RT-PCR检测GMⅡmRNA在胃癌组织中的表达
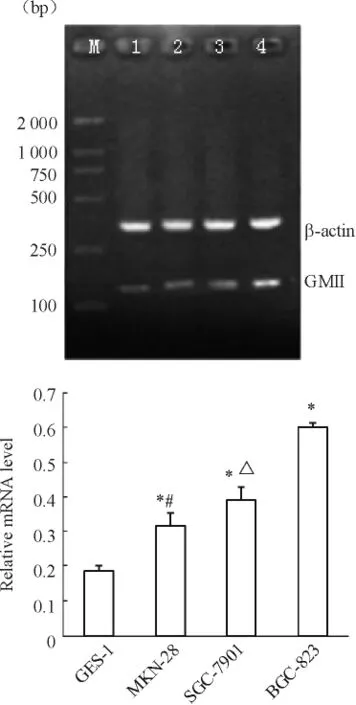
Figure 3.Expression of GMⅡ mRNA detected by RT-PCR infour gastric cell lines.M:DNA marker;Lane 1:GES-1;Lane 2:MKN-28;Lane 3:SGC-7901;Lane 4:BGC-823.±s.n=3.*P<0.05 vs GES-1.#P<0.05 vs SGC-7901;△P<0.05 vs BGC-823.图3 RT-PCR检测4种胃细胞系中GMⅡmRNA的表达水平
GMⅡmRNA在30例正常胃黏膜组织、8例高分化胃癌组织、18例中分化胃癌组织和12例低分化胃癌组织中相对含量分别为0.25±0.13、0.40±0.27、0.58±0.56和0.74±0.23。GMⅡmRNA在正常胃黏膜组织中GMⅡ表达最低,低分化胃癌组织中表达最高,各组间比较差异显著(P<0.05),见图4。
5 Western blotting检测GMⅡ蛋白在胃癌细胞系中的表达
内参照β-actin位于42 kD位置,条带粗细亮度基本一致,没有显著差异,4种细胞系在132kD处均出现GMⅡ的阳性表达,与β-actin蛋白的灰度比值显示GMⅡ蛋白在GES-1中的表达量最低,在MKN-28、SGC-7901和BGC-823 3组不同分化的胃癌细胞系中表达逐渐增加,分化越差,GMⅡ蛋白的表达越高。各组之间比较差异显著(P<0.05),见图5。
6 Western Blotting检测GMⅡ蛋白在胃癌组织中的表达

Figure 4.Expression of GMⅡmRNA detected by RT-PCR in four gastric cell tissues.M:DNA marker;Lane 1:human normal gastric tissues;Lane 2:well-differentiated gastric cancer tissues;Lane 3:moderately-differentiated gastric cancer tissues;Lane 4:poorly-differentiated gastric cancer tissues.±s.n=3.*P<0.05 vs group 1.#P <0.05 vs group 3;△P <0.05 vs group 4.图4 RT-PCR检测4种胃组织中GMⅡ的基因表达水平

Figure 5.Expression of GMⅡ protein detected by Western blotting in four gastric cell lines.Lane 1:GES-1;Lane 2:MKN-28;Lane 3:SGC-7901:Lane 4:BGC-823.±s.n=3.*P<0.05 vs GES-1.图5 Western blotting检测4种胃细胞系中GMII蛋白的表达水平
GMⅡ蛋白在30例正常胃黏膜组织、8例高分化胃癌组织、18例中分化胃癌组织、12例低分化胃癌组织中相对含量分别为0.12±0.03、0.33±0.24、0.49±0.17和0.62±0.51,GMⅡ在正常胃黏膜组织中表达最低,在中、低分化胃癌组织中表达最高,高分化胃癌组织中表达居中。各组之间比较差异显著(P <0.05),见图6。

Figure 6.Expression of GMⅡ protein detected by Western Blotting in four gastric cell tissues.Lane 1:human normal gastric tissues;Lane 2:well-differentiated gastric cancer tissues;Lane 3:moderately-differentiated gastric cancer tissues;Lane 4:poorly-differentiated gastric cancer tissues.图6 Western blotting检测4种胃组织中GMⅡ的蛋白表达水平
讨 论
恶性肿瘤细胞的侵袭和转移实质上是细胞与其周围环境(包括相邻细胞、细胞外可溶性生物活性分子及不溶性细胞外基质)之间相互作用失常所致,而细胞表面正是介导了细胞与周围环境的相互作用。细胞表面以糖蛋白分布最为广泛,如信号分子的受体、细胞黏附分子等。糖蛋白借助其糖链所携带的多种多样的生物识别信息,实现细胞与周围环境的联系,从而影响细胞的存活或凋亡、增殖与分化、迁移与侵袭等活动[8]。因此,细胞表面糖蛋白的的改变与肿瘤的生物学行为,如恶性转化、转移与侵袭等密切相关[9]。
糖蛋白是糖链通过N-糖基化和O-糖基化作用修饰蛋白质而形成。α-甘露糖苷酶是蛋白质N-糖基化修饰中关键性糖苷酶,它通过剪切N-糖链甘露糖残基而在聚糖从高甘露糖型转化成复杂型结构中起着重要的作用。迄今为止,已克隆的α-甘露糖苷酶cDNA有20多种,其中来自人类的有6种。高尔基体α-甘露糖苷酶Ⅱ(GMⅡ)在哺乳动物组织中分布广泛,它位于高尔基体的反面和中间体,分子量约为132 kD,其cDNA与鼠科动物的相近,位于5号染色体。GMⅡ分 子中含有糖基水解酶家族38(glycosyl hydrolase family 38)的保守序列,因此能特异性地剪切GlcNAc2Man5GlcNAc上 α -1,3和 α -1,6连接的甘露糖残基,形成 Glc2Man3GlcNAc[10]。
研究表明,GMⅡ与多种类型肿瘤的侵袭和转移行为密切相关。在乳腺、结肠及皮肤癌中,GMⅡ所引起的细胞表面复合糖数量分布的异常促进了肿瘤的发生发展,其临床预后更差。GMⅡ被苦马豆碱(swainsonine,SW)特异性抑制后,细胞表面的N-聚糖发生改变,肝癌细胞的黏附和迁移行为被明显抑制;正常尿路上皮及膀胱癌细胞GMⅡ被SW抑制后,其与纤维连接蛋白及IV型胶原纤维结合能力分别增加1.5及2倍,同时膀胱癌细胞的迁移率下降20%;在恶性黑色素瘤和淋巴瘤中也有类似的研究发现[11,12]。GMⅡ促进肿瘤的侵袭和转移的确切机制目前并不清楚。有研究者认为,GMⅡ可能通过对糖蛋白分子的质量控制、成熟、运输以及分泌来调控细胞之间、细胞与细胞外基质之间的识别[13]。GMⅡ抑制后肿瘤细胞与血管内皮细胞的黏附降低、对LAK和NK细胞的杀伤敏感性增强、细胞表面整合素糖蛋白分子中的寡糖基与其它细胞的配体结合受阻或者通过细胞表面凝集素介导的凋亡等均提示GMⅡ可能成为抗癌治疗的重要靶点[11,12]。
GMⅡ蛋白在胃癌中作用目前研究较少,国内研究者[13]曾用SW处理的胃癌细胞接种至裸鼠,结果显示裸鼠体内成瘤能力及转移能力均降低,这提示GMⅡ在胃癌的发生和发展中可能发挥重要的作用。但是,SW对GMⅡ抑制的非特异性(SW同时抑制细胞浆、溶酶体α-甘露糖苷酶)[6]以及体内实验中SW抗癌作用的发挥可能是通过免疫调节机制而非抑制GMⅡ,使得GMⅡ在胃癌发生和发展中的具体作用有待更加深入的研究。在癌变过程中,为糖链合成酶编码的基因表达异常或发生突变或活性异常是导致糖链结构形成发生异常的重要原因。GMⅡ基因及其蛋白在胃癌中的表达情况国内外文献均鲜见报道。前期实验中我们已应用免疫组化法研究分析了GMⅡ与临床病理特征之间的关系,表明GMⅡ在胃癌的发生发展、侵袭迁移中可能扮演着重要的角色[14]。本研究进一步通过RT-PCR、免疫组化法和Western blotting等方法分别检测GMⅡ基因和蛋白在3种不同分化胃癌细胞系及胃癌组织中的差异表达。结果显示,与正常胃黏膜上皮相比,3种胃癌细胞系MKN-28、SGC-7901、BGC-823中GMⅡ的基因及蛋白表达水平显著增加。并且,GMⅡ在低分化胃癌细胞系BGC-823中表达最高;而在高分化胃癌细胞系MKN-28中表达最低。此外,本研究还应用同样方法对不同分化的临床组织标本进行进一步研究,结果显示,GMⅡ表达水平在正常胃组织中最低,在低分化胃癌组织中表达最高,结果与对细胞系的研究结果一致。这进一步提示GMⅡ参与了胃癌的发生和发展,GMⅡ蛋白表达与胃癌的分化程度相关;而胃癌组织中GMⅡ基因表达的增高,为以GMⅡ为靶点的基因治疗提供重要的理论基础。
[1]蒋 振,郭俊明,肖丙秀,等.特异性微小RNA抑制剂对胃癌细胞增殖的影响[J].中国病理生理杂志,2009,25(9):1726 -1730.
[2]Pinho SS,Osório H,Nita- Lazar M,et al.Role of E -cadherin N-glycosylation profile in a mammary tumor model[J].Biochem Biophys Res Commun,2009,379(4):1091-1096.
[3]Santos IC,Silbiger VN,Higuchi DA,et al.Angiostatic activity of human plasminogen fragments is highly dependent on glycosylation[J].Cancer Sci,2010,101(2):453-459.
[4]Kariya Y,Kawamura C,Tabei T,et al.Bisecting GlcNAc residues on laminin-332 downregulates galectin-3 dependent keratinocyte motility[J].J Biol Chem,2010,285(5):3330-3340.
[5]van den Elsen JM,Kuntz DA,Rose DR.Structure of Golgi alpha-mannosidase II:a target for inhibition of growth and metastasis of cancer cells[J].EMBO J,2001,20(12):3008-3017.
[6]Fiaux H,Kuntz DA,Hoffman D,et al.Functionalized pyrrolidine inhibitors of human type II α-mannosidases as anti-cancer agents:optimizing the fit to the active site[J].Bioorg Med Chem,2008,16(15):7337 -7346.
[7]Gerber-Lemaire S,Juillerat-Jeanneret L.Glycosylation pathways as drug targets for cancer:glycosidase inhibitors[J].Mini Rev Med Chem,2006,6(9):1043 -1052.
[8]Lau KS,Partridge EA,Grigorian A,et al.Complex N -glycan number and degree of branching cooperate to regulate cell proliferation and differentiation[J].Cell,2007 ,129(1):123-134.
[9]Varki A,Kannagi R,Toole BP.Glycosylation changes in cancer[A].In:Varki A,Cummings RD,Esko JD,et al.eds.Essentials of glycobiology[M].2nd ed.New York:Cold Spring Harbor Laboratory Press,2009.537 -551.
[10]Suits MD,Zhu Y,Taylor EJ,et al.Structure and kinetic investigation of Streptococcus pyogenes family GH38 αmannosidase[J].PLoS One,2010,5(2):e9006.
[11]Suzuki O,Abe M.Cell surface N -glycosylation and sialylation regulate galectin-3-induced apoptosis in human diffuse large B cell lymphoma[J].Oncol Rep,2008,19(3):743-748.
[12]Unverzagt C,Gundel G,Eller S,et al.Synthesis of multiantennary complex type N-glycans by use of modular building blocks[J].Chemistry,2009,15(45):12292 -12302.
[13]Liu B,Lin Y,Yin H.Inhibition effect of Swainsonine on the growth and metastasis of gastric cancer in vivo[J].Zhonghua Zhong Liu Za Zhi,1998,20(3):168 -170.
[14]杨雅莹,李艳青,易永芬,等.高尔基体α-甘露糖苷酶Ⅱ在胃癌中的表达及其与E-cadherin、Galectin-3的关系[J].重庆医科大学学报,2010,35(9):1313-1316.
