瘦素与雌激素在骺板内的作用机制研究进展*
2011-09-12王善金李新锋戴力扬
王善金 李新锋 戴力扬
(上海交通大学医学院附属新华医院骨科,上海200092)
骺板 (epiphyseal plate)又称为生长板 (growth plate),是中胚层来源的高度分化的软骨结构。长骨的线性生长由生长板软骨内成骨实现。生长板内软骨细胞的生长经历静止、增殖、分化和凋亡的有序过程,从组织学上可分为静止层、增殖层、肥大层和矿化层。静止软骨细胞不活跃,处于相对静止状态,是骺板幼稚软骨细胞的源泉,又称细胞生发层;增殖细胞层堆积成柱状,柱的排列与骨的纵轴相平行,细胞生长活跃,数目多,有丰富的软骨基质和胶原纤维,以Ⅱ型胶原、蛋白聚糖为主;肥大层细胞体积变大、变圆,软骨基质明显减少,以X型胶原为主,这部分是骺板最薄弱的部位;矿化层很薄,仅有一层或几层细胞构成,软骨细胞凋亡,基质钙化,新生血管和骨细胞前体侵入并将肥大层内软骨改建形成新骨。这一过程是在多种内分泌因素的直接和 (或)间接控制下完成的,这些因素包括糖皮质激素、甲状腺激素、性激素、瘦素等。骺板区生长代谢活跃,易受体内外多种不良因素的影响,引起生长板软骨细胞增殖、生长、钙化障碍,最终导致肢体短缩和 (或)成角畸形或过度生长。
瘦素和雌激素是人体内重要的激素内物质,和不同性别个体的生长发育都有密切的关系。近年来,对雌激素和瘦素在生长板软骨内化骨过程中的机制研究日益增多,本文对两者的作用及相互关系作一综述。
1 雌激素与生长板
雌激素是主要的女性性激素,主要由卵巢分泌或者雄性激素经芳香酶转化而来。在长骨的生长发育中,雌激素发挥着重要的调节作用,可以引起青春期长骨的快速生长和后期骺板的融合,雌激素受体或者芳香酶的变异可以导致身高的异常[1]。雌激素对骨生长的作用分为两方面,一是系统性作用,即通过调节生长激素 (GH)/胰岛素样生长因子-I(IGF-I)轴来实现;二是直接作用与生长板内软骨细胞来调节生长[1]。
雌激素的直接作用主要分为基因组和非基因组效应。基因组效应是通过雌激素受体激活雌激素反应元件 (estrogen response element)完成的。雌激素受体 (ER)是核受体超家族的成员,介导雌激素的效应,主要分两种亚型:ERα和ERβ。研究发现 人和动物的生长板软骨细胞中存在雌激素受体的表达,表明雌激素对生长板软骨细胞的直接作用。ERα和ERβ在各个细胞层均有表达以增生层表达高,与年龄点相关呈动态变化,并受体内激素水平调节[2],提示受体表达动态变化有功能性意义。Yao等[2]研究发现 ERα主要位于细胞质中而ERβ主要位于细胞核中,说明不同的受体在细胞内介导的通路传导效应不同。
ERα和ERβ介导着相反的作用,前者促进骨生长,后者则有抑制作用。近来对雌激素受体敲除的实验研究证实了ERα和ERβ在生长板中的不同作用。Chagin等[3]则发现 ERβ敲除后抑制了生长板软骨细胞的增殖。然而究竟哪个受体在生长板软骨中起主导作用取决于性别和雌激素的浓度。青春期,高浓度的雌激素主要通过ERα来介导生长板融合[4],相反有作者[5]认为性成熟早期,ERα介导的作用并不重要。不同浓度的雌激素,ERβ介导的作用不同,低浓度时ERβ能抑制ERα介导的作用,而高浓度时,ERβ介导的作用得到增强,因此雌激素作用生长板最合适的剂量维持在一个很小的范围内,过高或者过低的浓度起到相似的作用[6]。雌激素的作用不仅跟剂量有关系,跟时间点也有关系。在青春期早期,长骨的增长与ERβ的激活有关系,而在青春期后期骨增长与ERα的激活有关系[7]。
由于ERα和ERβ介导的作用不同,雌激素对软骨细胞增殖作用研究尚无定论。Simm等[8]通过雌激素受体拮抗剂作用于生长板细胞株(RCJ3.1C5.18),研究发现拮抗ERα后致软骨细胞增殖分化减弱,拮抗ERβ后致软骨细胞增殖分化增强,说明ERα和ERβ在软骨内骨化中发挥着不同的作用。Talwar等[9]发现雌二醇 (10-8M)能够显著抑制大鼠生长板软骨细胞的增殖促进软骨细胞的成熟。Takano[10]等通过去势造成雌激素减少的兔模型,发现股骨生长板的软骨细胞数目减少,caspase-3基因的活性增强,这可能是雌激素减少促进细胞凋亡的结果。进一步的研究发现高浓度的雌激素能够激活caspase-3基因的活性,说明雌激素介导软骨细胞的凋亡过程[6]。最近发现雌激素调控生长板软骨细胞的凋亡机制是通过线粒体通路而与MAPK和NO无关,但是调控细胞增殖是通过雌激素膜受体和MAPK信号通路[11]。
雌激素的非基因组效应表现为激活了一些细胞内信号通路如 等 这些信号通路与细胞的增殖分化有密切的关系。雌激素能够调节雌性大鼠生长板软骨细胞质中的游离钙浓度,而对雄性大鼠无明显作用,这个作用是通过PKC依赖的IP3通路介导的[12]。McMillan 等[13]研究发现雌激素能激活大鼠生长板软骨细胞的MAPK信号通路,不同的性别作用不同。
此外,雌激素调控生长板融合的机制至今不清楚。一般认为雌激素能通过耗竭增生层的软骨细胞来诱导生长板融合的[14]。Emons 等[15]发现雌激素能增加大鼠生长板内血管内皮生长因子 (VEGF)的表达,雌激素诱导的血管侵入也是生长板融合机制之一。Chagin等[16]发现大鼠生长板软骨细胞可以自行合成雌激素,有促进增殖抑制凋亡的作用。最近的研究发现雌激素受体新的亚型GPR30,主要在静止层和肥大层表达,与年龄变化有关系[17],与ERs一样能够介导雌激素在生长板中的作用[18]。Ford等[19]发现GPR30敲除后能增加雄性小鼠生长板软骨细胞的增殖能力。
2 瘦素与生长板
瘦素 (leptin)是肥胖基因 (Ob)的产物,是调节摄食和体重的激素类物质,主要在白色脂肪组织中表达。瘦素在青春期早期发挥着启动促进作用,并且在不同性别之间的作用有差异[20]。瘦素对长骨生长的作用分为直接作用和间接作用。间接作用是通过中枢神经系统下丘脑直接调控的。同时瘦素能直接调控生长板软骨细胞的增殖、分化和矿化,这个过程是通过瘦素受体 (leptin receptor)完成的。瘦素受体属于I类细胞因子受体家族,有6种亚型,但是只有长型瘦素受体 (Ob-Rb)参与细胞内的信号传导[21]。研究发现瘦素受体可以表达在生长板软骨细胞的各个细胞层,以肥大层为主[22,23]。Li等[23]能过免疫组化发现瘦素受体在大鼠生长板软骨细胞中的表达和年龄及性别有关系,且在脊柱椎体生长板和四肢长骨生长板的表达也不同。
瘦素与瘦素受体结合后可以激活JAK/STAT、PI3K、MAPK等多种细胞通路,这些细胞通路被证实在软骨内骨化过程中发挥着重要作用[24]。瘦素调控软骨细胞增殖分化的机制至今未完全明了。ATDC5细胞在胰岛素的诱导下可以分化成生长板软骨细胞,不同的时间点具有不同的细胞层特点,是目前研究生长板机制最常用的细胞株。Ben-Eliezer等[25]发现瘦素通过激活ERK1/2和STAT3信号通路来增加ATDC5细胞中X型胶原的表达,而P38信号通路则没有明显的意义。瘦素的作用与剂量有关系,生理剂量的瘦素 (10 ng/ml)能增加ATDC5细胞内X型胶原的表达,高剂量的瘦素 (100 ng/ml) 则减少了 X 型胶原的表达[22]。Kume等[26]认为瘦素调控软骨化骨的过程是通过调节生长板中的血管生成实现的。瘦素还可以增加PTHrP水平,并同时减少IHH水平[27],通过这个反馈通路来调控细胞的增殖分化。Otero等[28]发现瘦素与干扰素γ在调控ATDC5细胞中NOS发挥协同作用,这个作用是通过PI-3K,MEK1 and p38信号通路。Wang等[29]也发现瘦素可以增加大鼠生长板内甲状腺激素受体 (TR-α)的表达,并与甲状腺激素发挥协同作用,共同调控软骨细胞的增殖和分化。
瘦素缺乏的小鼠 (Ob小鼠)股骨生长板细胞凋亡增加,一定剂量的瘦素刺激后可以抑制凋亡[22]。瘦素受体缺乏的小鼠 (db小鼠),胫骨长度较对照组短小,说明瘦素受体通路在生长板代谢中发挥重要作用[30]。瘦素对脊柱和四肢的骺板有着相反的作用。对瘦素缺乏的Ob小鼠研究发现,相对于野生小鼠,ob小鼠股骨缩短,而脊柱变长,瘦素缺乏最初影响的是股骨的改变,后期才会影响到脊柱椎体[31],提示椎体和四肢长骨骺板对leptin信号缺陷的反应不同。
3 瘦素与雌激素的相互关系
青春发育期生物体内常常会伴有诸多重要的生理变化,诸如生长加速、性发育成熟等。这些过程都需要保证体内有充足的能量储备,而瘦素和雌激素都是调节能量代谢的重要激素,瘦素能调节青春期的性成熟[32]。人体体脂组成呈现鲜明的性别差异性,这种差异性最初开始于青春发育期,雌激素和瘦素都是体脂组成的重要调解者,青春期女性体内脂肪含量明显高于男性,性激素是影响青春期的重要激素,脂肪细胞分泌的瘦素是青春期的准入因子,女性进入青春期的时间要明显早于男性[33]。这些研究提示瘦素和雌激素在生长发育中可能存在某种相互关系。
目前已经研究证实瘦素和雌激素在一些特定组织存在相互作用。Choi等[34]发现瘦素诱导的卵巢癌细胞的增殖也是通过ERα的表达和STAT3通路。Binai等[35]证实在乳腺癌细胞中,ERα能增加瘦素诱导的STAT3磷酸化水平,抑制ERα则降低瘦素诱导的STAT3磷酸化水平,而且这种作用与雌激素受体的配基是没有关系的。Gambino等[36]发现雌二醇能够增加胎盘滋养层细胞的瘦素分泌,这个过程是通过ERα的表达和MAPK信号通路。Yi等[37]发现ERα能够促进瘦素的分泌,而ERβ能够抑制瘦素的分泌,表明ERα与ERβ在瘦素分泌的过程中起着相反的作用。雌激素能够上调大鼠背根神经节的瘦素受体mRNA和蛋白的表达[38]。
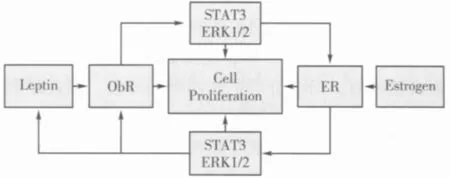
图1 瘦素与雌激素在细胞增殖中的相互作用关系
瘦素、雌激素及其相应受体在骺板内都有表达,而且表达部位类似,提示它们可能存在相互作用。Runx2(Runt相关转录因子2)是软骨细胞向肥大层分化的必需因子,并和雌激素和瘦素都有作用关系[39]。最近发现Wnt通路及其抑制因子Dickkopf-1(DKK1)也是骨发育的关键调解信号,并且Wnt是 Ihh的下游靶点[40]。瘦素能增加骺板内PTHrP,降低 Ihh,而且有年龄和部位依赖的特点[27]。雌激素可以刺激 Ihh及其靶向基因Ptc1等的表达。提示这些围绕PTHrp-Ihh、Ihh-Wnt等信号轴的多种细胞因子同瘦素和雌激素都有一定关系,可能充当两者之间相互作用的媒介因子。
综上所述,瘦素与雌激素的受体在生长板上存在共表达,两者均能调控软骨细胞的增殖、分化以在生长板中的相互作用研究比较少。研究二者的关系对阐明青春期骨发育的机制、防治骨生长有关的畸形有着重要的意义。及凋亡,而且作用于共同的媒介分子和相同的信号通路。这些结论都一定程度地揭示了瘦素和雌激素存在着某种相互关系,然而直接涉及瘦素与雌激素
[1]Perry RJ,Farquharson C,Ahmed SF.The role of sex steroids in controlling pubertal growth.Clin Endocrinol(Oxf),2008,68(1):4-15.
[2]Yao X,Chen H,Ohtake N,et al.Morphological alterations in the growth plate cartilage of ovariectomized mice.Med Mol Morphol,2006,39(4):193-197.
[3]Chagin AS,Lindberg MK,Andersson N,et al.Estrogen receptor-β inhibits skeletal growth and has the capacity to mediate growth plate fusion in female mice.J Bone Miner Res,2004,19(1):72-77.
[4]Nilsson O,Baron J.Impact of growth plate senescence on catch-up growth and epiphyseal fusion.Pediatr Nephrol,2005,20(3):319-322.
[5]Borjesson AE,Lagerquist MK,Liu C,et al.The role of estrogen receptor α in growth plate cartilage for longitudinal bone growth.J Bone Miner Res,2010,25(12):2414-2424.
[6]Takano H,Aizawa T,Irie T,et al.Normal bone growth requires optimal estrogen levels:negative effects of both high and low dose estrogen on the number of growth plate chondrocytes.Tohoku J Exp Med,2008,214(3):269-280.
[7]Marquez Hernandez R,Ohtani J,Fujita T,et al.Mandibular and femoral growth alteration after sex hormone disruption in growing mice.Orthod Craniofac Res,2011,14(2):63-69.
[8]Simm PJ,Russo VC,Werther GA.The effect of selective oestrogen receptor antagonists in an in vitro model of growth plate chondrogenesis.Endocrine,2011,40(1):27-34.
[9]Talwar RM,Wong BS,Svoboda K,et al.Effects of estrogen on chondrocyte proliferation and collagen synthesis in skeletally mature articular cartilage.J Oral Maxillofac Surg,2006,64 (4):600-609.
[10]Takano H,Aizawa T,Irie T,et al.Estrogen deficiency leads to decrease in chondrocyte numbers in the rabbit growth plate.J Orthop Sci,2007,12(4):366-374.
[11]Zhong M,Carney DH,Boyan BD,et al.17β-Estradiol regulates rat growth plate chondrocyte apoptosis through a mitochondrial pathway not involving nitric oxide or MAPKs.Endocrinology,2011,152(1):82-92.
[12]Ekstein J,Nasatzky E,Boyan BD,et al.Growth-plate chondrocytes respond to 17β-estradiol with sex-specific increases in IP3 and intracellular calcium ion signalling via a capacitative entry mechanism.Steroids,2005,70(11):775-786.
[13]McMillan J,Fatehi-Sedeh S,Sylvia VL,et al.Sex-specific regulation of growth plate chondrocytes by estrogen is via multiple MAP kinase signaling pathways.Biochim Biophys Acta,2006,1763(4):381-392.
[14]Chagin AS,Savendahl L.Estrogens and growth:review.Pediatr Endocrinol Rev,2007,4(4):329-334.
[15]Emons J,Chagin AS,Malmlof T,et al.Expression of vascular endothelial growth factor in the growth plate is stimulated by estradiol and increases during pubertal development.J Endocrinol,2010,205(1):61-68.
[16]Chagin AS,Chrysis D,Takigawa M,et al.Locally produced estrogen promotes fetal rat metatarsal bone growth;an effect mediated through increased chondrocyte proliferation and decreased apoptosis.J Endocrinol,2006,188(2):193-203.
[17]Chagin AS,Savendahl L.GPR30 estrogen receptor expression in the growth plate declines as puberty progresses.J Clin Endocrinol Metab,2007,92(12):4873-4877.
[18]Windahl SH,Andersson N,Chagin AS,et al.The role of the G protein-coupled receptor GPR30 in the effects of estrogen in ovariectomized mice.Am J Physiol Endocrinol Metab,2009,296(3):E490-496.
[19]Ford J,Hajibeigi A,Long M,et al.GPR30 deficiency causes increased bone mass,mineralization,and growth plate proliferative activity in male mice.J Bone Miner Res,2011,26(2):298-307.
[20]Rutters F,Nieuwenhuizen AG,Verhoef SP,et al.The relationship between leptin,gonadotropic hormones,and body composition during puberty in a Dutch children cohort.Eur J Endocrinol,2009,160(6):973-978.
[21]Tsuji K,Maeda T,Kawane T,et al.Leptin stimulates fibroblast growth factor 23 expression in bone and suppresses renal 1α,25-dihydroxyvitamin D3 synthesis in leptin-deficient mice.J Bone Miner Res,2010,25(8):1711-1723.
[22]Kishida Y,Hirao M,Tamai N,et al.Leptin regulates chondrocyte differentiation and matrix maturation during endochondral ossification.Bone,2005,37(5):607-621.
[23]Li XF,Yan J,Jiang LS,et al.Age-related variations of leptin receptor expression in the growth plate of spine and limb:gender-and region-specific changes.Histochem Cell Biol,2011,135(5):487-497.
[24]Gat-Yablonski G,Phillip M.Leptin and regulation of linear growth.Curr Opin Clin Nutr Metab Care,2008,11(3):303-308.
[25]Ben-Eliezer M,Phillip M,Gat-Yablonski G.Leptin regulates chondrogenic differentiation in ATDC5 cell-line through JAK/STAT and MAPK pathways.Endocrine,2007,32(2):235-244.
[26]Kume K,Satomura K,Nishisho S,et al.Potential role of leptin in endochondral ossification.J Histochem Cytochem,2002,50(2):159-169.
[27]Gat-Yablonski G,Shtaif B,Phillip M.Leptin stimulates parathyroid hormone related peptide expression in the endochondral growth plate.J Pediatr Endocrinol Metab,2007,20(11):1215-1222.
[28]Otero M,Lago R,Gomez R,et al.Phosphatidylinositol 3-kinase,MEK-1 and p38 mediate leptin/interferon-γ synergistic NOS type Ⅱinduction in chondrocytes.Life Sci, 2007, 81 (19-20):1452-1460.
[29]Wang L,Shao YY,Ballock RT.Leptin synergizes with thyroid hormone signaling in promoting growth plate chondrocyte proliferation and terminal differentiation in vitro.Bone,2011,48(5):1022-1027.
[30]Williams GA,Callon KE,Watson M,et al.Skeletal phenotype of the leptin receptor-deficient db/db mouse.J Bone Miner Res,2011,26(8):1698-1709.
[31]Ealey KN,Fonseca D,Archer MC,et al.Bone abnormalities in adolescent leptin-deficient mice.Regul Pept,2006,136(1-3):9-13.
[32]Martos-Moreno GA,Chowen JA,Argente J.Metabolic signals in human puberty:effects of over and undernutrition.Mol Cell Endocrinol,2010,324(1-2):70-81.
[33]Rogol AD.Sex steroids,growth hormone,leptin and the pubertal growth spurt.Endocr Dev,2010,17:77-85.
[34]Choi JH,Lee KT,Leung PC.Estrogen receptor α pathway is involved in leptin-induced ovarian cancer cell growth.Carcinogenesis,2011,32(4):589-596.
[35]Binai NA,Damert A,Carra G,et al.Expression of estrogen receptor α increases leptin-induced STAT3 activity in breast cancer cells.Int J Cancer,2009,127(1):55-66.
[36]Gambino YP,Maymo JL,Perez-Perez A,et al.17B-estradiol enhances leptin expression in human placental cells through genomic and nongenomic actions.Biol Reprod,2010,83(1):42-51.
[37]Yi KW,Shin JH,Seo HS,et al.Role of estrogen receptor-α and-β in regulating leptin expression in 3T3-L1 adipocytes.Obesity(Silver Spring),2008,16(11):2393-2399.
[38]Chen HP,Fan J,Cui S.Detection and estrogen regulation of leptin receptor expression in rat dorsal root ganglion.Histochem Cell Biol,2006,126(3):363-369.
[39]Komori T.Regulation of bone development and maintenance by Runx2.Front Biosci,2008,13:898-903.
[40]Day TF,Yang Y.Wnt and hedgehog signaling pathways in bone development.J Bone Joint Surg Am,2008,90 Suppl 1:19-24.
