饲粮能量水平对乌金猪脂肪组织脂类分解代谢相关基因表达的影响
2011-09-11潘洪彬赵素梅葛长荣高士争
潘洪彬 王 静 黄 英 赵素梅 张 曦 葛长荣 高士争
(云南农业大学云南省动物营养与饲料重点实验室,昆明 650201)
乌金猪是云南优良地方猪种之一,具有耐粗饲、抗逆性强、肉质优良、肌内脂肪丰富等优良性状[1]。研究不同能量水平的饲粮对乌金猪脂肪组织中脂类分解代谢相关基因表达的影响,对阐明饲粮能量水平对猪脂肪组织脂类代谢影响的分子机制具有重要科学意义。
激素敏感脂肪酶(hormone sensitive lipase,HSL)是调节脂肪动员的关键酶,是脂肪分解的限速酶,HSL能水解甘油三酯成甘油和脂肪酸以满足动物体的需要[2]。线粒体膜上的肉碱脂酰转移酶(carnitine acyl transferase,CPT)能催化脂酰基在肉碱和辅酶A之间的转移反应,CPT-Ⅰ是脂酰辅酶A转入线粒体中脂肪酸 β-氧化的限速酶[3];脂蛋白脂酶(lipoprotein lipase,LPL)是脂质代谢中的关键酶,可水解极低密度脂蛋白和乳糜微粒中的甘油三酯,使之转变成相对分子质量较小的脂肪酸,以供各种组织贮存和利用[4];过氧化物酶体增殖物激活受体 γ(preoxisome proliferator-activated receptor γ,PPARγ)是一类由配体激活的核转录因子,属于细胞核受体超家族的成员[5],PPARγ不仅参与脂代谢相关基因的表达调控,调节脂类代谢,同时在控制脂肪储存和释放、维持机体能量平衡和调节胰岛素抵抗及血糖的稳定等方面有正向调节作用[6]。
在前期研究中,本实验室系统研究了饲粮不同能量水平对乌金猪生长、胴体组成和肉品质的影响,得出了乌金猪在不同生长阶段获得最佳肉品质所需的饲粮能量水平[7-8],并研究了饲粮蛋白质水平对猪脂肪组织中脂类代谢相关基因表达的影响和饲粮能量水平对猪脂肪组织中脂类合成代谢相关基因表达的影响[9-10]。本文在此基础上,进一步深入研究饲粮不同能量水平对乌金猪脂肪组织脂类分解代谢相关基因表达的影响,从基因水平阐明饲粮营养水平对猪脂肪组织脂类分解代谢影响的分子机制。
1 材料与方法
1.1 试验动物及试验设计
选取健康、胎次相近、体重约15 kg的乌金猪54头,公母各占1/2,单因子随机分为3组,每组3个重复,每个重复6头猪,分别饲喂3个消化能水平的饲粮。试验分15~30 kg、31~60 kg和61~100 kg体重3个阶段,各阶段换料逐渐过渡,过渡期为7 d,日饲喂3次,自由饮水,分别于30、60和100 kg体重时分批屠宰,每批屠宰6头,取背部外层皮下脂肪组织于-80℃保存待测。
1.2 试验饲粮
根据《动物营养参数与饲养标准:中国肉脂型生长肥育猪饲养标准》[11]设计乌金猪饲粮,各阶段饲粮蛋白质等营养水平基本一致,中能组饲粮以饲养标准的消化能为标准,高、低能组饲粮消化能上下调整10%,分别为:低能组11.74 MJ/kg,中能组12.89 MJ/kg,高能组14.22 MJ/kg[7-8]。试验饲粮组成及营养水平见表1。
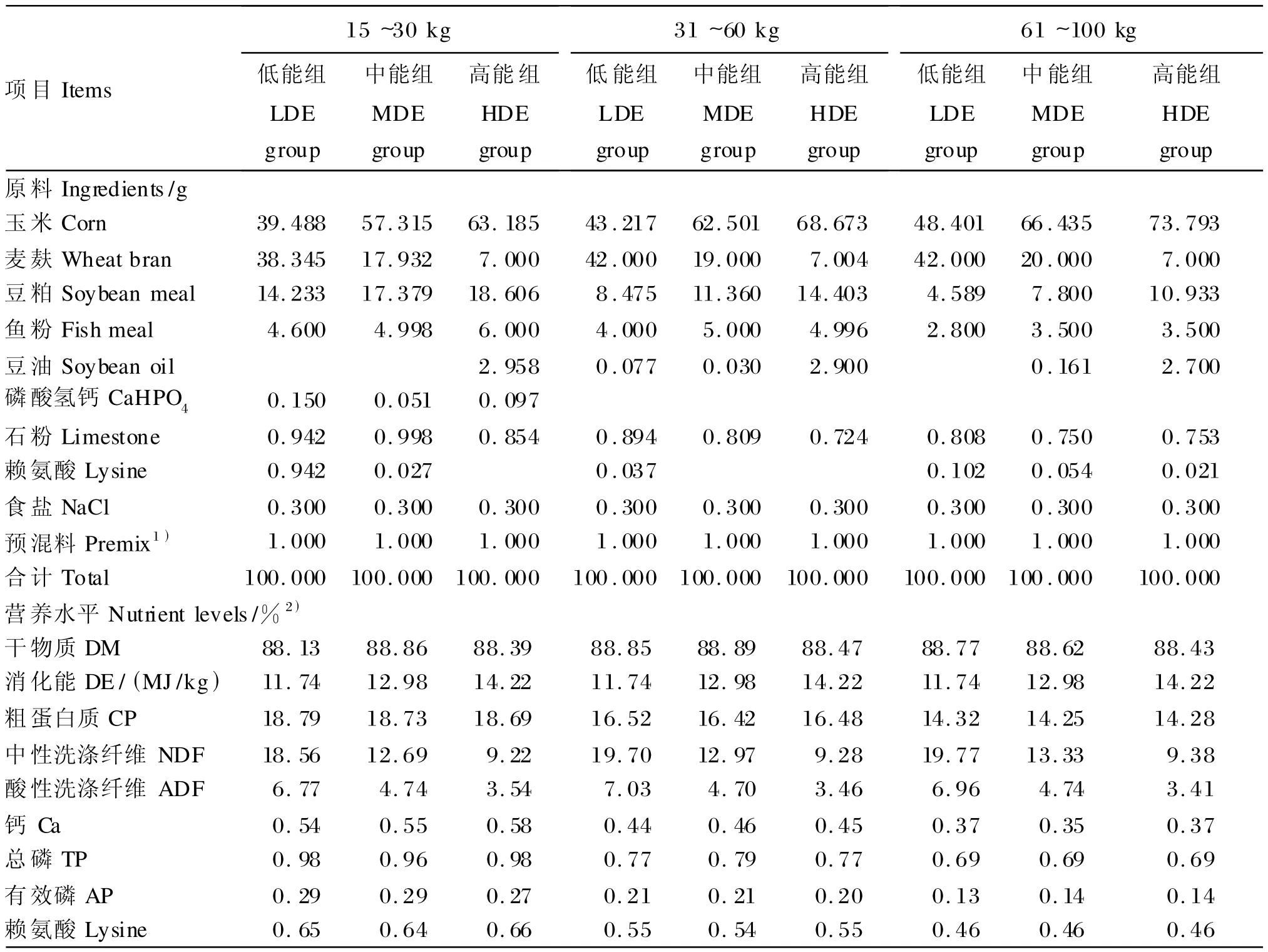
表1 试验饲粮组成及营养水平(风干基础)Table 1 Composition and nutrient levels of experimental diets(air-dry basis)
1.3 实时定量PCR(real-time PCR)
1.3.1 总RNA提取
取每批屠宰的6头乌金猪的背部外层皮下脂肪组织样品,用Trizol试剂提取总RNA,用紫外分光光度计(260 nm)和变性琼脂糖凝胶电泳测定总RNA浓度与纯度。
1.3.2 反转录
取 2 μ g 总 RNA 进行反转录 ,反应采用 20 μ L体系 :12 μmol/L 随机引物 、0.5 mmol/L dNTP、20 U/μ L RNA 酶 抑 制 剂 (RNase inhibitor)、10 U/μ L反转录酶 (M-MLV RTase)、4 μ L 5 ×RT Buffer[含 250mmol/L Tris-HCl(pH 8.3)、50 mmol/L MgCl2、250 mmol/L KCl、50 mmol/L二硫苏糖醇(DTT)、2.5 mmol/L亚精胺(Spermidine)]。先加RNA模板,dNTP和随机引物,70℃变性5 min,立即冷却,再加其余试剂37℃反应60 min,95℃灭活5 min。反转录产物于-20℃保存备用。
1.3.3 实时定量PCR及其条件优化
目的基因 (HSL 、CPT-Ⅰ 、LPL、PPARγ)和内参基因 β-肌动蛋白(β-actin)引物使用 Primer 5.0软件根据GenBank中猪的基因序列设计,引物序列及参数见表2。

表2 实时定量PCR特异性引物序列及参数Table 2 Sequences and parameters of specific primers for real-time PCR
实时定量 PCR 采用20 μ L反应体系:1.5 μ L反转录产物 、10 μ L iQTMSYBR Green Supermix(BIO-RAD, 美 国 )、 0.25mmol/μ L dNTP、0.5 mmol/L目的基因引物。同时用双蒸水代替RT产物和荧光试剂作空白对照。每样品做2次重复,取其平均值代入2-ΔΔCT公式进行计算。各基因PCR的优化条件见表3。
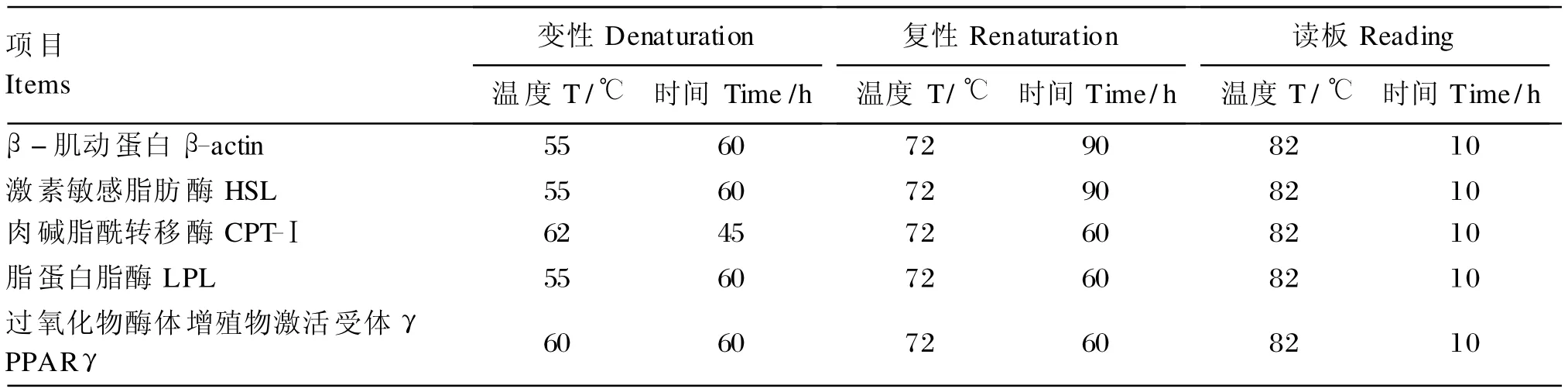
表3 实时定量PCR条件Table 3 Conditions for real-time PCR
1.4 定量方法
每个样本的目标基因表达量为通过内参基因均一化处理后相对于低能组(设为1倍量)的倍数。
各基因基因相对表达量计算公式[12]如下:
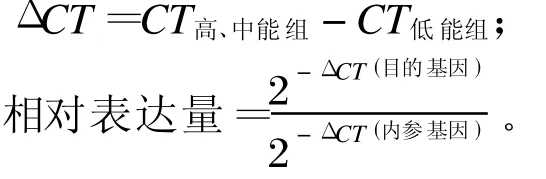
式中,CT为阈值循环。
1.5 数据分析
采用SAS 9.0软件对试验数据进行统计分析,对平均值进行方差分析,作显著性检验(P<0.05)。
2 结 果
2.1 HSL基因的表达水平
由表4可知,在30和100 kg体重时,脂肪组织中HSL基因的表达水平随饲粮能量的升高而逐渐降低,且与低能组相比,高能组30 kg体重时、中能组30和100 kg时表达水平显著下降(P<0.05);在60 kg体重时,HSL基因的表达水平随饲粮能量的升高而升高(P<0.05);随着猪体重的增加,脂肪组织中HSL基因的表达水平下降。
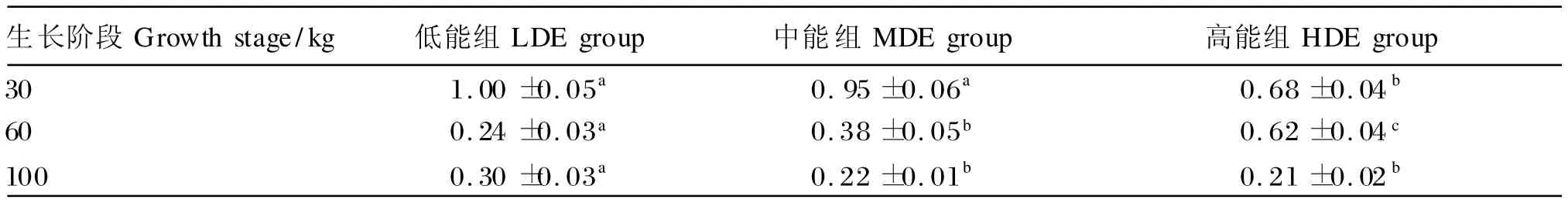
表4 饲粮能量水平对不同生长阶段猪脂肪组织中激素敏感脂肪酶基因的表达水平的影响Table 4 Effects of dietary energy level on expression level of HSL in adipose tissue of pigs at different growth stages
2.2 LPL基因的表达水平
由表5可知,在乌金猪不同生长阶段,LPL基因的表达水平随饲粮能量升高而升高,30 kg体重时,高能组显著高于低、中能组(P<0.05),60和100 kg体重时,中、高能组显著高于低能组(P<0.05);在60 kg体重时,各组LPL基因的表达水平均分别高于其他2个体重阶段。
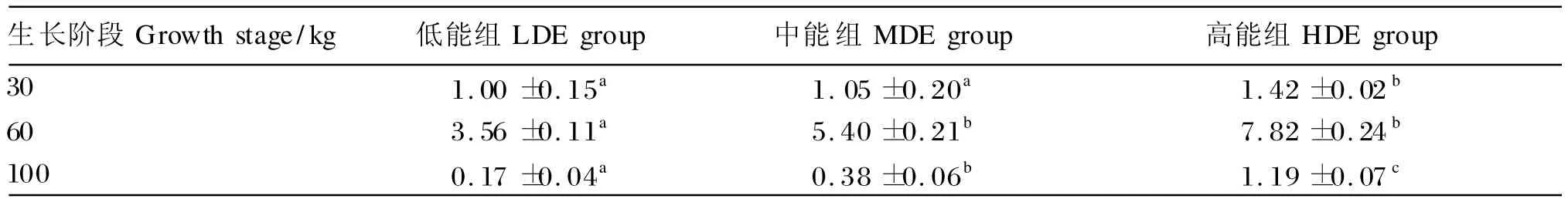
表5 饲粮能量水平对不同生长阶段猪脂肪组织中脂蛋白脂酶基因的表达水平的影响Table 5 Effects of dietary energy level on expression level of LPL in adipose tissue of pigs at different growth stages
2.3 CPT-Ⅰ基因的表达水平
由表6可知,在60 kg体重时,CPT-Ⅰ基因的表达水平随饲粮能量水平的升高而升高,中、高能组上调CPT-Ⅰ基因的表达(P <0.05);在30和100 kg体重时,CPT-Ⅰ基因的表达水平随饲粮能量水平的升高而降低,且30 kg体重时高能组以及100 kg体重时中、高能组的表达水平均为显著降低 (P <0.05)。
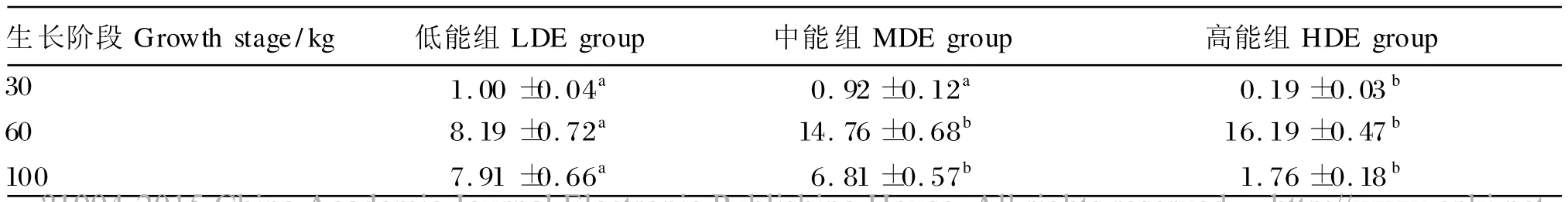
表6 饲粮能量水平对不同生长阶段猪脂肪组织中肉碱脂酰转移酶Ⅰ基因的表达水平的影响Table 6 Effects of dietary energy level on expression level of CPT-Ⅰin adipose tissue of pigs at different growth stages
2.4 PPAR γ基因的表达水平
由表7可知,在60 kg体重时,PPARγ基因的表达水平随饲粮能量水平的升高而升高,中、高能组PPARγ基因的表达水平显著升高(P<0.05);在30和100 kg体重时,PPARγ基因的表达水平随饲粮能量水平的升高而降低,且30 kg体重时高能组以及100 kg体重时中、高能组的表达水平均为显著降低(P <0.05)。
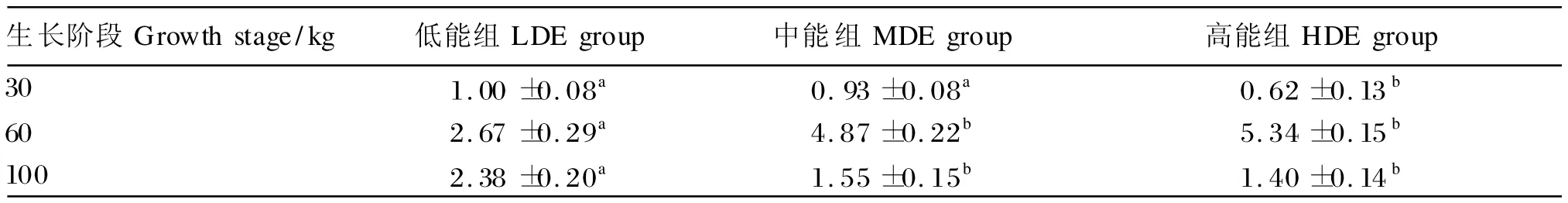
表7 饲粮能量水平对不同生长阶段猪脂肪组织中过氧化物酶体增殖物激活受体 γ基因的表达水平的影响Table 7 Effects of dietary energy level on expression level of PPARγin adipose tissue of pigs at different growth stages
3 讨 论
动物体脂沉积是一个复杂的生理生化过程,品种、生长阶段及营养水平都可影响动物机体脂肪的沉积,其中饲粮能量水平是影响动物机体脂肪沉积的重要因素之一。作者的前期研究结果表明,不同生长阶段乌金猪的脂肪沉积率随饲粮能量水平的升高而升高[10]。
动物体脂沉积的多少取决于脂肪酸的合成、分解及转运等过程,脂肪组织中脂肪的分解及脂肪酸的转运和氧化对脂肪沉积有着重要影响。HSL是脂肪分解的关键酶,将甘油三酯分解成甘油和脂肪酸以满足动物体的需要[2]。HSL主要在脂肪组织中表达[13],受胰岛素、胰高血糖素等多种激素的调节[14],而且受生长阶段和饲粮营养水平的影响,低能量或含多不饱和脂肪酸较高的饲粮可增加HSL的活性[15]。CPT-Ⅰ位于线粒体外膜,负责将长链脂肪酸转运进入线粒体[3]。当脂肪动员作用加强时,较多的脂肪酸为机体提供能量,此时CPT-Ⅰ活性增加,脂肪酸的 β-氧化增强。本试验结果表明,高能量饲粮显著上调60 kg体重乌金猪脂肪组织中HSL和CPT-Ⅰ基因的表达水平,说明可能脂肪组织中脂肪的分解代谢加强,产生的脂肪酸增加,进入线粒体进行 β-氧化的脂肪酸增多,脂肪酸的氧化作用增强,这一阶段脂肪的沉积能力较弱。高能量饲粮显著下调30和100 kg体重乌金猪脂肪组织中HSL和CPT-Ⅰ基因的表达水平,并且100 kg体重时,饲喂高能量日粮乌金猪的脂肪率比饲喂低能量饲粮乌金猪的脂肪率高19.25%(P<0.01)[10],可能由于脂肪组织中脂肪的分解和脂肪酸的氧化作用减弱,促进乌金猪生长的早期和后期脂肪的沉积。
LPL主要由脂肪组织合成并分泌到血液中,将血液中乳糜微粒和极低密度脂蛋白中的甘油三酯水解为脂肪酸[4],肥型猪脂肪组织中LPL的水平显著高于瘦肉型猪[5]。目前普遍认为,LPL与机体的脂类代谢及肥胖密切相关,白色脂肪组织中LPL的活性升高有助于机体脂类的贮存[16]。研究表明,用含20%饱和脂肪酸或富含亚油酸的非饱和脂肪酸的高脂肪饲粮和含2%红花油的低脂肪饲粮饲喂大鼠3周,高脂肪饲粮可降低肾周组织LPL基因的表达,上调肾周棕色脂肪组织LPL基因的表达,对肾周白色脂肪组织LPL基因的表达无显著影响[17]。本试验结果显示,高能量饲粮上调不同生长阶段乌金猪脂肪组织LPL基因的表达,且60 kg体重时的表达水平高于30和100 kg体重,表明高能量水平饲粮可促进机体脂肪酸的利用。
PPARγ是一类由配体激活的核转录因子,具有调节LPL和HSL基因的表达的活性[18]。本试验结果显示,高能量饲粮可显著上调60 kg体重时乌金猪脂肪组织PPARγ基因的表达,抑制30和100 kg体重时PPARγ基因的表达,其表达水平的变化与LPL及HSL基因的表达一致,表明PPARγ基因的表达与LPL及HSL基因的表达具有协同作用,PPARγ基因通过调节LPL及HSL基因的表达参与脂肪组织的脂类代谢。
4 结 论
①高能量饲粮可下调乌金猪在30和100 kg时脂肪组织HSL、CPT-Ⅰ和PPARγ基因的表达,上调LPL基因的表达,可能降低乌金猪生长的早期和后期阶段脂肪组织中脂肪的分解和脂肪酸的β-氧化。
②高能量饲粮可上调乌金猪在60 kg体重时脂肪组织 HSL、CPT-Ⅰ 、PPARγ和 LPL基因的表达,可能增强这一生长阶段乌金猪脂肪组织中脂肪的分解和脂肪酸的 β-氧化。
[1] 王忠庆,荣耀先.大河乌猪与大河猪(乌金猪)肉质形状研究[J].云南农业科技,2004(增刊):41-44.
[2] MERSMANN H J.Lipoprotein and hormone-sensitive lipases in porcine adipose tissue[J].Journal of Animal Science,1998,76:1396-1404.
[3] DEBERARDINIS R J,LUM J J,THOMPSON C B.Phosphatidylinositol 3-kinase-dependent modulation of carnitine palmitoyltransferase 1A expression regulates lipid metabolism during hematopoietic cell growth[J].Journal of Biological Chemistry,2006,281:37372-37380.
[4] WANG Y,FRIED S K,PETERSEN R N,et al.Somatotropin regulates adipose tissue metabolism in neonatal swine[J].The Journal of Nutrition,1999,129:139-145.
[5] HAUSMAN G J,CAMPION D R,THOMAS G B.Adipose tissue cellularity and histochemistry in fetal swine as affected by genetic selection for high or low backfat[J].Journal of Lipid Research,1983,24:223-228.
[6] BHATIA V,VISWANATAN P.Insulin resistance and PPAR insulin sensitizers[J].Current Opinion in Investigational Drugs,2006,7(10):891-897.
[7] ZHANG X,ZHAO S M,GE C R,et al.Effects of dietary digestible energy levels on meat quality in Wujin pig[J].Chinese Journal of Animal Nutrition,2008,20(4):377-387.
[8] ZHANG X,ZHAO S M,GE C R,et al.Effects of dietary energy levels on growth performance and carcass composition of Wujin pigs[J].Chinese Journal of Animal Nutrition,2008,20(5):489-450.
[9] ZHAO M S,WANG J,SONG L X,et al.Impact of dietary protein on lipid metabolism related gene expression in porcine adipose tissue[J].Nutrition&Metabolism,2010,7(1):6-18.
[10] 潘洪彬,赵素梅,王静,等.饲粮能量水平对乌金猪脂肪组织脂类合成代谢相关基因表达的影响[J].动物营养学报,2011,23(5)781-788.
[11] 张宏福,张子仪.动物营养参数与饲养标准:中国肉脂型生长肥育猪饲养标准[M].北京:中国农业出版社,1998.
[12] ZHAO S,MA H,ZOU S,et al.Hepatic lipogenesis gene expression in broiler chicken with different fat deposition during embryonic development[J].Journal of Veterinary Medicine Series A,2007,54:1-6.
[13] LANGFORT J,PLOUG T,IHLEMANN J.Hormone-sensitive lipase(HSL)expression and regulation in skeletal muscle[J].Advances in Exprimental Medicine and Biology,1998,441:219-228.
[14] PEYOT M L,CHRISTOPHER J,SONI N K,et al.Hormone-sensitive lipase has a role in lipid signaling for insulin secretion but is nonessential for the incretin action of glucagon-like peptide[J].Diabetes,2004,53:1733-1742.
[15] SMITH T R,MCNAMARA J P.Regulation of bovine adipose tissue metabolism during lactation 6 cellularity and hormone-sensitive lipase activity as affected by genetic merit and energy intake[J].Journal of Dairy Science,1990,73(3):772-783.
[16] TAKAHASHI Y,IDE T.Effect of dietary fats differing in degree of unsaturation on gene expression in rat adipose tissue[J].Annals of Nutrition and Metabolism,1999,43(2):86-97.
[17] PETERS J M,ZHOU H C,RAM P A.Peroxisome proliferator-activated receptor alpha required for gene induction by dehydroepiandrosterone-3 beta-sulfate[J].Molecular Pharmacology,1996,50:67-74.
[18] DENG T,SHAN S,LI P P,et al.Peroxisome proliferator-activated receptor-γ transcriptionally up-regulates hormone-sensitive lipase via the involvement of specificity protein-1[J].Endocrinology,2006,147(2):875-884.
