肺癌血清肿瘤标志物的临床意义
2011-09-11赵肖王孟昭
赵肖 王孟昭
进入21世纪以后,肺癌已经超过胃癌和肝癌成为我国恶性肿瘤死因的第一位[1]。非小细胞肺癌(non-small cell lung cancer, NSCLC)占肺癌的85%,5年生存率仅15%。小细胞肺癌(small cell lung cancer, SCLC)的2年生存率仅为1%。70%的肺癌患者在确诊时已经是局部晚期或远处转移(IIIb/IV期),失去了手术机会,缺乏有效的治疗手段[2]。如果肺癌患者能在Ia期被诊断,那么5年生存率可提高到80%[3]。因此肺癌的早期诊断成为我国临床医生和科研工作者的重要任务。
肿瘤标志物(tumor markers, TMs)是一类在肿瘤发生、发展过程中,由肿瘤细胞所产生和分泌并释放到血液、体液、组织中反映肿瘤存在和生长的一类物质。好的肿瘤标志物应具有较高的灵敏度和特异性,不但有助于癌症的早期诊断、病理类型的判断和癌症分期,更重要的是能够评估治疗效果和预后并指导个体化治疗。本文对目前应用于临床的6种血清肿瘤标志物进行综述,包括神经元特异性烯醇化酶(neuron-specific enolase,NSE)、胃泌素释放肽前体(pro-gastrin-releasing peptide,ProGRP)、细胞角蛋白19片段(CYFRA 21-1)、组织多肽抗原(Tissue Polypeptide Antigen, TPA)、鳞状细胞癌相关抗原(squamous cell carcinoma related antigen, SCC-Ag)和癌胚抗原(carcinoembryonic antign, CEA)。
1 神经元特异性烯醇化酶(NSE)
NSE是神经源性细胞分泌的一种蛋白酶,在神经内分泌肿瘤中明显升高。正常人和良性疾病患者的平均NSE血清浓度为(4.2±1.1)ng/mL。一般>12.3 ng/mL-13 ng/mL则认为升高。NSE在SCLC增高明显,在NSCLC也可升高。一些良性疾病和其它器官恶性肿瘤中NSE也可升高,如感染性疾病和甲状腺髓样癌、黑色素瘤、神经母细胞瘤、嗜铬细胞瘤、胰岛细胞瘤、视网膜母细胞瘤等。
一些研究[4-7]认为NSE对SCLC的诊断敏感性达64%-74.5%,主要对广泛期患者有较好的诊断作用,但这些研究样本量较小。Shibayama等[8]比较了114例SCLC、142例NSCLC、103例肺良性疾病患者和108例正常人的血清NSE浓度,NSE对SCLC的诊断敏感性仅有43%,低于之前的报道。作者认为主要是由于该研究中局限期SCLC占60.5%,而NSE对局限期SCLC的诊断敏感性仅有20.3%。
血清NSE浓度不仅对SCLC的诊断有提示作用,对其治疗效果和预后也有预测作用。Shibayama等[8]研究比较了27例血清NSE水平升高的SCLC患者和47例水平正常的SCLC患者在接受化疗后的客观完全缓解率(18.5%vs 61.7%, P<0.001)、中位生存期(10.5个月 vs 21.3个月,P=0.003)和5年生存率(3.7% vs 27.5%, P=0.003),结果显示了NSE的升高提示预后不良和较短的生存期。
NSE对SCLC的复发也有一定的预测价值。Niho等[9]研究显示,在66例复发的SCLC患者中,53%的患者血清NSE水平升高,但NSE并不是复发的强预测因子。在Okusaka等[10]的研究中,44例SCLC中26例复发,其中19例NSE水平升高,并且19例中有7例(39%)接受一线化疗后NSE血清水平下降,复发时又重新升高(NSE升高定义为连续两天NSE升高水平较前次测定增加>10%,或一次测定较前增加>50%)。这7例患者血清NSE升高的时间较临床复发平均晚20天(-85天-124天)。血清NSE的水平在治疗后是否变化对生存期并无影响,多项研究[9-11]都得出了相同的结论,但样本量均较小,结论是否能扩展到所有SCLC患者需要较大样本量的研究。
NSE对NSCLC诊断的敏感性较低,仅有10%-20%的NSCLC患者血清NSE浓度升高(一般比正常值高1-2倍)。Molina等[12]测定了211例NSCLC患者的NSE水平,其中45(21.3%)例升高,无统计学差异;但多变量分析发现NSE的升高与NSCLC患者的生存期呈现负相关,可作为NSCLC患者生存期的独立预测因子。
Paone等[13]对50例NSCLC和17例SCLC的研究显示,NSE与CYFRA 21-1联用对鉴别SCLC和NSCLC有97%的准确率,特别是对进展期肺癌病理类型的判断有很大帮助。
2 胃泌素释放肽前体(ProGRP)
ProGRP是由胃肠道分泌的一种促胃泌素释放肽(GRP)前体,可存在于胎儿肺的神经内分泌细胞内。ProGRP血清浓度>46 pg/mL-50 pg/mL认为升高,而正常人和良性疾病患者一般为(21.7±9.1)pg/mL。在SCLC患者中ProGRP血清浓度升高明显,可达到(1,673.9±706)pg/mL。如果ProGRP血清浓度>200 pg/mL,则应高度怀疑SCLC。研究[14]显示ProGRP血清中位浓度局限期SCLC患者为472 pg/mL,而广泛期SCLC患者高达1,136 pg/mL。ProGRP在一些良性疾病和其它恶性疾病中也会升高,如肾脏功能衰竭患者的ProGRP血清浓度可高达310 pg/mL,但一般仍低于SCLC患者。
ProGRP对SCLC诊断的敏感性在47%-86%之间[6,7]。与NSE相比,ProGRP对于SCLC诊断的敏感性更高,尤其对于局限期SCLC。研究[8]显示ProGRP和NSE对SCLC的诊断敏感性分别为64.9%和43.0%(P<0.01),特别对于局限期SCLC ProGRP更显示出明显的优势(56.5% vs 20.3%,P<0.01)。
ProGRP对SCLC患者治疗效果评估和复发监测也起到一定的作用[15]。在Okusaka等[10]的研究中,26例复发SCLC患者中18例患者一线化疗前ProGRP血清浓度升高,接受化疗后ProGRP血清浓度下降,其中17例(94%)患者在疾病复发时再次升高。ProGRP血清浓度的升高平均较临床复发早35天(-95天-151天)。
Hirose等[16]对178例SCLC患者进行了血清ProGRP和NSE水平的研究。化疗有效后复发患者123例,其中103例患者治疗前血清ProGRP和/或NSE水平升高,在一线化疗完成时和复发时再次测定血清ProGRP或NSE水平。在复发的患者中,血清ProGRP和NSE水平升高的患者分别占69.3%(70/101)和60.2%(56/93)(P=0.38);两项都升高的占45.1%(41/91),其中至少一项升高的占81.3%(74/91)。复发时血清ProGRP水平升高的患者中,其中63例(84%)治疗前血清ProGRP水平高于正常,只有7例(16%)患者治疗前血清ProGRP水平正常。对于没有复发的患者,均未观察到血清ProGRP和NSE水平的升高。在该研究中只有4例患者血清ProGRP或NSE水平升高发生在临床复发前,3例在临床复发2个月前出现血清学肿瘤标志物异常,1例发生在10个月前。复发时血清ProGRP水平升高对生存期并无影响(7个月vs 9个月,P=0.17)。而NSE可作为SCLC患者复发后生存期的独立预测指标,复发时血清NSE水平升高的患者较正常水平的患者生存期明显缩短(6个月vs 14个月,P<0.001)。
ProGRP对SCLC患者的预后也有一定的评估作用,但对生存期的预测没有NSE有优势。有研究[8]测定了73例接受化疗的SCLC患者血清ProGRP浓度,并比较了血清ProGRP浓度和生存期的关系。47例血清ProGRP浓度升高和27例血清ProGRP浓度正常的SCLC患者相比中位生存期(16.4个月vs 25.7个月,P=0.038)和5年生存率(10.6% vs 32.9%, P=0.038)都较低,危险比(Hazard Ratio, HR)为1.65(95%CI: 0.86-3.19, P=0.134)。
NSE与ProGRP联合应用可提高SCLC的诊断率,对SCLC患者化疗疗效和生存期预测有很好的评估作用[9-11,17]。
10%-30%左右的NSCLC患者的ProGRP血清浓度也会升高,鳞癌患者比腺癌患者升高程度更明显,但一般升高程度<120 pg/mL[18,19]。Nisman等[20]测定了88例NSCLC患者的血清ProGRP和NSE浓度,通过单变量分析发现血清ProGRP浓度与NSCLC患者生存率有关(P=0.03)。
3 细胞角蛋白19片段(CYFRA 21-1)
细胞角蛋白19片段是细胞角蛋白中间丝的亚单位,表达于上皮细胞和上皮细胞来源的恶性肿瘤细胞。血清CYFRA 21-1正常值一般<1.5 ng/mL,如>3.2 ng/mL-3.6 ng/mL认为阳性。NSCLC患者的血清CYFRA 21-1升高较明显,部分SCLC患者的血清CYFRA 21-1浓度也会升高。而ProGRP和NSE正常的SCLC的CYFRA 21-1一般并不升高。一些肺良性疾病CYFRA 21-1血清浓度也有可能升高。
以往文献报道血清CYFRA 21-1诊断NSCLC的敏感性差异较大,范围为23%-70%。但对于鳞癌,一般均认为CYFRA 21-1有较高的敏感性。CYFRA 21-1与CEA联合应用诊断NSCLC敏感性达81%,然而即使CEA和CYFRA 21-1都升高对NSCLC的诊断也不具特异性。
Ardizzoni等[21]对107例晚期NSCLC患者化疗前和2个疗程后的血清CYFRA 21-1和CEA浓度进行了测定和分析,结果显示患者血清CYFRA 21-1和CEA下降与影像学客观疗效相关,如浓度下降>20%可认为化疗有效,并且血清CYFRA 21-1和CEA浓度是生存的强独立预测因子。其它研究[22,23]也得出了相似的结论 。
Ando等[24]对57例SCLC患者的研究显示,NSE与CYFRA 21-1联用可对SCLC患者的预后进行预测,两者都升高的患者较仅NSE升高的患者死亡风险比明显升高。
联合ProGRP、NSE和CYFRA 21-1对于鉴别SCLC和NSCLC有重要意义。Lou等[25]测定了52例晚期转移肺癌患者的ProGRP、NSE和CYFRA21-1血清水平。SCLC患者ProGRP(P<0.001)和NSE(P<0.03)血清浓度明显升高。多变量分析显示联合这3种肿瘤标志物对于鉴别SCLC和NSCLC有很高的准确度(C Index=0.98)。
Pujol等[26]对128例NSCLC患者的研究显示鳞癌患者血清CYFRA 21-1浓度升高较明显,平均血清浓度达5.6 ng/mL,其它病理类型的肺癌患者血清CYFRA 21-1浓度仅轻度升高(平均血清浓度<4 ng/mL);血清CYFRA 21-1浓度与疾病严重程度有关,IV期NSCLC患者的CYFRA 21-1血清浓度升高明显,平均可达7.4 ng/mL,而局限期NSCLC患者血清CYFRA 21-1平均浓度仅为3.8 ng/mL。2,063例NSCLC患者的meta分析[27]显示CYFRA 21-1血清浓度高的患者生存期少于正常浓度的患者,可作为一项独立预后因素。
4 组织多肽抗原(TPA)
TPA是细胞角质蛋白8、18和19的循环多肽复合物,血清TPA浓度与细胞增殖和肿瘤生长速度有关。TPA对于肺癌的诊断并不具有特异性,在很多其它类型的恶性肿瘤中TPA血清浓度都可升高。一些良性疾病也可引起TPA的升高,如感染性疾病、急性肝炎、妊娠和一些自身免疫性疾病。Buccheri等[28]测定了226例肺癌患者的血清TPA浓度,其中137例(61%)水平升高(>100 U/L),平均血清浓度为204 U/L。TPA升高水平与组织类型无关,但与肿瘤分期有关, TNM分期越晚血清TPA浓度越高。
TPA的升高也预示着预后不良。Matsuguma等[29]对344例完全切除的I期NSCLC患者进行了前瞻性研究,其中12%的患者术前血清TPA浓度升高,与血清TPA浓度正常的患者相比其5年生存率下降(66% vs 81%,P=0.031,1)。
5 鳞状细胞癌相关抗原(SCC-Ag)
SCC-Ag是一种细胞结构蛋白,在各组织来源的鳞状细胞癌其血清浓度升高,皮肤病和肺部感染时也会升高。正常人的血清SCC-Ag浓度一般<1.5 ng/mL。SCC-Ag对NSCLC诊断的敏感性为15%-55%,而对SCLC的诊断敏感性仅有15.5%。在排除肾衰竭的情况下,SCC-Ag升高高度提示NSCLC可能。
SCC-Ag对于肺鳞癌患者的诊断敏感性较高。Molina等[19]的研究中,472例NSCLC患者中101例(21.4%)血清SCC-Ag浓度升高,平均浓度为(0.8±0.4)ng/mL,而175例SCLC患者的血清SCC-Ag均正常,平均浓度为(0.5±0.1)ng/mL;在310例良性疾病患者中有6例血清SCCAg浓度升高。其中75例鳞癌患者SCC-Ag血清浓度升高明显,50例为I期-III期鳞癌患者,平均SCC-Ag血清浓度为1.35 ng/mL,25例为IV期鳞癌患者,平均血清SCC-Ag浓度为2.5 ng/mL;290例非鳞癌患者中血清SCC-Ag浓度升高的患者仅占6.5%,平均血清SCC-Ag浓度<0.7 ng/mL。
对200例肺鳞癌患者的研究[30]显示,SCC-Ag对肺鳞癌的诊断敏感性为0.72(95%CI: 0.65-0.78),其中76%的患者SCC-Ag≤2.8 ng/mL,中位生存期为12个月;24%的患者SCC-Ag>2.8 ng/mL,中位生存期为8个月;多变量分析显示SCC-Ag的升高对生存期并无影响(RR=1, 95%CI:0.71-1.52)。
对354例(鳞癌占23%)完全切除的I期NSCLC患者的研究[29]认为术前血清SCC-Ag浓度与患者预后相关,术前12%的患者血清SCC-Ag浓度升高,与血清SCCAg浓度正常的患者相比5年生存率下降(63% vs 82%,P=0.004,5)。
6 癌胚抗原(CEA)
CEA是由胃肠道细胞分泌的一类糖蛋白,可引起机体的免疫反应,其升高主要见于消化系统肿瘤,肺癌患者血清CEA也可升高。CEA经肝脏代谢,因此肝脏的良性疾病也可导致CEA升高,尤其是胆管阻塞和胆汁淤积。早期研究显示健康的吸烟者较非吸烟者血清CEA浓度高。文献报道正常血清CEA值为2.5 ng/mL-6.9 ng/mL,大部分研究CEA阳性判断值为5 ng/mL。良性疾病导致的CEA升高通常<10 ng/mL。
血清CEA浓度升高有助于肺癌的诊断。在Molina[19]的研究中,472例NSCLC患者其中256例(54.2%)血清CEA浓度升高,平均浓度为5.8 ng/mL;175例SCLC患者中84例(48%)血清CEA浓度升高,平均浓度为4.8 ng/mL;而310例良性疾病患者中仅16例患者血清CEA浓度升高,平均浓度<3 ng/mL。182例鳞癌患者平均血清CEA浓度<6 ng/mL;205例腺癌患者CEA血清浓度升高明显,I-III期肺腺癌患者平均血清浓度为6.4 ng/mL,IV期肺腺癌患者平均血清CEA浓度为19.5 ng/mL。
CEA单独升高对NSCLC并无诊断意义,因为在其它很多恶性肿瘤中CEA都会升高。CEA和CYFRA 21-1联合应用对NSCLC的预测较有意义。联合CEA、SCC-Ag和Cyfra21-1对NSCLC的诊断和评估具有很高的敏感性。
Matsuguma等[29]测定了355例可完全切除的I期NSCLC患者的血清CEA、Cyfra21-1、SCC、CA19-9、CA125、TPA、NSE、SLX浓度。研究显示在众多的NSCLC肿瘤标志物中,对手术完全切除的I期患者进行预后评估CEA是最好的预测指标。与术前血清CEA浓度正常的患者相比,CEA升高的患者5年生存率下降(52% vs 89%,P<0.000,1),因此认为对于术前CEA升高的完全切除的I期NSCLC患者,应密切随访或积极进行术后辅助化疗。
研究[31]测定了1,000例临床I期的NSCLC患者术前和术后的血清CEA浓度。其中术前632例正常,368例升高。在368例血清CEA浓度升高的患者中,242例术后降到正常水平以下。术前CEA水平正常和CEA水平升高患者的5年生存率分别是75.2%和53.8%(P<0.000,1)。术前CEA血清浓度升高的患者术后CEA水平也与生存率相关。术后CEA水平降到正常值以下的患者与术后CEA仍然升高患者的5年生存率分别为62.6%和35.2%。因此术后CEA水平仍升高,预示着预后不良,应密切随访。在该研究中有13例患者术前血清CEA浓度>50 ng/mL,虽然都是I期患者,9例复发时便为远处转移,但3例患者生存期长于5年。
对于不可手术切除的晚期NSCLC患者,治疗前CEA血清浓度的升高也预示着较短的生存期。Cedres等[32]对320例(鳞癌23.8%、腺癌39.7%)NSCLC患者血清CEA水平和无疾病进展期、生存期的关系进行了研究。其中275例为进展期NSCLC,血清CEA水平升高的患者与CEA水平正常患者相比,无疾病进展期(5.3个月 vs 7.4个月,P=0.011)和生存期(10.0个月 vs 14.0个月,P=0.085)都缩短。
Pollan等[33]对390例NSCLC患者的研究显示,CEA血清浓度的升高对鳞癌患者的生存期并无影响,但对于腺癌患者和其它类型NSCLC,CEA血清浓度的升高预示着预后不良。
7 联合应用几种肿瘤标志物对于NSCLC和SCLC的鉴别
Molina等[19]测定了647例肺癌患者(NSCLC 472例,SCLC 175例)的多种肿瘤标志物,包括NSE、ProGRP、CYFRA 21-1、SCC、CEA、CA125,发现在这几种肿瘤标志物中ProGRP和CYFRA 21-1分别对SCLC和NSCLC的诊断敏感性最高。联合上述几种肿瘤标志物鉴别SCLC和NSCLC可达77.4%的准确率。Molina为临床工作者提供了一个实用的病理类型鉴别步骤,见图1。
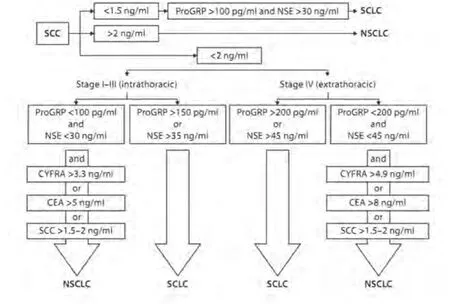
图1 SCLC和NSCLC病理类型判断步骤Fig 1 Algorithm to suggest the specific histological diagnosis using serum tumor markers
目前肿瘤标志物研究存还存在很多问题。肿瘤标志物在肿瘤的诊断、疗效评估和预后预测等方面主要作为辅助指标应用。近几十年寻找新的肿瘤标志物研究并无突破,正在研究中的肿瘤标志物很多,但是很少能应用于临床。目前肿瘤标志物研究中主要存在以下几个问题[34,35]:临床试验均为回顾性的研究,没有事先设定明确的检验假设;试验的样本量较少,大多数临床试验结论没有统计学意义;临床试验中设定的主要观察指标并非最佳选择;由于研究方法、阳性判断值和主要观察指标的不同,各试验所得到的结论不具有可比性。
因此应在临床试验实施前完善试验设计,使试验的可信度更高,而且肿瘤标志物的研究应以应用于临床为目标。临床肿瘤研究试验评估方案(PACCT)中关于肿瘤标志物研究的指南草案[36]指出,临床研究设计应遵循以下步骤:确定潜在有意义的肿瘤标志物、临床试验设计的改进和细化、临床应用的初步评估、试验设计标准化、试验和临床应用的最终确认。
今后对于肿瘤标志物的研究应向以下方向发展:①通过大规模临床实验验证肿瘤标志物的特异性,包括其它疾病,特别是感染性疾病;② 通过技术的进步,找到针对肺癌不同病理类型的更加特异的肿瘤标志物;③ 联合几种不同的肿瘤标志物进行诊断。
