高分辨熔解曲线法检测非小细胞肺癌p53基因的突变
2011-09-11陈志红安社娟谢至严红虹陈剑光苏健张绪超牛飞玉郭伟浜吴一龙
陈志红 安社娟 谢至 严红虹 陈剑光 苏健 张绪超 牛飞玉 郭伟浜 吴一龙
p53基因是迄今为止发现的与人类多种肿瘤相关性最高的基因。野生型p53基因是一个肿瘤抑制基因,而其突变型则具有致癌作用,p53基因突变广泛分布外显子5-8,可达95%-98%[1,2]。但p53的突变热点较多,比较分散,目前通常采用组织DNA直接测序法检测p53基因突变,费时且昂贵,无法满足临床需要。本研究旨在建立高分辨熔解曲线(high resolution melting, HRM)检测非小细胞肺癌(non-small cell lung cancer, NSCLC)患者p53基因突变的方法[3,4],探讨p53基因突变的特点及其在NSCLC发生发展中的演变规律。
1 材料与方法
1.1 标本来源 病例组为2007年-2009年广东省人民医院的NSCLC患者肿瘤标本,共264例,均为汉族,男184例,女80例,年龄23岁-88岁,均经病理学诊断确诊,且在知情同意后签署了知情同意书。对照组为肺癌患者的癌旁组织标本,共54例,均为汉族,男38例,女16例,年龄28岁-62岁。
1.2 主要试剂与仪器 HRM分析必需试剂:LightCycler 480 High Resolution Melting Master(瑞士Roche公司);其它试剂和仪器:DNA 抽提试剂盒(上海华舜公司)、pGEM-T(美国Promega公司)、Gel Extraction Kit(德国Qiagen公司)、BIGDYE (美国Applied Biosystems公司)、核酸蛋白测定仪(德国Eppendorf公司)、PCR扩增仪(美国BD公司)、LightCycler 480荧光定量分析仪(瑞士Roche公司)、ABI3100测序仪(美国Applied Biosystems公司)。
1.3 方法
1.3.1 标本采集和DNA提取 组织在手术切除后快速冻存于液氮中,-80oC保存待用。将冰冻切片评估肿瘤组织含量>50%的标本用于检测。组织样本(50 mg)中的DNA提取按照基因组DNA 抽提试剂盒说明书操作。使用Eppendorf核酸蛋白测定仪测定DNA纯度及含量,要求吸光度(A)值280/260>1.80,调整DNA浓度至5 ng/μL。
1.3.2 HRM检测 按照文献[5]设计p53基因突变检测引物,外显子5-8的引物序列见表1。所有引物均由大连宝生物公司合成,用HPLC进行纯化。PCR体系包括10 ng的基因组DNA、1xPCR Master mix、3 mmol/L MgCl2、250 nmol/L的正反向引物,并用PCR级别的水补足至20 μL。所有的PCR均重复2次。PCR和HRM分析均在LightCycler 480荧光定量分析仪上进行。PCR条件:95oC 10 m,95oC 10 s,60oC 15 s,72oC 25 s,45个循环。HRM分析条件:95oC 1 min,40oC 1 min,熔解曲线数据收集从65oC到95oC温度上升率为1oC/s,且每升高1oC进行25次数据采集。
1.3.3 p53基因突变型和野生型(wild-type, wt)质粒的构建 采用TA克隆法分别构建p53基因外显子5-8的野生型克隆和突变型克隆,即分别以p53外显子5-8的测序结果为阳性的标本的DNA和测序结果为阴性的标本的DNA为模板进行PCR。PCR产物采用凝胶回收试剂盒进行回收纯化,纯化产物与pGEM-T载体连接,转化入大肠杆菌感受态细胞。37 °C过夜培养,筛选出重组体。将重组体加至细菌Luria-Bertani(LB)培养基,37 °C摇床孵育过夜,提取质粒、测序,验证转入序列的准确性。序列正确的质粒-20 °C保存待用。
1.3.4 HRM分析的灵敏性试验 野生型和突变型质粒的DNA浓度均调整至5 ng/μL,然后按不同比例将二者混合,使得样本中突变型质粒所占的比例分别为2%、5%、10%、20%、50%、100%,各取1 μL混合质粒DNA作为模板用于HRM检测。
1.3.5 直接测序法检测 HRM分析后,阳性标本采用测序引物进行PCR扩增,PCR产物按试剂盒操作说明书切胶过柱纯化,以纯化后的PCR产物为模板,在ABI3100测序仪上按测序试剂盒按照说明书进行测序检测。采用Chromas软件分析测序图谱,判读p53基因外显子5-8的突变类型。
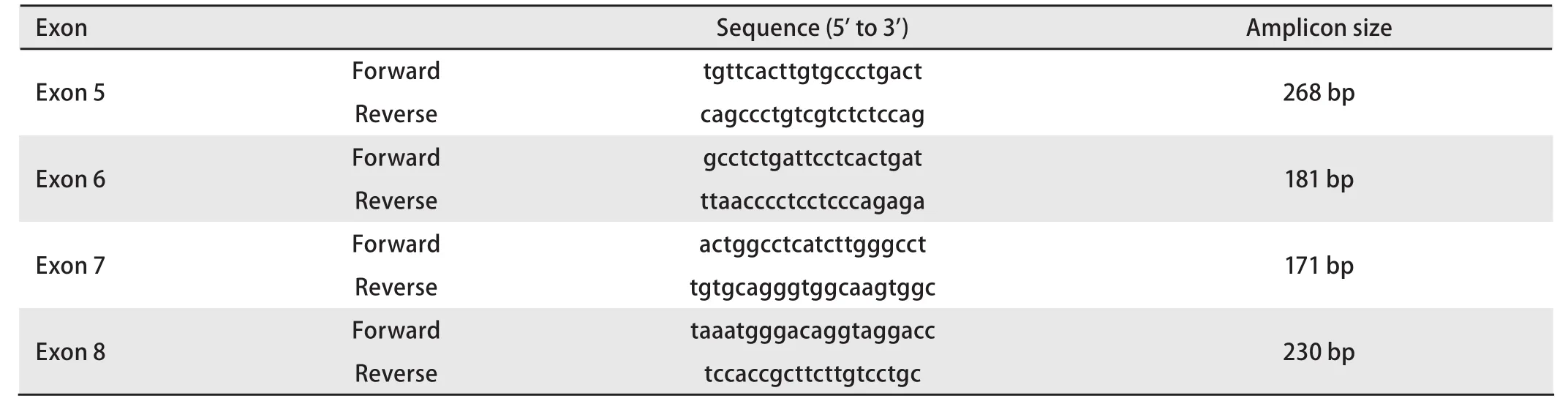
表1 p53 HRM引物表Tab 1 p53 HRM primers
1.3.6 亚克隆测序 HRM法检测阳性而PCR产物直接测序法检测阴性的样品,进一步进行亚克隆测序证实。
1.4 统计学分析 SPSS 13.0统计软件分析数据,采用卡方检验进行分析。P<0.05为差异有统计学意义。
2 结果
2.1 HRM法的检测灵敏性 如图1所示,HRM法检测p53不同外显子不同比例的系列混合质粒DNA,2次结果的重复性好,且可检测出仅含2%-10%突变型DNA混合样本中的突变,提示HRM法检测p53基因突变的灵敏度可达2%-10%。

图1 HRM法检测p53基因外显子5-8的敏感性结果。野生型和突变型质粒混合后突变型所占的比例分别为2% 、5%、10%、20%、50%和100%,分别显示不同颜色的熔解曲线。A:外显子5:蓝(wt),绿(2%),红(5%),棕(10%),黄(20%),灰(50%),紫(100%);B:外显子6:蓝(wt和2%),绿(5%),红(10%),紫(20%),黄(50%),灰(100%);C:外显子7:蓝(wt,2%和5%),绿(10%),灰(20%),紫(50%),红(100%);D:外显子8:红(wt),绿(2%),蓝(5%),黄(10%),紫(20%),灰(50%),棕(100%)。Fig 1 The exon 5-8 of p53 gene sensitive analysis by HRM. The mutation plasmid DNA was mixed with wild-type plasmid DNA to dilute the mutant allele to 2%, 5%, 10%, 20%, 50% and 100% of the total alleles. The melting curves of each dilution are shown in different color.A: exon 5: blue (wt), green (2%), red (5%), brown (10%), yellow (20%), grey (50%) and purple (100%);B: exon 6: blue (wt and 2%), green (5%), red(10%), purple (20%), yellow (50%) and grey (100%);C: exon 7: blue (wt, 2% and 5%), green (10%), grey (20%), purple (50%) and red (100%); D: exon 8:red (wt), green (2%), blue (5%), yellow (10%), purple (20%), grey (50%) and brown (100%).
2.2 HRM法和测序法检测结果 HRM法检测54例对照组的正常组织,未能检出p53基因突变。264例NSCLC患者的组织,检出具有p53基因突变104例,102例经测序法得到证实,突变率为39.4%,1例经亚克隆测序为野生型,1例DAN量不够无法进行亚克隆分析;95例为点突变,其中错义突变74例,无义突变6例,同义突变15例,其余7例为碱基插入和缺失导致的移码突变,突变中碱基转换突变占总突变的93.1%。各外显子不同突变类型的HRM曲线及测序结果见图2-图5。
2.3 p53外显子5-8的突变结果 p53外显子5、6、7、8的突变率分别为11.7%、8%、12.5%、10.6%,差异无统计学意义(P=0.35),且各外显子的突变率与吸烟、分化等临床参数均无关(P>0.05)。
2.4 p53基因突变与临床病理特征的关系(表2) p53基因突变与性别有关,男性突变率(43.5%)明显高于女性(30%)(P=0.039)。p53基因突变与年龄、吸烟、病理、分期和分化等临床病理特征均无关(P>0.05)。
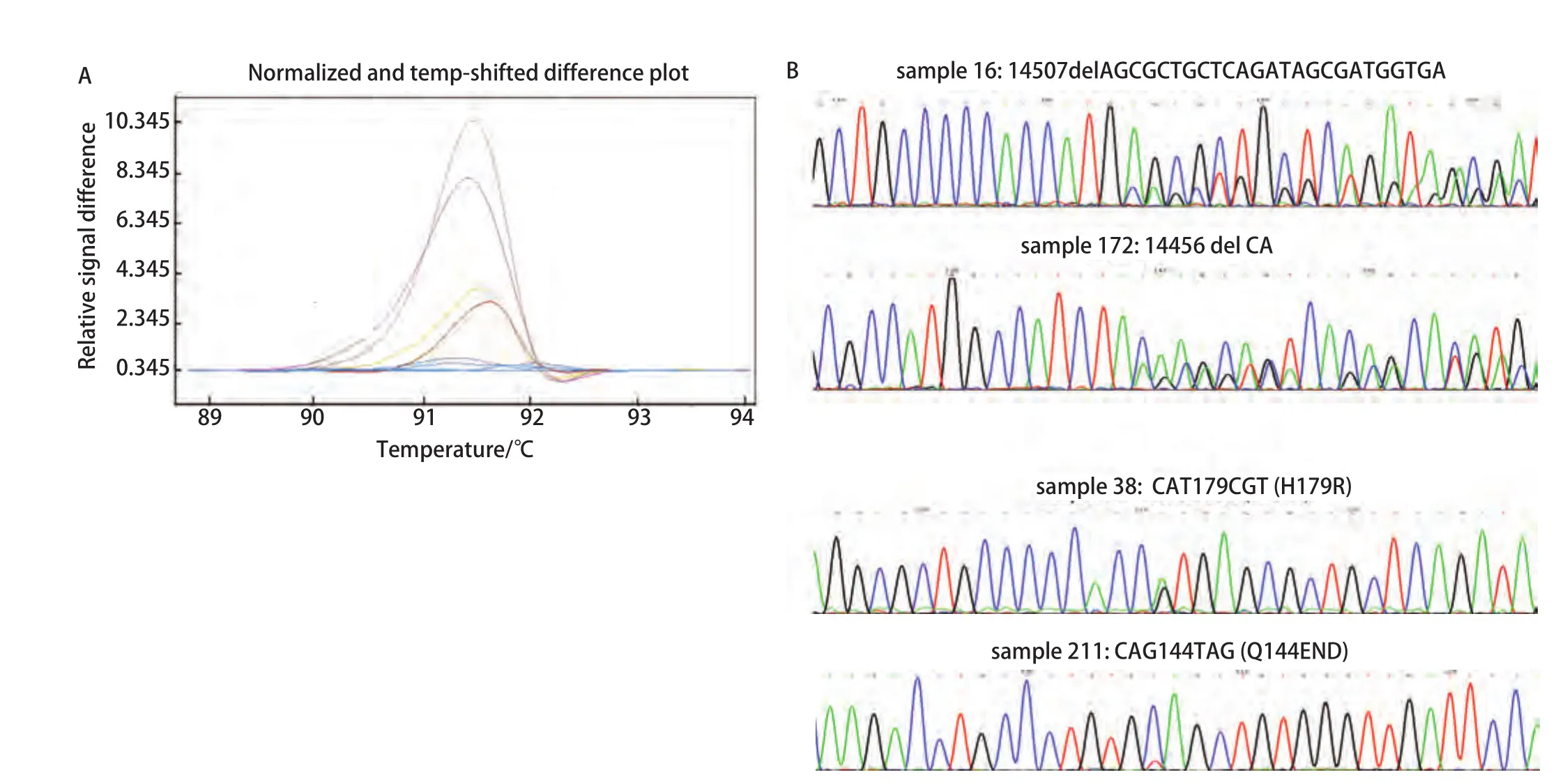
图2 p53外显子5不同突变类型样品的HRM曲线和测序结果。A:HRM曲线图。蓝(野生型),灰(样品16),紫(样品172),黄(样品38),棕(样品211);B:测序结果。Fig 2 HRM difference plot and sequence data for some mutation samples for p53 exon 5. A: Difference plot of some samples. Blue (wt),grey (sample 16), purple (sample 172), yellow (sample 38) and brown(sample 211); B: Sequencing traces for sample16, 172, 38 and 211.
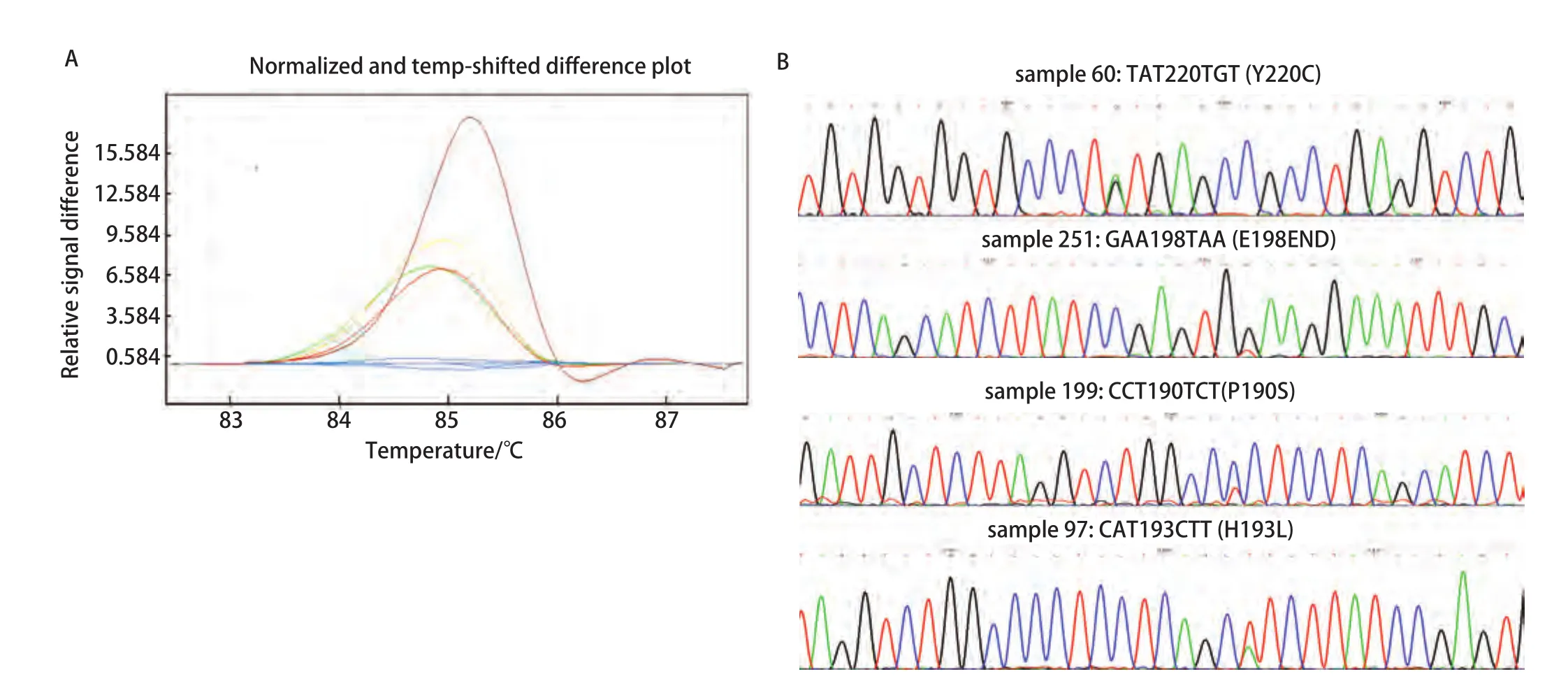
图3 p53外显子6不同突变类型样品的HRM曲线和测序结果。A: HRM曲线图。蓝(野生型),棕(样品60),黄(样品251),绿(样品199),红(样品97);B:测序结果。Fig 3 HRM difference plot and sequence data for some mutation samples for p53 exon 6. A: Difference plot of some samples. Blue (wt),brown (sample 60), yellow (sample 251), green (sample 199) and red(sample 97); B: Sequencing traces for sample 60, 251, 199 and 97.

图4 p53外显子7不同突变类型样品的HRM曲线和测序结果。A: HRM曲线图。蓝(野生型),绿(样品21),紫(样品127),灰(样品132),红(样品220);B:测序结果。Fig 4 HRM difference plot and sequence data for some mutation samples for p53 exon 7. A: Difference plot of some samples. Blue (wt),green (sample 21), purple (sample 127), grey (sample 132) and red(sample220); B: Sequencing traces for sample 21, 127, 132 and 220.

图5 p53外显子8不同突变类型样品的HRM曲线和测序结果。A: HRM曲线图。蓝(野生型),紫(样品48),灰(样品167),棕(样品154),绿(样品147),黄(样品67);B:测序结果。Fig 5 HRM difference plot and sequence data for some mutation samples for p53 exon 8. A: Difference plot of some samples. Blue (wt),purple (sample 48), grey (sample 167), brown (sample 154), green(sample 147) and yellow (sample 67); B: Sequencing traces for sample 48, 167, 154, 147 and 67.
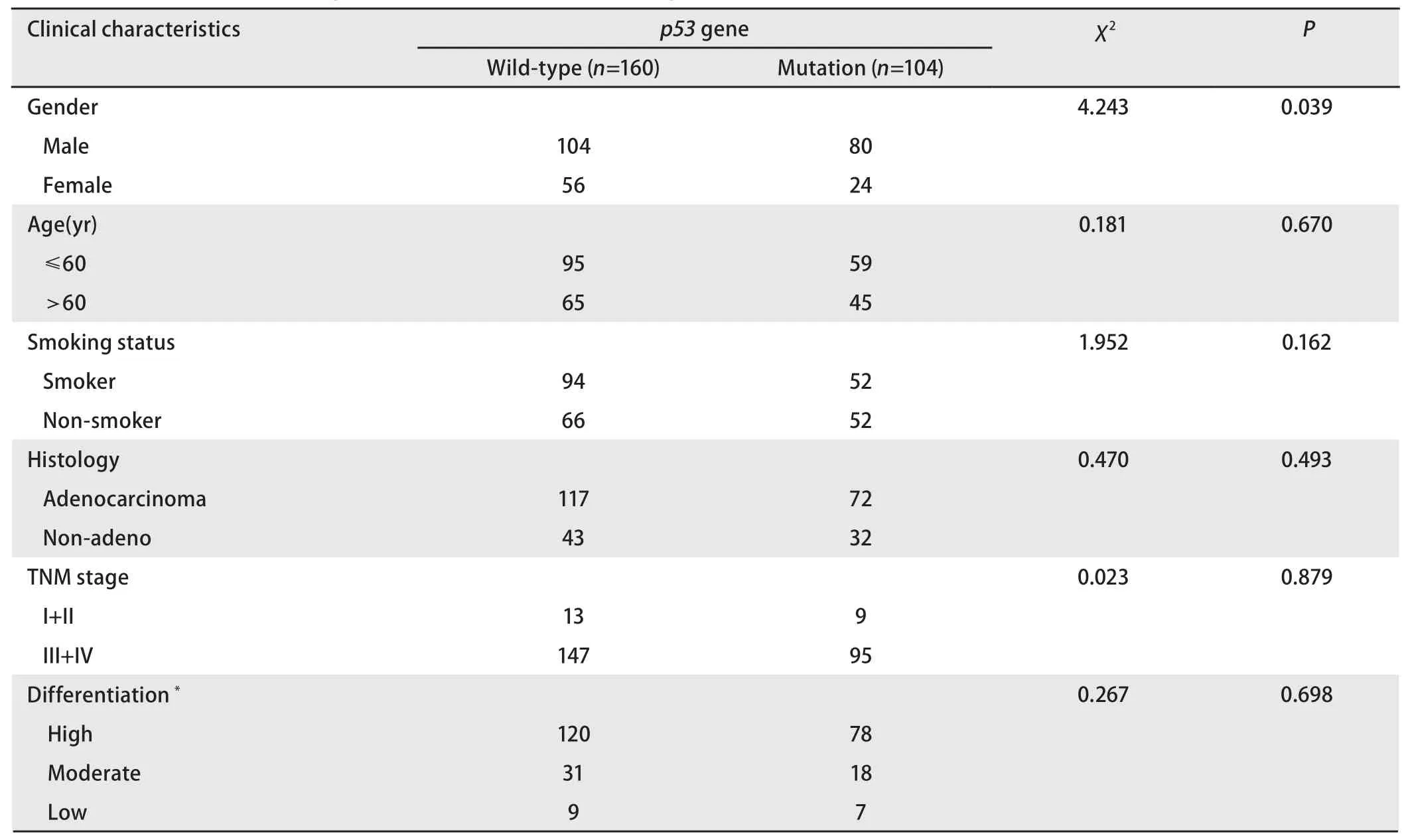
表2 p53基因突变与临床病理特征的关系Tab 2 Correlation between p53 gene mutations and clinicopathologic features
3 讨论
抑癌基因p53的突变已被证实与人类半数以上的肿癌发生有关。该基因编码一种分子量为53 kDa的蛋白质,命名为p53。一旦p53基因发生突变,p53蛋白失活,细胞分裂失去节制发生癌变。目前对p53基因变异与肿癌生物学行为关系的研究发现,在肺癌、胃癌、乳腺癌及大肠癌中,具有p53突变患者的恶性程度较高、预后较差[2,6,7]。本研究采用HRM结合DNA序列分析法在39.4%的NSCLC癌组织中检出p53突变,且突变与临床分期和分化程度均无关系,提示p53基因突变可能于肺癌早期就发生,并持续于肿瘤发展的全过程,有助于判断NSCLC患者的预后。p53基因有多种突变类型,主要为点突变,导致碱基转换,发生错义突变,本研究结果与Lee等[8]的报道一致。Suzuki等[9]报道p53基因突变与吸烟有相关性,本研究结果显示p53基因突变虽然在吸烟者中较多见,但吸烟与非吸烟患者间无统计学意义。p53基因突变在男性中的发生率明显高于女性,这与Lee等[8]报道非吸烟女性中p53基因突变的发生率较低相一致。 p53基因突变的突变特点和分布等均无统计学意义,提示p53基因突变是自发性突变,可能是在DNA合成和修复过程中的随机错误所致。
本研究共发现7例p53基因由于碱基插入和缺失导致的移码突变,HRM法和测序法均可确定。其测序图谱部分为单一峰,从突变位置开始为重叠峰。为确定是含有杂合突变还是由于PCR错配而导致的重叠峰,可采用高保真酶重复进行PCR和测序,如出现重叠峰的位置均一致,可判断为杂合突变,因为PCR错配的发生点不是唯一的,每次均发生在同一点的几率较少,或者进行克隆性测序。
目前检测基因突变的方法有很多,最常用的有直接测序法、荧光探针法、单链构象多态(single-strand conformation polymorphism, SSCP)法、变性高效液相色谱法(denaturing high performance liquid chromatography,DHPLC)等,各种方法均有不同的优缺点。直接测序法由于能直接鉴别出具体突变的碱基,所以一直都被作为检测突变的金标准。但这种方法步骤繁琐,耗时长,费用高,敏感性相对低,难以达到临床上的需要。本研究使用的HRM法是近几年来在国内外兴起的最新的单核苷酸多态性(single-nucleotide polymorphism, SNP)及突变研究的工具。它是通过熔解温度(Tm)的迁移而产生不同形状的熔解曲线来区分不同的基因型。这种方法不受突变碱基位点与类型的局限,无需根据不同的序列设计特异性探针,在PCR结束后直接运行高分辨率熔解,就可完成对样品基因型的分析。HRM法所使用的PCR扩增酶必须是热启动酶,减少非特异性扩增,使用的染料必须是饱和染料,才能根据熔解曲线的不同来区分不同的基因型。应用HRM法筛选NSCLC肿瘤标本的p53基因突变样品,具有操作简便、快速、敏感、单管避免污染等优点,完全符合临床个体化治疗的要求,值得推广。
