辣椒基因组DNA不同提取方法的比较研究
2011-09-07蓬桂华詹永发苏丹何建文
蓬桂华,詹永发,苏丹,何建文
(贵州省辣椒研究所,贵州遵义,563006)
辣椒以其特有的色泽、辣味、香味和丰富的维生素C而成为一种世界性的蔬菜作物,它既可鲜食、调味,也可入药,是提炼辣椒油、辣椒红素和辣椒素的原料,具有重要的经济价值和食疗保健作用[1]。
近年来,辣椒分子领域的研究逐步成为国内外研究的热点,而提取高质量的DNA分子是分子研究的基础。目前,常用的的DNA提取方法主要有十六烷基三乙基溴化铵 (CTAB)法、十二烷基硫酸钠(SDS)法和高盐低pH法[2]。其中,SDS法操作简单、温和,并可提取到较高分子量DNA,但所得产物含糖类杂质较多,这将直接影响DNA的限制性核酸内切酶酶切效果;CTAB可破碎细胞壁和细胞膜,并能与核酸形成复合物,再加入乙醇后可使核酸沉淀,而CTAB则溶于乙醇,进而从富含多酚和多糖的植物组织中分离出高质量基因组DNA[3];高盐低pH法可有效地防止组织破碎和沉淀大量材料时的电离化作用及酚类化合物的进一步氧化[4],但高盐低pH法提取DNA产率较低,且残留的较多小分子盐也会影响分子生物学试验结果[2]。由于不同材料所含的物质成分及各种成分的含量差异较大,而这种差异随植物种类、植物组织或植物组织的发育阶段等的不同而变化,因此,对于不同植物DNA提取应采取不同的方法[5]。
本研究采用改良CTAB法和SDS法分别提取辣椒基因组DNA,并对这2种方法进行比较分析,旨在筛选出一种快速、简便且可获得高质量DNA分子的提取方法,为进一步开展辣椒分子生物学研究奠定基础。
1 材料与方法
1.1 试验材料
供试材料为辣椒种子A和B,均由贵州省辣椒研究所提供。将2层滤纸放入培养皿构成发芽苗床进行辣椒种子发芽,期间用Hoagland's营养液浇灌,待幼苗长出2~3片真叶时,取幼嫩植株。
供试仪器有高速冷冻离心机(Benkman),恒温水槽,水平电泳仪 (DYY-7C),核酸蛋白分析仪(Gene Quit 1300),全自动凝胶系统。
供试试剂有 EDTA、NaCl、CTAB、巯基乙醇、氯仿、异戊醇、异丙醇、乙醇、SDS、β-巯基乙醇、醋酸钾、琼脂糖。
1.2 试验方法
①改良的CTAB法 按照提取植物DNA的经典方法加以改良来提取辣椒DNA:取0.1 g新鲜辣椒幼嫩植株,置于研钵中,加入700 μL 2%的CTAB提取液磨样,转入1.5 mL的离心管中;65℃水浴30 min(期间取出振荡2次);取出冷却至室温,加等体积的氯仿/异戊醇(24∶1),摇床上(130~140 r/min)摇至乳白色;4 000 r/min离心10 min;取出上清液至另一支1.5 mL离心管,加入0.8倍体积的异丙醇(-20℃下预冷)沉淀 DNA,静置或轻摇;8 000 r/min离心 2 min,弃掉上清液;加1 mL 70%乙醇(-20℃下预冷)洗涤;8 000 r/min离心2 min,倒掉乙醇,自然干燥至无乙醇味;加200 μL超纯水4℃下溶解;-20℃保存。
②SDS法 取0.1 g新鲜辣椒幼嫩植株,置于研钵中,加入700 μL的SDS提取液磨样,转入1.5 mL的离心管中;65℃水浴30 min(期间取出振荡2次);取出冷却至室温,加入250 μL醋酸钾冰上震荡20 min,4 000 r/min离心10 min;取出上清液至另一支1.5 mL离心管,加入0.8倍体积的异丙醇(-20℃下预冷)沉淀 DNA,静置或轻摇;8 000 r/min离心2 min,弃掉上清液;加1 mL 70%乙醇(-20℃下预冷)洗涤;8 000 r/min离心2 min,倒掉乙醇,自然干燥至无乙醇味;加200 μL超纯水4℃下溶解;-20℃保存。
③基因组DNA样品的浓度检测 利用核酸蛋白分析仪检测所提取DNA样品的浓度和质量,并根据A260/A280值判断DNA样品的纯度。纯DNA样品的 A260/A280值应为 1.8~1.9,A260/A230值应大于2.0。A260/A280值大于1.9时,表明有RNA污染;小于1.6时,表明样品中存在蛋白质或酚类物质污染。A260/A230值小于2.0时,表明溶液中有残存盐和小分子杂质,如核甘酸、氨基酸、酚等[6]。
④基因组DNA样品琼脂糖凝胶电泳检测 用1%的琼脂糖凝胶电泳及godview染色,检测提取基因组DNA质量,然后用凝胶成像系统观察、成像。
2 结果与分析
2.1 DNA提取方法的结果比较
由表1可以看出,CTAB法提取的辣椒基因组DNA A260/A280的比值为1.87~1.88,大于1.6,小于1.9,说明所提取DNA样品中没有蛋白质污染;SDS法提取的A260/A280的比值大于1.9,说明提取DNA样品中含有RNA,DNA纯度不高。CTAB法和SDS法的A260/A230值均大于2.0,说明2种方法都能较好地去除酚类物质及小分子盐。另外,从DNA的浓度上看出,SDS法的产率最高,是CTAB法的2倍多。通过两个品种的比较,2种方法在2个品种上的差异较小,表明2种方法对辣椒品种选择没有特殊要求,能用于不同辣椒品种的DNA提取。
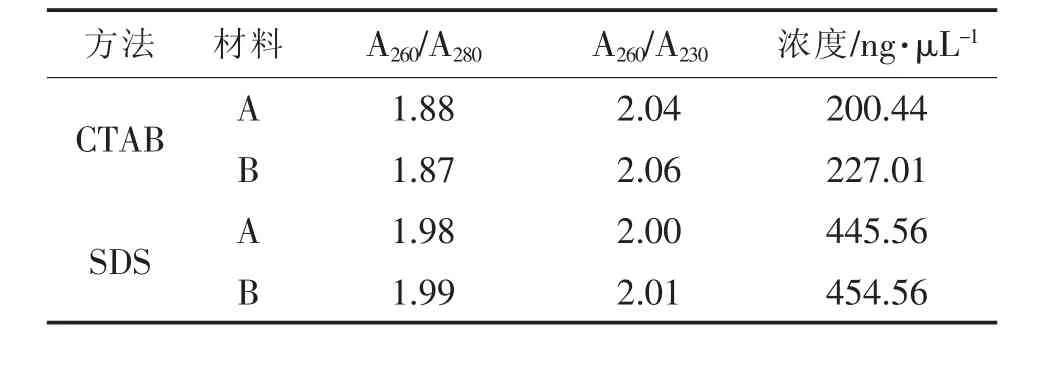
表1 辣椒基因组DNA提取方法检测结果
2.2 两种方法提取辣椒基因组DNA的电泳检测结果
图1所示,对2种方法提取的辣椒幼苗的基因组DNA进行琼脂糖凝胶电泳检测。结果表明,2种方法提取的DNA均有一条单一的信号强的主带,点样孔无亮点,说明没有多糖等杂质的污染。CTAB法(1~3道和7~9道)提取的DNA条带均匀一致,拖尾弥散现象很少,说明DNA纯度较高,无RNA污染;SDS 法(4~6 道、10~12 道)提取的 DNA 条带出现严重拖尾弥散等现象,说明DNA发生部分降解,但SDS法的条带较CTAB法的条带大,说明SDS法的产率较CTAB法的高。另外,2种方法在不同的品种上表现较为一致,说明这2种方法都适用于不同品种辣椒DNA的提取。
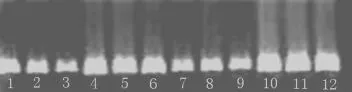
图1 辣椒基因组DNA提取凝胶电泳检测
3 小结与讨论
随着生物技术的不断发展,快速、经济、安全、高效地提取辣椒基因组DNA为其在资源鉴定、遗传多样性分析、亲缘关系评估、分子标记辅助选择等方面奠定基础。辣椒叶片中富含的酚类物质不仅可导致DNA降解,与DNA结合形成黄色至黑褐色的难以溶解的沉淀物,还可使提取液颜色变深,因此很难得到高纯度DNA。本研究通过应用改良的CTAB法提取的辣椒基因组DNA,经分析其A260/A280的比值为1.87~1.88,样品DNA的纯度较高,不含蛋白质、RNA等杂质。而应用SDS法提取的辣椒基因组DNA A260/A280的比值大于1.9,提取的DNA纯度不高,并出现DNA降解现象,但SDS法提取的辣椒基因组DNA的产率比CTAB法的高。与石庆华等[8]通过对刺山柑的研究指出,CTAB法提取DNA的A260/A280的比值大于1.8,而SDS法的为1.65左右,李娟玲等[9]通过改良CTAB法提取鹧鸪茶基因组DNA的A260/A280的比值在1.8左右的研究结果相一致。另外,还有研究认为,CTAB法在香蕉[10]、大花萱草[11]、苹果[12]上提取DNA的纯度高于SDS法。
本研究结果表明,通过改良的CTAB法和SDS法都能提取出辣椒的总DNA。改良CTAB法提取的辣椒基因组DNA质量高于SDS,但SDS法提取的量大于CTAB法,研究者可以根据自己的试验要求合理选择适合的提取方法。
[1]程永安.辣椒无公害生产技术[M].北京:中国农业出版社,2003:3-4.
[2]丁芳林,彭书练.黄芩高质量DNA提取方法研究[J].湖南农业科学,2010(7):23-25.
[3]罗志勇,周钢,陈湘晖,等.高质量植物基因组DNA的分离[J].湖南医科大学学报,2001,26(2):178-180.
[4]张娟,张道远,尹林克.刚毛柽柳基因组DNA提取和RAPD反应条件探索[J].西北植物学报,2003,23(2):253-256.
[5]袁长春,施苏华,叶创兴.从富含酚类的茶类植物叶中提取纯净的总 DNA[J].中山大学学报论丛,2001,21(3):1-4.
[6]沈洁,罗安才.提取蕨类植物DNA方法比较[J].安徽农业科学,2010,38(4):1 738-1 740.
[7]俞文政,杨贵,张映南,等.辣椒基因组DNA提取方法研究[J].辣椒杂志,2007(4):39-43.
[8]石庆华,代培红,许磊,等.刺山柑(Capparis spinosaL.)基因组DNA提取方法的比较 [J].新疆农业科学,2010,47(8):1 512-1 516.
[9]李娟玲,刘国民,贾媛,等.一种高效提取鹧鸪茶基因组DNA 的方法[J].中国农学通报,2010,26(8):69-73.
[10]易干军,于晓英,霍合强,等.香蕉种质资源的AFLP鉴别与分类中 DNA 模板的制备[J].果树学报,2001,18(6):345-348.
[11]于晓英,吴铁明,彭尽晖,等.萱草种质资源扩增片段长度多态性鉴别与分类的研究I.萱草DNA模板的制备[J].湖南农业大学学报:自然科学版,2001,27(1):41-43.
[12]王彩虹,王倩,戴洪义,等.苹果基因组AFLP分析的DNA模板的制备及技术体系的建立[J].山东农业大学学报:自然科学版,2001,32(2):197-200.
