硅限制对三角褐指藻叶绿素a、叶黄素含量和脂肪酸组成的影响*
2011-09-07陈百灵朱葆华马晓磊杨官品潘克厚
陈百灵,潘 瑾,朱葆华,马晓磊,杨官品,潘克厚**
(1.中国海洋大学海水养殖教育部重点实验室,山东青岛266003;2.中国海洋大学海洋生命学院,山东青岛266003)
硅限制对三角褐指藻叶绿素a、叶黄素含量和脂肪酸组成的影响*
陈百灵1,潘 瑾1,朱葆华1,马晓磊2,杨官品2,潘克厚1**
(1.中国海洋大学海水养殖教育部重点实验室,山东青岛266003;2.中国海洋大学海洋生命学院,山东青岛266003)
为研究硅限制对三角褐指藻脂肪酸组成的影响,用不含硅的f/2人工海水培养基对处于生长指数末期的三角褐指藻进行了0、6、12、24、48 h的硅限制并测定了其叶绿素a、叶黄素含量和脂肪酸组成。结果表明,硅限制对三角褐指藻叶绿素a和叶黄素含量无影响,对脂肪酸组成影响显著。硅限制显著增加了C14∶0、C16∶0、C16∶1、C16∶2、C20∶5(EPA)百分含量,但各脂肪酸响应硅限制的时间不同。C14∶0在硅限制24、48 h显著增加,分别是对照组的1.33倍、1.41倍。C16∶0在硅限制6、48 h显著增加,分别是对照组的1.12倍、1.19倍;C16∶1在硅限制48 h显著增加,是对照组的1.16倍;C16∶2在硅限制24 h显著高于对照组,是对照组的1.27倍;EPA在硅限制24 h百分含量达到最大值21.86%,分别是0 h和对照组的1.11倍、1.18倍。研究结果表明,一定时间的硅限制能显著提高三角褐指藻EPA百分含量,以期为工业化生产EPA提供理论参考。
三角褐指藻;硅限制;脂肪酸;叶绿素a;叶黄素;EPA
海洋微藻是海洋生态系统中最主要的初级生产者,在海洋生态系统的物质循环和能量流动中起着重要作用。海洋微藻富含多不饱和脂肪酸,而且具有生长周期短、繁殖速度快、可塑性强、对营养素要求简单和生物安全性高等特点,有利于工业化生产多不饱和脂肪酸。
多不饱和脂肪酸(polyunsaturated fatty acid,PUFA)是指含有2个或2个以上双键的不饱和脂肪酸,它是机体生物膜的重要组成成分,对维系和调节细胞的正常生物学功能起着重要作用[1-2]。多不饱和脂肪酸在营养和医学上具有重要作用,特别是二十碳五烯酸(EPA)和二十二碳六烯酸(DHA)已成为研究开发的热点。研究表明,EPA和DHA对防治心脏疾病、动脉硬化、风湿关节炎、气喘和糖尿病等人类疾病有明显效果[3-4]。在水产上,EPA和DHA是许多鱼类幼体、对虾幼体、双壳类幼虫的必需脂肪酸,关系到幼虫和幼体的生长发育和存活[5]。
三角褐指藻(Phaeodactylum tricornutum)是1种真核海洋单细胞硅藻,是海洋生态系统中非常重要的初级生产者[6]。三角褐指藻多不饱和脂肪酸含量很高,是进行多不饱和脂肪酸研究的理想材料,也是理想的基因资源和研究生物柴油的模式藻种[7-9]。目前,国内外关于三角褐指藻脂肪酸含量及组成的研究多集中在有机碳源、氮源、温度、光照、盐度等方面[10-14],而关于硅方面的研究较少。硅是硅藻生长繁殖的重要元素,硅吸收及硅化作用与细胞周期存在偶合关系[15]。本文以富含EPA的三角褐指藻为研究对象,研究硅限制对其叶绿素a、叶黄素含量和脂肪酸组成的影响,从而为更好的开发利用三角褐指藻工业化生产EPA提供基础资料。
1 材料与方法
1.1 实验材料
三角褐指藻由中国海洋大学微藻种质库提供,通过平板分离纯化2次获得纯种用于实验。
1.2 实验方法
1.2.1 三角褐指藻预培养 预培养在4 000 m L三角烧瓶中进行。培养液采用人工海水(McClengon,1917)配置的f/2培养液。培养条件:光照强度27.5~37.5μm-2·s-1,光照周期12L∶12D,温度(22±1)℃。
1.2.2 硅限制实验设计 取处于指数生长末期的三角褐指藻预培养藻液,1 700 r/min离心10 min收集,弃上清液,沉淀用无硅f/2培养液洗涤并转移至盛有300 mL培养液的塑料瓶中培养,调整初始接种密度在6.5× 106/mL左右。硅限制组培养液为无硅f/2人工海水培养液,对照组为f/2人工海水培养液。硅限制实验设定5个时间梯度0,6,12,24,48 h,每个梯度3个平行。硅限制实验从上午8:00开始,每日定时手动摇瓶3次。
1.2.3 单个藻细胞内叶绿素a、叶黄素含量的测定
采用Beckman Coulterepics XL流式细胞仪测定单个藻细胞内叶绿素a和叶黄素的相对含量。选取氩离子激光器,激发波长488 nm,信号前向散射(FS)、侧向散射(SS)及2个波长的荧光:FL3(620 nm)和FL4(675 nm)。其中FL3(620 nm)参数反映了单个细胞中叶黄素的含量,而FL4(675 nm)参数反映了单个细胞中叶绿素a的含量[16]。
1.2.4 硅钼黄法测定藻细胞内硅含量 参考陈丹丹等[15]的方法:取5 mL藻液经0.22μm的滤膜过滤,用无硅人工海水将滤膜上的藻细胞洗脱下来,离心弃上清,向藻细胞中加入1 mL的超纯水,沸水浴10 min,离心取上清用于测定胞内的硅含量。取提取上清液200μL,加入12μL的钼酸铵—硫酸混合液,混匀,放置5 min,再加入8μL的草酸溶液,混匀,显色15 min,380 nm处酶标仪测定吸光值。
1.2.5 脂肪酸组成分析 参考Lepage[17]的方法并进行改进:准确称取30 mg真空冷冻干燥的藻粉于10 mL螺口玻璃试管中,加入2 mL 2 mol/LKOH-CH3OH溶液,于75℃水浴中皂化30 min,冷却至室温加入2 m L 3 mol/LHCl-CH3OH溶液,75℃水浴中甲酯化15 min,冷却至室温,加入1 mL正己烷和少量的蒸馏水萃取脂肪酸,取上层正己烷层4℃425 r/min离心10 min分析脂肪酸组成。
脂肪酸组成分析:采用美国Agilent 6890 series GC system气相色谱仪、氢火焰离子化检测器(FID)和HP-5毛细管柱(30 m×320μm×0.25μm,5%Phenyl Siloxane)。根据待测峰与标样峰面积比和标样量计算各脂肪酸成分占总长链脂肪酸含量的百分比。程序升温:170℃恒温1 min,然后以3℃/min的升温速率升到210℃,保持17 min。进样口温度为210℃。载气为高纯N2,流速45 m L/min,H2流速为40 m L/min,空气流速为450 m L/min,分流比为1∶20,进样量1μL。1.2.6数据分析 采用SPSS软件对叶绿素a、叶黄素、细胞内硅和脂肪酸含量进行单因子方差分析。以P<0.05作为差异显著性水平。
2 实验结果
2.1 硅限制对三角褐指藻叶绿素a、叶黄素含量的影响
由图1和图2可以看出,硅限制对三角褐指藻叶绿素a和叶黄素含量变化无影响。但随着实验的进行,藻细胞叶绿素a和叶黄素含量变化具有相同的变化趋势。叶黄素和叶绿素a含量均是6 h无变化,12 h升高,24 h下降,48 h上升并达到最大值。
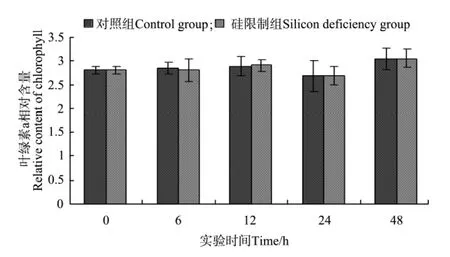
图1 不同时间硅限制条件下三角褐指藻细胞叶绿素a相对含量Fig.1 Relative contents of cellular chlorophyll a ofP.tricornutumin different times of silicon deficiency
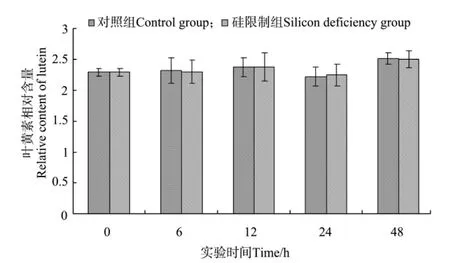
图2 不同时间硅限制条件下三角褐指藻细胞叶黄素相对含量Fig.2 Relative contents of cellular lutein of P.tricornutum in different times of silicon deficiency
2.2 硅限制对三角褐指藻细胞内硅含量的影响
如图3所示,初始接种时细胞内硅含量最高,硅限制6 h细胞内硅含量显著降低,12 h较6 h相比有所降低,硅限制12和24 h细胞内硅含量无变化,48 h细胞内硅含量再次降低,仅为0 h时的26.27%。
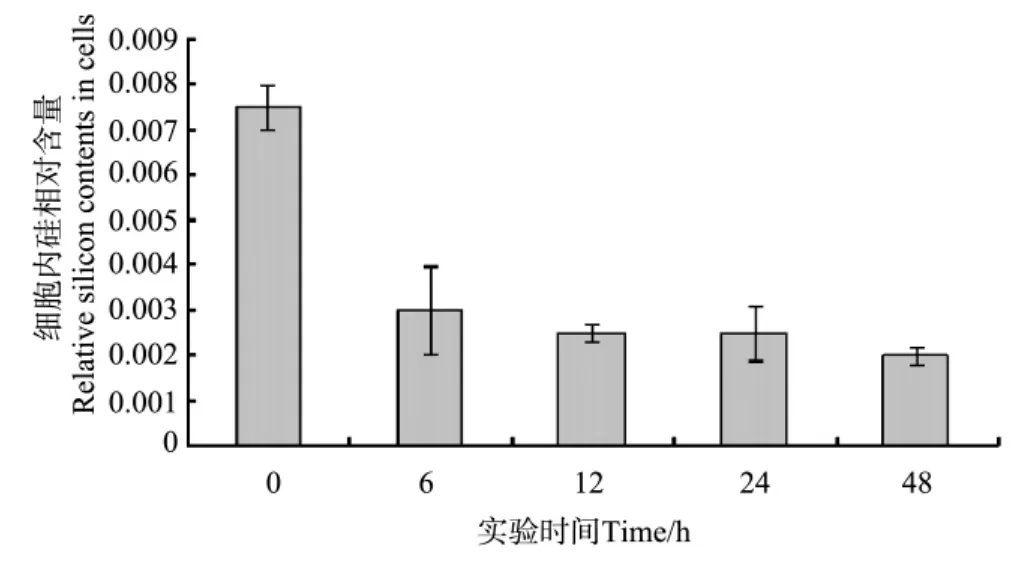
图3 不同时间硅限制条件下三角褐指藻细胞内相对硅含量变化(波长380 nm OD值)Fig.3 Variation of relative contents of intra-cellular silicon inP.tricornutumunder silicon deficiency(wavelength 380nm OD value)
2.3 硅限制对三角褐指藻脂肪酸组成的影响
由表1所示,这一株三角褐指藻的主要脂肪酸是C14∶0、C16∶0、C16∶1、C16∶3、C20∶5,其中C16∶1的含量最高,占总脂肪酸百分含量的22.90%~29.49%,其次是EPA,占总脂肪酸百分含量的18.57%~21.86%,这与其他研究所报道的三角褐指藻主要脂肪酸组成特征一致。硅限制对各脂肪酸百分含量变化影响显著,但各脂肪酸响应硅限制的时间不同。硅限制显著增加了C14∶0、C16∶0、C16∶1、C16∶2、C20∶5的百分含量。硅限制6 h,C16∶0增加了1.12倍;硅限制12 h,C20∶5增加了9.85%;硅限制24 h,C14∶0、C16∶2、C20∶5均显著增加,分别是对照组的1.33倍、1.27倍、1.77倍。硅限制48 h,C14∶0、C16∶0、C16∶1分别增加了41.48%、19.45%、15.34%。硅限制12、24、48 h,C16∶3分别降低了14.12%、11.44%、64.70%。硅限制6 h,C18∶1、C18∶2分别降低了14.00%、35.81%,硅限制12、48 h则无影响。硅限制24 h,C18∶1则显著增加了61.04%。
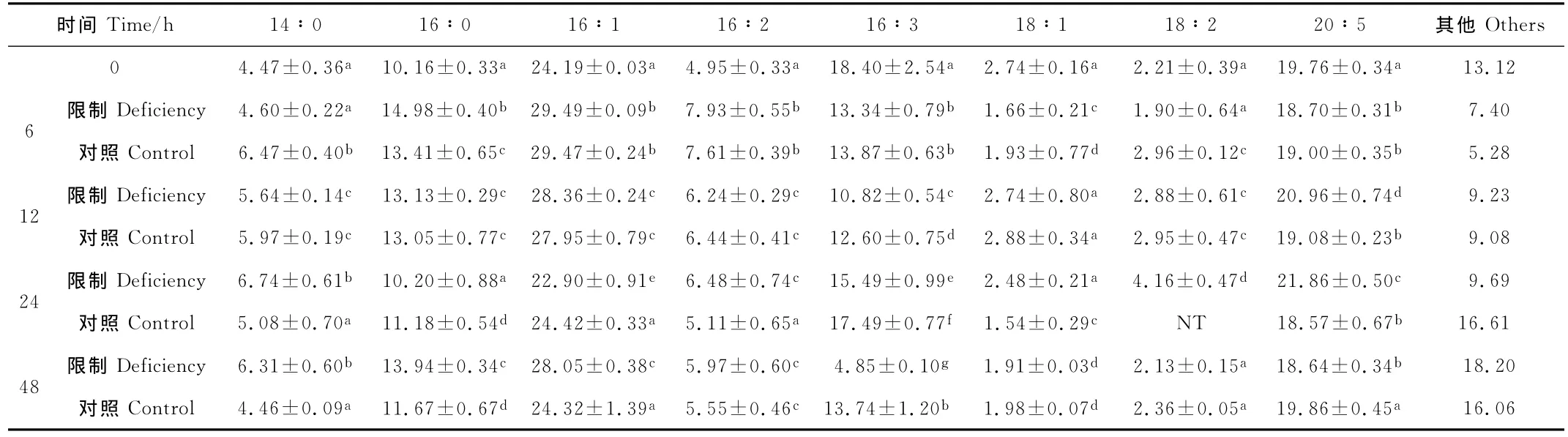
表1 硅限制对三角褐指藻脂肪酸组成的影响(means±S.D.)Table 1 Fatty acid composition ofP.tricornutumunder silicon deficiency(%TFA(means±S.D.))
3 讨论
叶绿素含量是藻类生物量的1个指示指标,也是反映光合作用强度的重要指标。微藻受到胁迫时,各种生理过程都会受到影响,直接或间接地影响叶绿素含量[18-19]。本实验中,硅限制对三角褐指藻藻细胞叶绿素a和叶黄素含量无影响,而梁英等[19]的研究结果表明,三角褐指藻叶绿素含量随着培养液中起始硅浓度的增加而增加,缺硅和低硅均使微藻受到伤害,叶绿素含量显著降低。相同的藻种实验结果存在差异,其原因可能与藻种所处的生长时期、培养条件、硅限制时间不同等有关。本实验中,随着硅限制时间的延长,藻细胞叶绿素a和叶黄素含量出现波动性变化,这可能与色素含量存在昼夜周期波动有关[14]。另外,本实验采用流式细胞仪法测定藻细胞色素含量,与传统的分光光度计法、高压液相色谱法、叶绿素荧光仪法相比具有所需样品少,更简单快速等优点。
环境因素如碳、氮、磷、光照强度、温度、盐度等均能影响硅藻的脂肪酸组成[12]。有关硅限制对硅藻脂肪酸组成方面的研究较少,Roessler[21]报道了硅限制的小环藻(Cyclotellacryptic),其中性脂(主要指三酰甘油)含量显著增加,饱和及单不饱和脂肪酸的比例也明显升高。硅限制使硅藻脂类积累,一方面由于硅限制使新同化的碳合成脂类的比例增加,另一方面由于非脂物质转变为脂类化合物造成的[21]。本实验硅限制条件下,脂肪酸组成变化显著。硅限制12、24 h显著增加了EPA的百分含量,这与廖启斌等[13]研究结果一致。硅限制导致脂肪酸百分组成的变化,一方面与饱和脂肪酸和单不饱和脂肪酸直接进入三酰甘油合成途径有关[21],另一方面硅限制可能改变了与脂肪酸合成相关的去饱和酶和延伸酶的活性。另外,硅限制影响脂类合成相关酶的活性,这对于脂类的积累是非常有利的。据报道,硅限制4~15 h小环藻乙酰辅酶A羧化酶的活性增加了2~4倍[20]。
三角褐指藻具有生长快、繁殖迅速、容易培养,营养丰富等优点,是水产动物的优质饵料和生物柴油模式藻种。环境调控简单可行,不需要太高成本就能改变脂肪酸的组成和百分含量,满足工业规模化生产优质饵料和EPA需要。本实验结果表明对处于指数生长末期的三角褐指藻进行硅限制,能显著增加EPA百分含量并改变脂肪酸的百分组成。
[1] Kang J X.From fat to fat-1:a tale of omega-3 fatty acids[J].Journal of Membrane Biology,2005,206(2):165-172.
[2] Leaf A,Albert C M,Josephson M,et al.Prevention of fatal arrhythmias in high-risk subjects by fish oil n-3 fatty acid intake[J].American Heart Association Journal,2005,112:2762-2768.
[3] Tapiero H,Ba G N,Couvreur P,et al.Polyunsaturated fattyacids(PUFA)and eicosanoids in human health and pathologies[J].Biomedecine &Pharmacotherapy,2002,56(5):212-222.
[4] Ward O P,Singh A.Omega-3/6 fatty acids:Alternative sources of production[J].Process Biochemistry,2005,40(12):3627-3652.
[5] Yongmanitchai W,Ward O P.Omega-3 fatty acids:Alternative sources of production[J].Process Biochemistry,1989,24(4):117-125.
[6] Field C B,Behrenfeld M J,Randerson J T,et al.Primary production of the biosphere:integrating terrestrial and oceanic components[J].Science,1998,281(5374):237-240.
[7] Bowler C,Allen A E,Badger J H,et al.ThePhaeodactylumgenome reveals the evolutionary history of diatom genomes[J].Nature,2008,456:239-244.
[8] Kroth P.Molecular biology and the biotechnological potential of diatoms[J].Biomedical &Life Sciences,2007,616:23-33.
[9] Saade A,Bowler C.Molecular tools for discovering the secrets of Diatoms[J].Bioscience,2009,59(9):757-765.
[10] Liang Y,Beardall J,Philip H.Effects of nitrogen source and UV radiation on the growth,chlorophyll fluorescence and fatty acid composition ofPhaeodactylumtricornutumandChaetoceros muelleri(Bacillariophyceae)[J].Journal of Photochemistry and Photobiology,2006,82(3):161-172.
[11] 刘晓娟,段舜山,李爱芬.有机碳源对三角褐指藻生长、胞内物质和脂肪酸组分的影响[J].生物工程学报,2008,24(1):147-152.
[12] 杨秀霞,于浩,曾晓起.影响微藻脂肪酸组成因素概述 [J].海洋湖沼通报,2001,1:76-82.
[13] 廖启斌,李文权,陈清花,等.营养盐对三角褐指藻脂肪酸含量与百分组成的影响[J].海洋环境科学,2000,19(2):6-9.
[14] 李文权,李芊,廖启斌,等.温度对四种海洋微藻脂肪酸组成的影响[J].台湾海峡,2003,22(1):9-13.
[15] 陈丹丹,王鹏,高亚辉,等.假微型海链藻硅吸收及硅化作用与细胞周期偶合关系的研究[J].自然科学进展,2009,19(9):931-935.
[16] 梁君荣,唐川宁,陈长平,等.底栖硅藻新月筒柱藻对锌胁迫的生理学效应[J].厦门大学学报,2006,45:225-230.
[17] Lepage G,Roy C.Improved recovery of fatty acid through direct transesterification without prior extraction or purification[J].Journal of Lipid Research,1984,25:1391-1396.
[18] 史庆华,朱祝军,钱琼秋,等.等渗Ca(NO3)2和NaCl胁迫对番茄光合作用的影响[J].植物营养与肥料学报,2004,10(2):188-191.
[19] 梁英,尹翠玲,江新琴,等.硅浓度对纤细角毛藻和三角褐指藻生长及叶绿素荧光特性的影响[J].海洋水产研究,2007,28(5):89-94.
[20] Roessler P G.Changes in the activities of various lipid and carbohydrate biosynthetic enzymes in the diatomCyclotellacrypticain response to silicon deficiency[J].Archives of Biochemistry and Biophysics,1988,267(2):521-528.
[21] Roessler P G.Effects of silicon deficiency on lipid composition and metabolism in the diatomCyclotellacrypitca[J].Journal of Phycology,1988,24(3):394-400.
Absstract:In order to determine the effects of silicon deficiency on the contents of Chlorophyllaand lutein and the fatty acids composition,P.tricornutumwas cultured for 0,6,12,24 and 48 h in f/2 medium with silicon-free artificial seawater.Silicon deficiency did not significantly affect the contents of chlorophyllaand lutein but changed the composition of fatty acids significantly.Silicon deficiency increased the percentage contents of C14∶0,C16∶0,C16∶1,C16∶2 and C20∶5(EPA)in a time-dependent manner.C14∶0 increased by 1.33-folds and 1.44-folds at 24 and 48 hours of silicon deficiency,respectively;C16∶0 increased by 1.12-folds and 1.19-folds at 6 and 12 hours,respectively;C16∶1 increased by 1.16-folds at 48 hours and C16∶2 increased by 1.27-folds at 24 hours.The percentage content of EPA reached the highest value(21.86%)at 24 hours,1.11-folds and 1.18-folds higher than that of the original cells and the control,respectively.The results showed that a certain time of silicon deficiency can increase the percentage content of EPA which provide a theoretical reference for EPA industrial production.
Effects of Silicon Deficiency on the Contents of Chlorophyll a and Lutein and Composition of Fatty Acids of Phaeodactylum tricornutum
CHEN Bai-Ling1,PAN Jin1,ZHU Bao-Hua1,MA Xiao-Lei2,YANG Guan-Pin2,PAN Ke-Hou1
(1.The Key Laboratory of Mariculture,Ministry of Education,Ocean University of China,Qingdao 266003,China;2.College of Marine Life Sciences,Ocean University of China,Qingdao 266003,China)
Phaeodactylumtricornutum;silicon deficiency;fatty acids;Chlorophylla;lutein;eicosapentaenoic acid
book=36,ebook=1
Q948.12
A
: 1672-5174(2011)12-036-04
责任编辑 王 莉
国家自然科学基金项目(40976076);国家重点基础研究发展计划项目(2011CB200901)资助
2011-01-12;
2011-06-10
陈百灵(1985-),女,硕士生。研究方向:微藻生理调控。
**通讯作者:E-mail:khpan@ouc.edu.cn
