生物人工肝支持系统中溶解氧控制问题的研究进展
2011-09-02段梅梅霍小林吴昌哲中国科学院电工研究所北京0090
段梅梅 霍小林 吴昌哲 李 明(中国科学院电工研究所,北京 0090)
2(中国科学院研究生院,北京 100190)
引言
在外科治疗中,肝移植手术可以显著提高患者抢救成功率,但由于供肝严重短缺,加之医疗费用昂贵,大多数患者在等待供肝的过程中死亡。生物人工肝支持系统为肝衰竭患者的康复带来了新的希望,是目前肝病治疗领域的重要研究课题。
非生物型人工肝支持系统主要以清除毒素功能为主,而生物型人工肝支持系统(bio-artificial liver support system,BALSS)不仅具有肝脏的特异性解毒功能,而且具有更高的性能,如参与能量代谢,具有生物合成转化功能,分泌促肝细胞生长的活性物质等,因比非生物型系统治疗更具有优势而愈来愈得到研究者的重视[1]。生物型体外人工肝支持系统这一技术的出现与发展,为肝衰竭的治疗开辟了新途径[2]。其中的生物反应器是肝细胞与病人血液/血浆进行物质交换的场所,是发挥人工肝代谢支持作用的关键部分[3]。
肝细胞的生长需要反应器中有适当的溶解氧、pH和温度等参数,为了给体外培养的肝细胞提供一个优化的物理及化学环境,使肝细胞能够更好地生长,发挥功能活性,需对反应器中这几个重要参数进行控制。因为肝细胞在培养过程中对氧气的需求量大,且生物反应器的体积需要限定在一定范围内,又由于氧气在培养基中溶解度较低,溶解氧的控制最为复杂且尤为重要。文中对如何增加培养基中溶解氧、反应器中溶解氧检测以及溶解氧的浓度控制等问题进行了综述,最后介绍了适合人工肝生物反应器溶解氧控制的自适应控制算法。
1 增加基质中溶解氧的方法
在细胞培养基质中,需要供给细胞充足的氧气才可以维持细胞活性,但是氧气溶解度有一定限度,对于如何增加基质中氧气溶解量,大量的研究正在进行。目前生物人工肝中对肝细胞供氧可以采用全血灌注和血浆灌注。应用全血灌注可以使血液不直接与肝细胞接触,但白细胞仍然有可能透过渗透膜而引起免疫反应。为防止免疫反应,可以采用血浆灌注,血浆直接与肝细胞接触,但是血浆中没有红细胞,对肝细胞充足供氧又会产生影响[4]。
因此氧气的充足供应是限制生物人工肝充分发挥功能的最主要因素之一。而解决这一问题,除增大生物反应器入口氧分压外,还可以减小氧气与肝细胞间传输距离[5],这可以通过优化反应器结构,改进基质特性或者引入氧气载体来实现。
1.1 生物反应器结构的优化
人工肝生物反应器基本形状有平板状、灌注式、包埋/悬浮式、中空纤维状以及基于微流体系统的PDMS微流体芯片状。其中灌注式和中空纤维状结构反应器已较广泛地进入临床试验阶段,并且改进其基本结构以改善供氧及物质传输性能[6]。以下两种结构的反应器分别是基于灌注式和中空纤维结构改进而成。
荷兰医学中心研制的AMC-BAL(Academic Medical Center BAL)具有肝细胞原位氧合功能,并且肝细胞与血浆直接接触以增强二者之间的双向物质传输。这一反应器为圆筒状,由聚碳酸酯制成,其中有两片无纺布聚酯基片螺旋环绕中心内核,环绕而形成的空间中灌注有细胞培养基质,其中占肝细胞总数的50%的细胞附着在基片表面。在基片环绕空间中,增加了与反应器平行分布的疏水供氧毛细软管作为内部氧合器为细胞供氧,会有另外50%的肝细胞附着其上。含95%空气,5%二氧化碳的混合气体通过毛细软管通入反应器。通过增加毛细软管的数量,增加外部氧合器中氧分压,减小聚酯基片厚度以及采用更合理的细胞分布均可有效增加细胞供氧[7-8]。
另外模仿肝脏结构的氧合中空纤维的生物反应器(OXY-HFB)也可以满足肝细胞持续供氧问题。由于三维分布的细胞比单层细胞更有益于细胞分化,所以可以使细胞分布在氧合纤维的表面或者内腔。但是又因为细胞种植在内腔时,凝胶床中物质传输只是通过扩散达成,扩散引起的浓度梯度会造成物质传输的障碍。所以将细胞种植在氧合纤维表面,供氧以及温度控制设备放置在纤维内腔,同时基质充满纤维外空间。这一结构可以养殖2.5×107cells/mL的高密度的细胞,具有高的物质传输系数,氧合纤维不会造成氧气传输障碍[9],并且毛细管占用空间小。它的缺点在于氧合纤维是多孔的,则膜表面的沉积物易使膜的性状由疏水变为亲水。因此经过2~3周的培养,氧合纤维开始漏气。为了防止纤维泄露,可以将微孔纤维转变为密致材料[10],但是这又有可能影响氧气的传输。
上述两种结构虽然较为有效解决了肝细胞供氧问题,但是与包埋/悬浮式生物反应器相比[11],后者更有利于细胞功能的发挥[12]。解决细胞悬浮等非氧合软管供氧的生物反应器供氧问题,可以采取改进基质特性和引入氧气载体两种方法。
1.2 反应器中基质特性的改进
为促进氧气传输,除了对反应器结构进行改进,还可以优化传输介质。McClelland等在I型胶原蛋白胶(collagen type I gel)中加入多孔微球体,成为增强版的细胞外基质—多孔胶原质[13]。研究者通过分析平板式、中空纤维式和包埋式等3种人工肝生物反应器结构中,细胞外基质(ECM)分别为胶原质和多孔胶原质时的氧气传输模型,结果表明,通过包含入这一增强技术,氧气传输得到明显改善。
胶原质ECM氧气传输以扩散为主,通过这一增强技术改善形成的多孔胶原质ECM中氧气的扩散与对流并存。虽然弯曲的通道增长了多孔ECM中氧气传输通道,但是降低了氧气传输阻力,因此氧气可以更有效率的进入基质[13-14]。
1.3 反应器中氧气载体的引入
若不改变基质性状,还可以通过在基质中引入“血液替代品”—氧气载体来优化传输介质。虽然氧气载体最初被人们称为“血液替代品”,但是由于它只是具有增加供氧的功能,因此叫做氧气载体更为恰当[15]。Moolman等提出用全氟辛基溴(PFOB)的乳化剂作为氧气载体为肝细胞生长供给足够的氧气[4]。PFOB是全氟化碳(PFC)聚合物中的一种,由于PFOB中氧气和二氧化碳的较高的溶解度而被用于充当氧气传输的载体。
基于PFC的氧气载体由包含一个或多个PFC分子的乳状滴构成,相比水或者血浆表现出了对气体较高的溶解性。PFC中,氧气与二氧化碳的溶解度分别是水中溶解度的20倍和2倍。但是PFC憎水而且疏油,所以要乳化后用于水油环境。PFC作为“血液替代品”,在20世纪60年代就已经得到应用[4]。
人工肝生物反应器中的肝细胞虽然不会再分化,但是其在冷藏状态、正常生长阶段和衰老死亡阶段的耗氧率不同。若要准确控制溶解氧浓度,需要对细胞实时耗氧率进行监测,这就要依靠氧气传感器对溶解氧浓度的精确测量。
2 溶解氧的检测-氧传感器的选择
为保证反应器中培养环境适合细胞生长,需要溶解氧传感器与控制系统相连,通过改变温度、细胞培养基质流速、曝气量以及压力来实时控制溶解氧浓度,并且通过测量细胞的实时耗氧率和总耗氧率,可以满足检测细胞生存活性的要求。为满足上述需求,即使测量环境变化,传感器依然要满足的条件有:传感器电极表面不能形成生物结垢,在不对细胞造成损伤和不干扰细胞生存环境的基础上,快速检测溶解氧浓度,并且校正后不易发生漂移。此外,在人工肝生物反应器的应用中,传感器尺寸也尤为重要[16]。在人工肝反应器中最常用的溶解氧传感器有电化学溶解氧传感器以及光学溶解氧传感器。
2.1 电化学溶解氧传感器
Clark溶解氧电极是电化学溶解氧电极中的典型代表,它测量溶氧浓度是基于电池反应。电极将液体中的溶解氧在电解液中还原,产生与氧浓度成正比的扩散电流,通过测量扩散电流值来测定溶解氧浓度,该法可实现现场连续测量。
当电解液为KCl溶液时,电极两端发生的化学反应如式(1)和式(2)所示。
在阴极发生的还原反应为

在阳极发生的氧化反应为

2.2 光学氧传感器
光纤氧传感器是根据荧光淬灭原理研制的。当LED光源照亮钌化合物时,荧光物质分子中的原子吸收能量跃迁入激发态,激发态原子要回到稳定的基态,将吸收的能量释放出来从而发出荧光。氧分子与荧光物质碰撞对荧光产生淬灭作用从而引起荧光强度降低,寿命减短。这种带有低能量的光被传感器接收后与参考光源进行比较,通过检测光相位的延迟或者强度的降低[17],并据Stern-Volmer方程,可得氧分压。由于氧分压与溶解氧浓度成正比,可换算为溶解氧浓度。对两种传感器进行了比较如表1所示。

表1 电化学氧传感器与光学氧传感器的比较Tab.1 The comparation between electrochemical sensor and optical sensor
经典的电化学传感器虽然结构简单、灵敏度高,但需要经常更换电解液和电极膜,并且易受流速影响而不适合人工肝反应器中溶解氧的测量。光纤氧传感器不含电解液和电极膜,因此不存在电解液泄露问题,并且测量过程不受流速影响,可以非接触测量,满足人工肝反应器测量要求。目前市场上已产品化的光纤传感器有Ocean Optics,Hamilton和PreSens型传感器,因其体积小,可以非接触测量,并且较高的灵敏度可以应用于人工肝生物反应器中的溶解氧测量。
测量液体中溶氧还有其他方法,但均因不同的缺陷而不能用于人工肝反应器中溶解氧检测,比如Winklers滴定法是侵入式,并且需要取样离线测量不易形成实时监测,色析法不仅耗价高、检测时间长,而且离线测量无法实时控制。
3 溶解氧的控制方法
自动控制系统已广泛应用于生物反应过程以维持溶解氧、pH和温度在最优值。为建立系统功能全面的人工肝支持系统,除了为细胞长期培养保障可调节的环境,还需要建立高度灵敏的控制系统[19]。其中溶解氧是影响生物过程特性的关键参数,因此通常被控制在一个常数或者遵循特定曲线,使过程需求达到最优。
3.1 用于生物反应器溶解氧控制的普遍方法
经典控制中,PID调节器是一种滞后-超前校正装置,同时具有PI和PD两种调节器的作用,前者可以提高系统的稳态精度,后者用于改善系统动态性能,两者相辅相成,对线性时不变系统具有优良的控制性能。
但是人工肝生物反应器系统是一个大滞后、非线性、时变的复杂控制对象,难以建立精确地数学模型,仅仅采用传统PID控制很难取得良好的控制品质[20]。
模糊控制由于依赖于人和专家的经验进行控制,无需建立被控对象的数学模型,因此对时滞、非线性和时变的系统有良好的控制能力。但又因为模糊控制不具有积分环节,在变量分级不够多的情况下,在平衡点附近常出现震荡现象和稳态残差。
因此诸多研究将模糊控制与PID调节器结合起来,形成模糊PID控制以及模糊自适应PID控制。前者为当溶解氧设定值与测量值相差较大时,采用模糊控制加快响应速度,偏差较小时采用PID控制,提高控制精度[21]。控制系统框图如图1所示。后者以设定值与输出值间的偏差E和偏差变化EC作为输入,根据系统偏差的大小、方向及变化趋势等特征,找出PID中3个参数与E和EC之间的模糊关系,在运行中通过不断检测E与EC,根据模糊控制规则表对3个参数进行在线修改,以满足不同E与EC对控制参数的不同要求,使被控对象具有良好的动、静态特性,从而获得更加满意的控制效果[22]。模糊自适应PID控制器原理框图如图2所示。这一控制方法曾被用于人工肝生物反应器温度控制中,对溶解氧控制有一定指导作用[23]。
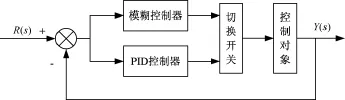
图1 模糊PID控制框图Fig.1 The block diagram of FUZZY-PID control

图2 模糊自适应PID控制框图Fig.2 The block diagram of FUZZY-ADAPTIVEPID control
仅仅采用模糊PID控制仍然不能解决大时滞的影响,为解决这一问题,提出了模糊Smith-PID控制[24]。Smith预估控制解决大时滞的原因在于预先估计出过程的动态特性,然后用预估器进行补偿,使滞后的被控量超前反映到模糊控制器中,使模糊控制器提前动作,从而减少超前量,加速调节过程。PID控制器仍然用于消除稳态残差。控制系统框图如图3所示。

图3 Smith-PID控制框图Fig.3 The block diagram of Smith-PID control
另外有研究提出无量纲参数控制法[25]。细胞培养基反应器的控制系统的动态过程不仅与控制常数和反应器设计参数有关,而且还与细胞生长状态有关。随着细胞生长的不同阶段,细胞生长速率不同,调节控制常数是必要的。因此文中提出了两个无量纲常数Φ和Ω(二者通过雷诺数Re相关联),它们将PID反馈算法中的控制常数与系统运行条件(气体流速、搅拌率、培养基的粘度和密度)、反应器参数(反应器直径)和细胞生长的过程特点(生长速率)联系起来。控制结果显示,两个无量纲参数可以在不扰乱反应过程的基础上构建适应性的PID控制策略。
3.2 适用于人工肝生物反应器中溶解氧的控制方法
上述无量纲参数控制法与模糊PID控制思想相似,均是实时调整PID控制参数以适应生物反应器时滞、时变特性。虽然生物人工肝反应器中肝细胞不再分化,不会存在不同生长速率的问题,但是我们可以将这一算法简化后用于人工肝支持系统中。
针对人工肝分体双循环式生物反应器的溶解氧控制,刘剑锋等提出了应用溶解氧和pH关联补偿的各气体协同控制的先进过程控制—APC控制方法[26-27]。这一方法引入关联控制从而避免了气体造成的相互影响。并且针对系统高滞后、大惯性的特点引入经验值调控与在线反馈相结合的预测控制,结合PID调节使得控制性能得到了显著提升,提高了控制精度。另外他还针对圆柱状生物反应器的结构特点,提出了一种基于仿人决策控制(HSIC)技术的参数自整定模糊控制系统[28-29]。实验结果表明,这种自适应模糊控制器具有动态性能好、稳定度高、鲁棒性较强以及对参数时变的适应能力强等特点。该控制器的自整定模糊规则表物理意义明确,实时计算工作量小,大大提高了溶解氧浓度控制水平。
不过这两种控制方法皆是针对某一氧气传输模型已知,且具有特定结构的生物反应器,对任意结构生物反应器的溶解氧控制不具有自适应性。所以需要引入无需大量先验知识的自适应预测算法[30-31]。根据Constantino Diaz等提出的基于搅拌率的溶解氧控制算法,可以构建基于进气量控制的溶解氧控制。建立模型时首先在有限的时间内预测溶解氧浓度变化特性,这一动态过程可以用增量的一阶模型表示。模型中还要包括溶解氧浓度对进气量的预估环节,最后通过广义的预测算法由溶解氧的预测值和设定值计算出进气量。这一算法控制框图如图4所示。
4 结语
本研究从生物反应器结构的优化、培养基质的改进和氧载体的引入等三方面介绍了增加生物反应器中培养基质中溶氧的方法。AMC-BAL和OXYHFB这两种中空纤维供氧结构的生物反应器提供了一种三维细胞固定培养方式,其中的氧合毛细管供氧的方式有利于为体外生长的肝细胞提供适宜的微环境。但是细胞固定培养环境与细胞悬浮生长环境相比,仍然对肝细胞功能的发挥有抑制作用。所以当采用包埋/悬浮式生物反应器时,为了彻底改善细胞悬浮生长时生物反应器中肝细胞供氧问题,又提出了改进培养基质和引入氧气载体两种方法。其中在不改变人工肝生物反应器中的细胞培养基质特性的基础上,为提高溶解氧浓度可以引入氧气载体。而且鉴于氧气载体中氧气、二氧化碳等非极性分子的较高的溶解度以及载体的无毒性,氧气载体应用于人工肝生物反应器中肝细胞的供氧将得到良好的效果,但是氧气载体引入后,载体的体积分数大小、氧合时基质流速快慢,以及氧合氧分压的高低等参数对肝细胞供氧的具体影响仍然有待于研究。
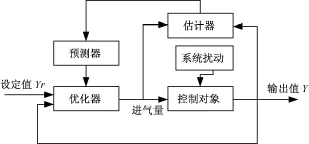
图4 自适应预测控制框图Fig.4 The block diagram of adaptive predictive control
为保证生物反应器中溶解氧浓度的精确控制,首先要解决溶解氧浓度实时测量的问题,文中对满足实时测量要求的电化学和光学溶解氧传感器进行了比较,其中光学溶解氧传感器由于小型化、精确度高、测量过程不受流速影响以及可以非接触测量等特点,适合于生物人工肝中溶解氧测量。之后文章中介绍了几种可用于人工肝生物反应器溶解氧控制的方法,它们针对特定反应器结构达到了较高的控制精度。当细胞供氧不足时,往往需要寻求几个变量,比如搅拌率、基质流速和进气量等共同控制溶解氧浓度,其中搅拌率或基质流速的改变产生的剪切力易对细胞造成伤害。但当引入氧气载体解决了细胞充足供氧问题,在此基础上,可以在基质流速一定的条件下建立仅以进气量为控制变量的控制方程。不过氧气载体量的多少对进气量调控的影响需要深入探讨。文中最后提出了基于进气量的广义自适应预测控制算法,这种算法免去了模糊控制对大量专家经验的需求,适用于时变、大滞后、非线性系统的控制,会使溶解氧的控制特性更加优良。相信随着这一领域研究的不断深入,人工肝生物反应器的性能必然会得到进一步改进与优化,取得突破性的进展。
[1]Chamuleau RAFM.Future of bio-artificial liver support[J].World J Gastrointest Surg,2009,1(1):21-25.
[2]刘剑峰,李明,杨巍,等.一种新型生物人工肝支持系统[J].透析与人工器官,2007,18(1):9-13.
[3]李睿瑜,李明,刘剑峰,等.生物人工肝体外支持系统供氧问题的研究[J].现代科学仪器,2007,(6)49-52.
[4]Moolman FS.Oxygen carrier for a novel bio-artificial liver support[D].South Africa:University of Pretoria,2003.
[5]Nieuwoudt M.Bio-artificial liver support system:an evaluation of models used in demonstrating or improving metabolic and clinical efficacy[D].South Africa:University of Pretoria,2010.
[6]Wang Y,Susando T,Lei Xia,et al.Current development of bioreactors for extracorporeal bioartificial liver[ J].Biointerphases,2010,5(3):FA116-FA131.
[7]Mareels G,Poyck PPC,Eloot S,et al.Three-dimensional numerical modeling and computational fluid dynamics simulations to analyze and improve oxygen availability in the AMC bioartificial liver[J].Annals of Biomedical Engineering,2006,34(11):1729-1744.
[8]Poyck PPC,Mareels G,Hoekstra R,et al.Enhanced oxygen availability improves liver-specific functions of the AMC bioartificial liver[J].Artificial Organs,2007,32(2):116-126.
[9]Patzer JF.Oxygen consumption in a hollow fiber bioartificial liver-revisited[J].Artificial Organs,2004,28(1):83-98.
[10]Jasmund I,Langsch A,Simmoteit R,et al.Cultivation of primary porcine hepatocytes in an OXY-HFB for use as a bioartificial liver device[J].Biotechnol Prog,2002,18(4):839-846.
[11]陈耀凯,王宇明,韩本立.人工肝生物反应器的研究现状[J].中华实验外科杂志,2001,18(6):601-602.
[12]孔德胜,胡龙虎.微重力旋转细胞培养的研究及应用进展[J].航空航天医药,2009,20(11):1-3.
[13]McClelland RE,MacDonald JM,Coger RN.Modeling O2 transport within engineered hepatic devices[J].Biotechnology and Bioengineering,2003,82(1):12-27.
[14]Mcclelland RE,Coger RN.Effect of enhanced O2 transport on hepatocytes packed within a bioartificial liver device[J].Tissue Engineering,2004,10(1-2):253-266.
[15]Moolman FS,Rolfes H,Van der Merwe SW,et al.Optimization of perfluorocarbon emulsion properties for enhancing oxygen mass transfer in a bio-artificial liver support system[J].Biochemical Engineering Journal,2004,19(3):237-250.
[16]Lindblom T.Qualitative comparison of optical and electrochemical sensors for measuring dissolved oxygen in bioreactors[D].LINKÖPING:LINKÖPING University,2009.
[17]赵士威,哀薇,刘晓东.基于相敏检测技术的光纤氧传感器[J].传感器技术,2002,21(12):11-12.
[18]Ge Xudong,Hanson M,Shen Hong,et al.Validation of an opticalsensor-based high-throughput bioreactor system for mammalian cell culture[J].Journal of Biotechnology,2006,122(3):293-306.
[19]Nagamori S,Hasumura S,Matsuura T,et al.Developments in bioartificial liver research:concepts,performance,and applications[J].Journal of Gastroenterology,2000,35:493-503.
[20]何世钧,王化祥,杨立功,等.污水处理系统溶解氧的模糊自适应 PID控制[J].化工自动化及仪表,2003,30(1):36-38.
[21]狄轶娟,陈照章,朱湘临,等.基于模糊PID控制的生物发酵温度过程控制系统[J].自动化仪表,2006,27(8):43-47.
[22]王健,张兴申.污水处理系统溶解氧的模糊自适应PID控制[J].自动化与仪器仪表,2010,(1):39-41.
[23]周晓峰,李明,刘剑锋,等.一种新型生物人工肝温度控制系统的研制[J].Modern Science Instruments,2007,(6):38-41.
[24]Lian Xiaofeng,Liu Zaiwen,Su Zhen,et al.Research in DO control based on fuzzy Smith-PID controller for sewage disposal[C]//Proceedings of 2010 International Conference on Logistics Systems and Intelligent Management..Harbin:IEEE,2010:554-557.
[25]LeónAD,Rosa APBL,MayaniH,etal.Twouseful dimensionless parameters that combine physiological,operational and bioreactor design parameters for improved control of dissolved oxygen[J].Biotechnology Letters,2001,23(13):1051-1056.
[26]刘剑峰,李明,杨巍,等.APC技术在生物型人工肝支持系统中的应用[J].计算机测量与控制,2005,13(10):1048-1051.
[27]刘剑峰,李明,杨巍,等.新型生物人工肝支持系统的控制与实现[J].生物医学工程学杂志,2008,25(2):445-449.
[28]刘剑锋.多功能生物人工肝支持系统的模块化设计与实现[D].北京:中国科学院研究生院,2009.
[29]Liu Jianfeng,Song Tao,Jiang Wei,et al.Construction of modular novel bioartificial liver support system[C]//Proceedings of 31stAnnual International Conference of the IEEE EMBS.Minneapolis:IEEE,2009:3095-3098.
[30]Liu Jianfeng,Li Ming,Yang Wei,et al.Construction of devices in bioartificial liver support system[C]//Proceedings of 27thAnnual Conference on Engineering in Medicine and Biology.Shanghai:IEEE,2005:6699-6702.
[31]Diaz C,Dieu P,Feuillerat C,et al.Adaptive predictive control of dissolved oxygen concentration in a laboratory-scale bioreactor[J].Journal of Biotechnology,1995,43(1):21-32.
