红法夫酵母高产虾青素菌株的选育
2011-08-29张蕊周博李贤宇天津渤海职业技术学院天津300402
张蕊 周博 李贤宇 (天津渤海职业技术学院 天津300402)
虾青素的化学名称为3,3'-二羟基-4,4'-二酮基-β,β'-胡萝卜素,分子式为C40H52O4(见图1),相对分子量为596.86,是一种天然非维生素A原的类胡萝卜素,广泛存在于虾蟹、鲑鱼和某些藻类及真菌中,常用作鱼虾等水产养殖动物的饲料添加剂。[1]动物实验表明虾青素有抑制肿瘤发生、增强免疫功能、延缓衰老等多方面的功能,在功能食品、饲料、化妆品和医药等方面有着广阔的应用前景。[2-4]
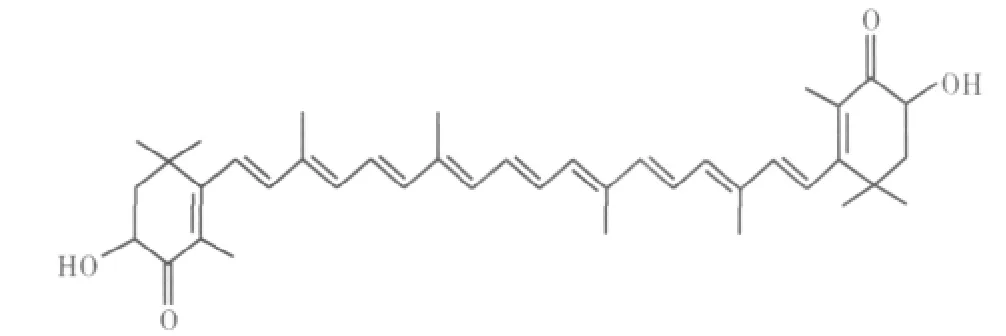
图1 虾青素的结构式
红法夫酵母可以发酵糖类产生虾青素,最初于1970年在美国阿拉斯加的高山和日本北海道一带山区落叶松的渗出液中分离得到。红法夫酵母有生长速度快、容易实现细胞高密度培养以及提取色素后的酵母细胞可以作为饲料添加剂等优点,已越来越受到人们的重视。但红法夫酵母的野生型胞内虾青素含量比较低,一般为0.05%细胞干重,要进行连续化生产最终实现较高的经济效益,必须对红法夫酵母原始菌株进行改造,以达到增产的目的。
1 材料与方法
1.1 实验材料和仪器
1.1.1 菌种 红法夫酵母(Phaffia rhodozyma),中科院微生物所提供,编号As2.1557。
1.1.2 培养基 摇瓶发酵培养基比例:葡萄糖20,酵母粉3,蛋白胨5,pH值自然。
1.1.3 主要仪器 紫外诱变箱(自制),高速离心机(北京医用离心机厂),回转式恒温调速摇瓶柜(上海欣蕊自动化设备有限公司),高效液相色谱仪(美国Laballiance公司)。
1.2 实验方法
1.2.1 紫外诱变 ①菌体前培养[5]:取活化后斜面种子1环接至盛有30 mL种子培养基的250 mL三角瓶中,20℃,160 r/min振荡培养48 h。然后取培养液5 mL接至盛有50 mL摇瓶发酵培养基的500 mL三角瓶中,20℃,160 r/min振荡培养24 h,使细胞处于对数期后期。②诱变处理:取5 mL菌液于Ф75 cm的培养皿中(带磁棒),置于紫外诱变箱的磁力搅拌器上,开启磁力搅拌器,打开皿盖,分别照射 5 s、10 s、15 s、30 s、45 s、60 s、75 s、90 s。移取不同照射时间的菌液1 mL,将其稀释到合适的浓度(3个梯度),然后分别取0.1 mL在固体完全培养基平板上涂布,每个稀释度作3个平行,在20℃恒温培养箱中培养2~3 d。待菌落长出后计数。
1.2.2 筛选[6-7]按照1.2.1的方法对出发菌株进行诱变处理,取诱变后的菌液3 mL接入盛有30 mL液体完全培养基的250 mL三角瓶中,20℃,160 r/min培养过夜,取10 mL培养液离心,收集菌体,洗涤后配制成浓度适中的菌悬液;取0.1 mL涂布于二苯胺抗性筛选平板上,20℃恒温培养箱中培养2~3 d,待菌落长出后,挑选颜色较红、较大的菌落点接于固体完全培养基平板上,挑选较红的、生长较快的菌株接到斜面上,并编号保存。
2 实验结果
2.1 出发菌株的致死曲线(见图2)
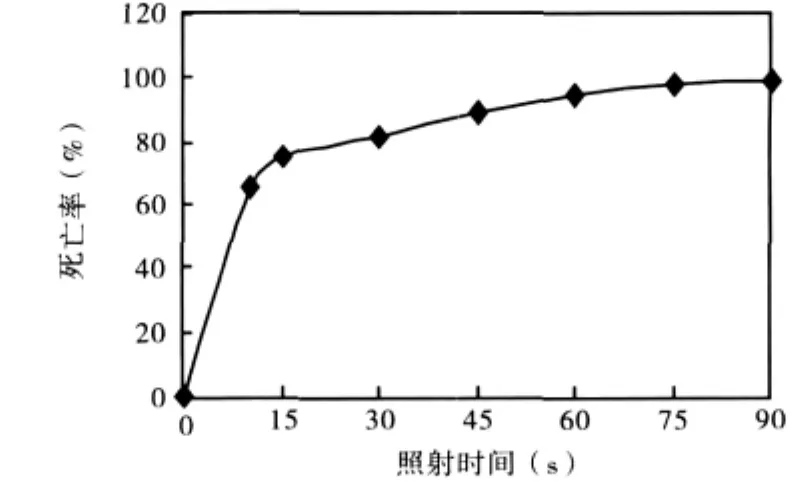
图2 出发菌株红法夫酵母AS2.1557的紫外诱变致死曲线
根据诱变结果绘制出红法夫酵母AS2.1557的紫外诱变致死曲线,如图2所示。一般认为紫外诱变的致死率在75%~85%之间时菌株的突变率较高,本实验选择80%左右的致死率,即诱变时间为30 s。
2.2 出发菌株二苯胺抗性检验
二苯胺是八氢番茄红素脱氢酶的抑制剂,能抑制类胡萝卜素的合成。把红法夫酵母涂布在含二苯胺的平板上,菌落为土白色。但如果细胞发生突变,八氢番茄红素脱氢酶活性不再受二苯胺等抑制剂的抑制,该菌落便是红色的。实验研究了不同二苯胺浓度下出发菌株的生长状况,其结果见表1。
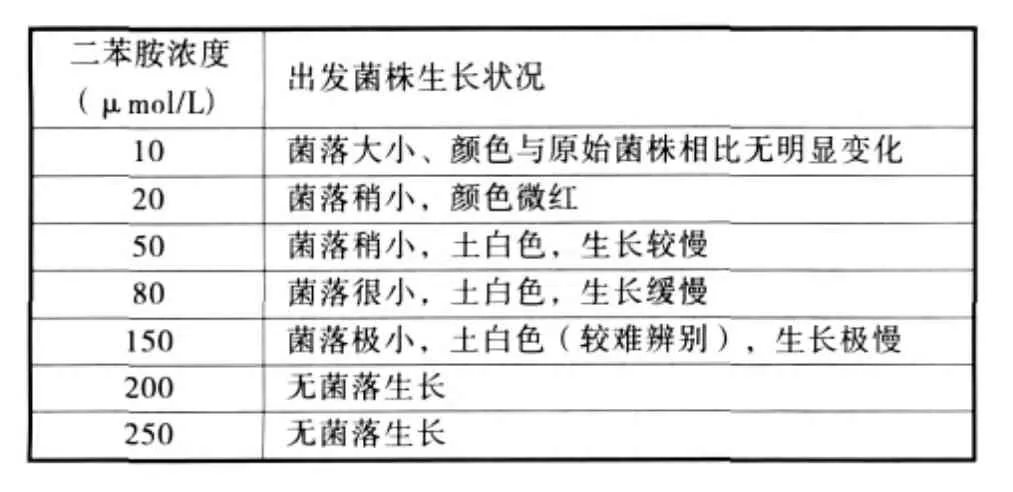
表1 不同二苯胺浓度下出发菌株生长状况
由表1可以看出,二苯胺在较低浓度下对出发菌株的生长状况影响不大;当二苯胺浓度增加至50~80 μmol/L时,菌体的生长受到一定的限制,菌落较小,生长缓慢,颜色为土白色;当二苯胺浓度增加至150 μmol/L时,菌体的生长受到很大的限制,菌落极小,生长极其缓慢,菌落颜色较难辨别;当二苯胺浓度达到200 μmol/L以上时,菌体的生长受到抑制。
二苯胺不仅抑制红法夫酵母胞内类胡萝卜素的合成,而且强烈抑制红法夫酵母的生长。但诱变后需要筛选的是菌落相对较红的菌株,综合考虑,诱变后的二苯胺筛选培养基的浓度选为 80 μmol/L。
2.3 高产菌株的筛选
按照方法1.2.1对出发菌株进行诱变处理,诱变时间为30 s。诱变处理后,取诱变后的菌液3 mL接入盛有30 mL液体完全培养基的250 mL三角瓶中,20℃,160 rpm培养过夜,取10 mL培养液离心,收集菌体,洗涤后配制成浓度适中的菌悬液,取0.1 mL涂布于浓度为80 μmol/L的二苯胺抗性筛选平板上,20℃恒温培养箱中培养2~3 d,待菌落长出后,挑选颜色较红、较大的菌落点接于固体完全培养基平板上,培养2~3 d后,挑选较红生长较快的菌株接到斜面上,并编号保存。最终得到突变株81株,进一步筛选,共得到25株菌株,统一编号为Puv-1~Puv-25。
2.4 诱变菌株发酵性能的测定
2.4.1 高产菌株发酵性能的测定 对上述筛选的25株菌株进行发酵性能测定,实验结果如表2所示,从中可以看出,Puv-7、Puv-11、Puv-16及Puv-24这4株菌的增产幅度较大。
2.4.2 诱变菌株的遗传稳定性检验 将得到的4株高产突变菌株进行遗传稳定性检验,连续液体传20代,期间测定其发酵性能,结果如表3所示。从中可以看出,4株高产突变菌株除Puv-11产量有所下降外,其他3株遗传性能比较稳定。
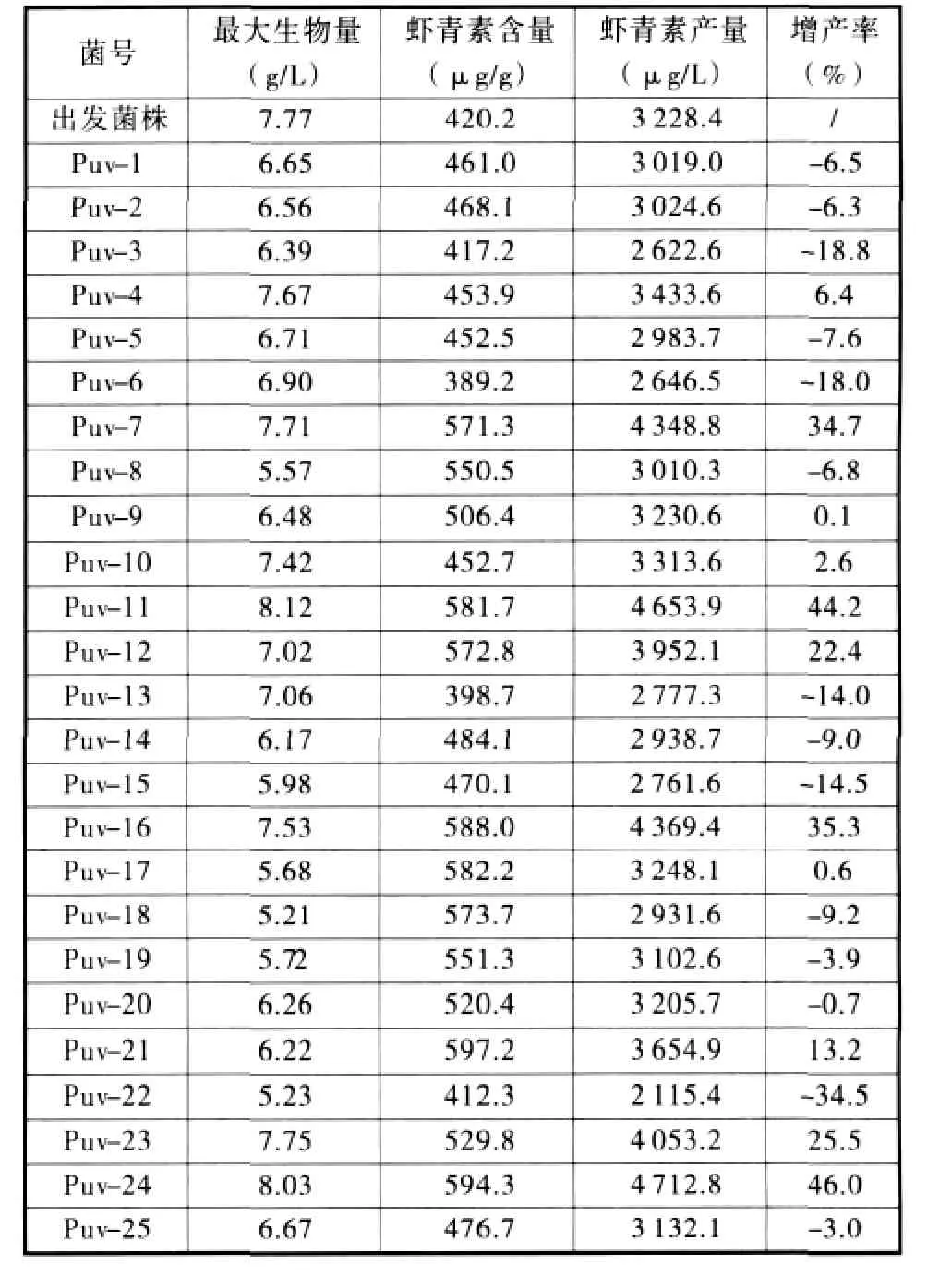
表2 高产菌株发酵性能的测定
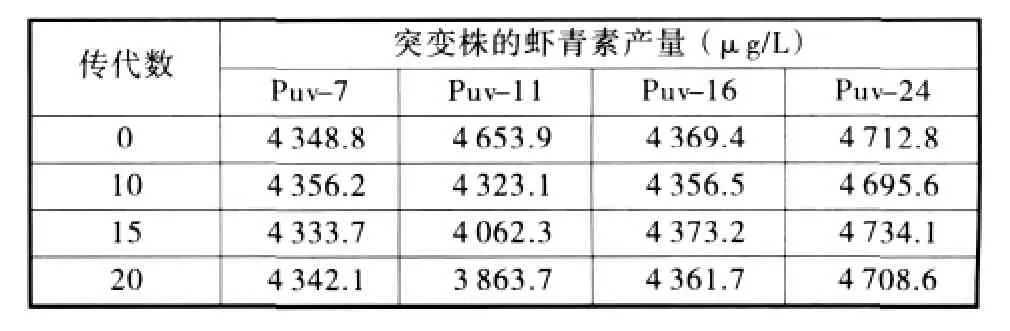
表3 高产菌株的遗传稳定性检验
3 结果讨论
依照出发菌株红法夫酵母AS2.1557的紫外诱变致死曲线,选择致死率在80%左右,即诱变时间为30 s,对出发菌株进行诱变。经过筛选,得到突变株81株,进一步筛选,共得到25株菌株。经过发酵性能测定和菌株稳定性检验,最终得到3株稳定的高产菌Puv-7、Puv-16、Puv-24,其产量相对原始菌株分别提高了34.7%、35.3%和46%。■
[1]朱宏娟,田科雄,李玲,等.酵母在饲料工业中的新应用[J].饲料工业,2005(12):23-25.
[2]王菊芳,吴振强,梁世中.虾青素的生理功能及其应用[J].食品与发酵工业,1999,26(2):66-69.
[3]姬德衡,钱方,祖国仁.微生物工程在保健食品开发中的应用[J].江苏食品与发酵,2002(2):32-34.
[4]Whyte,J.N.C,Sherry,K.L.Pigmentation and composition of flesh of Atlantic salmon fed diets supplemented with the yeast Phaffia rhodozyma [J].North American Journal of Aquaculture,2001,63(1):52-57.
[5]FANG,T.J.and Chiou T.Y.Batch cultivation and astaxanthin production by a mutant of the red yeast phaffia rhodozyma NCHU-FS501[J].Journal of industrial Microbiology,2003(16):175-181.
[6]王普,裘娟萍,郑裕国,等.高产虾青素的红法夫酵母菌种的选育[J].微生物学通报,2002,29(1):15-19.
[7]裘娟萍,沈寅初.红法夫酵母高产虾青素突变株的选育方法[J].工业微生物,2000(4):55-57.
