金雀异黄素在不同钙浓度条件下对大鼠血管平滑肌cGMP水平的调节作用
2011-08-25于桂春孙莉娜周珊珊林静涵张黎明
于桂春, 孙莉娜, 周珊珊, 林静涵, 张黎明
金雀异黄素是一种异黄酮类植物雌激素,其结构和雌激素相似,在大豆等植物中含量丰富,同时作为一种酪氨酸蛋白激酶(protein tyrosine kinase,PTK)抑制剂,广泛应用于各种研究。金雀异黄素不仅可以直接舒张血管,还可以抗动脉粥样硬化、调整血脂、保护血管内皮、抑制血管平滑肌增殖、抗氧化等,对多系统具有保护作用,在心脑血管疾病的防治中有重要地位[1~4]。如研究发现,蛛网膜下腔出血后的严重并发症——脑血管痉挛的主要发生机制之一即氧合血红蛋白通过增强酪氨酸蛋白激酶活性引起血管持续收缩,金雀异黄素等PTK抑制剂可阻断该效应[5]。另有研究表明,金雀异黄素抑制血管平滑肌细胞 L型钙通道钙离子内流,诱导血管舒张[6]。
cGMP是细胞内重要的第二信使,由血管平滑肌细胞可溶性鸟苷酸环化酶(soluble guanylyl cyclase,sGC)催化产生。在血管平滑肌细胞,cGMP一方面直接和间接抑制细胞膜电压依赖钙通道、促进肌浆网钙摄取、增加内钙外流,使细胞内钙离子浓度下降,另一方面降低收缩装置对钙离子的敏感性,导致血管平滑肌舒张[7]。目前尚无文献报道不同细胞外钙浓度下金雀异黄素对血管平滑肌舒缩状态的影响。本研究通过观察金雀异黄素在不同钙条件下对大鼠血管平滑肌cGMP含量的影响,从金雀异黄素和钙的角度为药物研发提供新的思路和理论基础。
1 材料和方法
1.1 实验材料
成年雄性SD大鼠8只,体重300±50g(购自哈尔滨医科大学附属第一医院实验动物中心),按不同干预方式随机分为8组,每组4只。cGMP酶免疫分析试剂盒(货号581021),购自美国 Cayman Chemical公司。金雀异黄素、二甲基亚砜、毒胡萝卜素内酯、EGTA、硝苯地平、BAPTA-AM、NaCl、NaHCO3、葡萄糖、KCl、KH2PO4、MgSO4、CaCl2均购自美国Sigma公司。水合氯醛、乙醚、三氯乙酸均为国产分析纯。金雀异黄素用二甲基亚砜溶解配制,二甲基亚砜终浓度<0.1%。
1.2 实验方法
1.2.1 肠系膜动脉的分离 成年雄性SD大鼠禁食水8h后称重,10%水合氯醛(3.5ml/kg)腹腔注射麻醉。开腹,动脉夹在近心端夹闭肠系膜动脉,远心端结扎,靠近结扎部位剪断血管,将肠系膜与肠管分离。将得到的组织浸于持续通入95%O2+5%CO2的4℃ Krebs-Henseleit(K-H)缓冲液中,显微镜下分离肠系膜动脉血管。上述K-H液成分为(mmol/L):NaCl 130,NaHCO314.9,葡萄糖 5.5,KCl 4.7,KH2PO41.18,MgSO41.17,CaCl21.6,pH 7.2 ~7.4。
1.2.2 标本处理 每只大鼠分离得到的肠系膜动脉在通氧K-H液中平衡20min后,分为实验组(金雀异黄素100μmol/L)和对照组,分别给予下述干预条件37℃ 孵育20min:钙离子浓度为0、0.6、1.2、和 1.8mmol/L,EGTA 2mmol/L,硝 苯 地 平10μmol/L,毒胡萝卜素内酯2μmol/L和BAPTA-AM 20μmol/L(n=4)。
1.2.3 cGMP测定 标本孵育结束后立即放入液氮中冷冻。组织称重后加入预冷的5%三氯乙酸4℃下匀浆化,4℃下1500r/min离心10min,取上清液,沉淀烘干称重。水饱和乙醚洗涤3次,以除去三氯乙酸。采用cGMP酶免疫分析试剂盒,严格按照说明书操作。组织cGMP含量以pmol/mg表示。
2 结果
2.1 不同钙浓度下大鼠肠系膜动脉cGMP含量
实验组 cGMP含量在低钙浓度组(0、0.6、1.2mmol/L)较正常钙浓度组(1.8 mmol/L)降低(P<0.01),随钙浓度降低而逐渐下降;对照组cGMP含量在低钙组与正常钙浓度组无明显差异,然而,随着钙浓度逐渐降低cGMP水平则逐渐升高(见图1)。

图1 不同钙浓度下cGMP水平
2.2 钙螯合剂作用下大鼠肠系膜动脉cGMP含量
EGTA(2mmol/L)作用下,实验组cGMP含量较EGTA对照组(5.13倍)和正常钙条件实验组(3.94倍)有显著升高(P<0.01)(见图2)。BAPTA-AM(20μmol/L)作用下,实验组cGMP含量与对照组无明显差异,而较正常钙条件实验组降低(P<0.01)(见图3)。
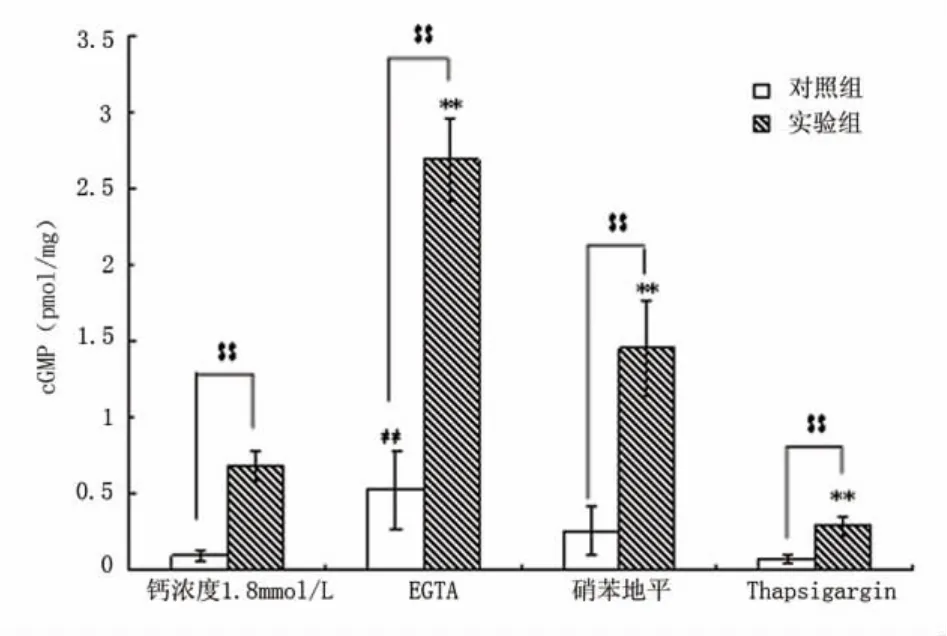
图2 不同钙条件下cGMP水平
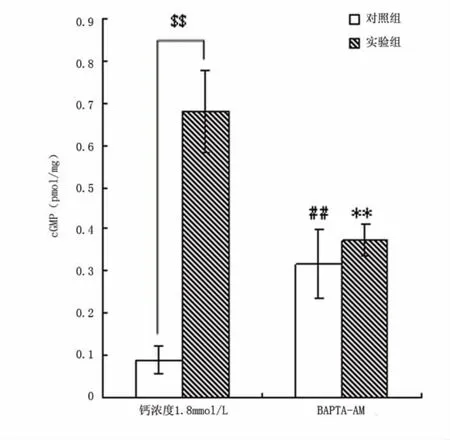
图3 BAPTA-AM作用下cGMP水平
2.3 L型钙通道阻断剂和肌浆网钙泵阻断剂作用下大鼠肠系膜动脉cGMP含量
硝苯地平(10μmol/L)作用下,实验组较硝苯地平对照组和正常钙条件实验组cGMP含量明显升高(P<0.01)。毒胡萝卜素内酯(2μmol/L)作用下,实验组较毒胡萝卜素内酯对照组cGMP升高(P<0.01),与正常钙条件实验组相比cGMP含量降低(P <0.01)(见图2)。
3 讨论
cGMP是血管平滑肌细胞内重要的第二信使,由细胞内可溶性鸟苷酸环化酶催化产生。研究证明,cGMP通过抑制钙内流、增加内钙外流、促进肌浆网钙摄取等来降低细胞内钙浓度,并降低钙敏感性,从而使血管平滑肌细胞舒张[7,8]。因此,血管平滑肌的cGMP水平可以在一定程度上反映其收缩舒张状态。本实验中正常钙条件对照组cGMP含量0.088 ±0.032pmol/mg,这与 Cleber等[9]测定的大鼠肠系膜动脉环基础条件下0.09±0.01pmol/mg一致。正常钙条件下,加入100μmol/L金雀异黄素可使 cGMP 含量抬高至 0.681 ±0.010pmol/mg,与对照组值相比,cGMP含量显著升高(P<0.01)。当细胞外无钙时,金雀异黄素可调节cGMP含量至0.146±0.040pmol/mg水平,低于对照组 0.256 ±0.054pmol/mg(P<0.05)。这说明不同钙浓度下金雀异黄素对血管平滑肌cGMP含量有不同的调节作用。
钙离子作为底物协助促进鸟苷酸环化酶的催化活性,但表现为sGC的负性变构调节剂。文献报道[10],将大鼠sGC转染入不表达一氧化氮合酶、本身sGC活性很低的人胚肾HEK293细胞,发现钙离子抑制其sGC活性;Serfass等[11]也支持这一观点。
本实验中对照组cGMP含量在正常钙浓度组和低钙浓度组相比虽然无显著差异,但可以看出,在正常细胞外钙至零细胞外钙水平之间,随钙浓度降低,cGMP含量逐渐升高。而金雀异黄素孵育20min后改变了此情况,实验组cGMP含量低钙浓度组较正常钙浓度组降低(P<0.01),且随钙浓度降低逐渐下降。虽然实验组低钙浓度下cGMP含量低,但并不能因此推断血管平滑肌舒张,因为低钙浓度本身也会造成血管舒张。因此,我们将进一步利用血管张力实验深入研究。
细胞内钙离子浓度是调节血管平滑肌收缩的关键[7,12]。胞浆内钙离子浓度升高或钙敏感性增加,平滑肌细胞收缩;相反则平滑肌细胞舒张。细胞外钙离子内流、肌浆网钙释放使胞浆钙离子浓度升高,前者在血管平滑肌细胞主要通过细胞膜L型钙通道流入,而Ca2+-ATP酶、Na+-Ca2+交换使钙离子排出细胞外或重新进入肌浆网内,胞浆钙离子浓度降低。
研究表明[6],金雀异黄素对细胞膜L型钙通道有抑制作用,在正常钙条件下实验组cGMP含量较对照组高(P<0.01),这可能与金雀异黄素抑制L型钙通道有关,钙离子内流减少,钙离子对sGC的抑制作用下降,从而使cGMP含量增加。实验组和对照组加入L型钙通道阻断剂硝苯地平(10μmol/L)后,对L型钙通道的抑制作用更强,cGMP含量更高(P<0.01)。而加入EGTA(2mmol/L)完全螯合细胞外钙离子,使钙内流进一步减少,实验组cGMP含量达到最高。上述结果与钙离子抑制sGC活性的观点一致。但是为何在细胞外钙为零时实验组cGMP含量反而不高,还需要进一步的探索。
毒胡萝卜素内酯能够抑制肌浆网Ca2+-ATP酶活性,肌浆网钙排空后不能回收,消除了内钙释放的影响,使细胞内钙离子浓度降低。对照组加入毒胡萝卜素内酯对结果无显著影响,实验组cGMP含量较正常该条件对照组下降。这与钙离子抑制sGC的假说矛盾,但肌浆网排出钙离子后胞浆内钙离子浓度短暂上升,可能对结果也有影响。BAPTA-AM可螯合所有进入细胞内的钙离子,无金雀异黄素存在时(即对照组)较正常钙条件对照组cGMP含量升高,与钙离子抑制sGC活性的观点一致,实验组与对照组无明显差异,BAPTA-AM抹除了所有进入细胞内的钙的影响,我们的结果提示金雀异黄素作用的最终通路在于细胞内钙离子浓度的变化。
综上所述,我们的结果显示在不同钙浓度条件下金雀异黄素对大鼠肠系膜动脉平滑肌的cGMP影响不同,随细胞外钙浓度下降 cGMP含量降低,EGTA、硝苯地平存在下金雀异黄素使cGMP含量明显增加,毒胡萝卜素内酯、BAPTA-AM存在下金雀异黄素使cGMP含量下降。不同钙条件下金雀异黄素对血管平滑肌的舒缩影响及相应机制还有待更深入的研究。
[1] Si HW,Liu DM.Phytochemical genistein in the regulation of vascular function:new insights[J].Curr Med Chem,2007,14(24):2581 -2589.
[2] Atteritano M,Marini H,Minutoli L,et al.Effects of the phytoestrogen genistein on some predictors of cardiovascular risk in osteopenic,postmenopausal women:a two-year randomized,double-blind,placebocontrolled study[J].JClin Endocrinol Metab,2007,92(8):3068 -3075.
[3] Rimbach G,Boesch-Saadatmandi C,Frank J,et al.Dietary isoavones in the prevention of cardiovascular disease-A molecular perspective[J].Food Chem Toxicol,2008,46(4):1308 -1319.
[4] Schreihofer DA,Deutsch C,Lovekamp-Swan T,et al.Effect of high soy diet on the cerebrovasculature and endothelial nitric oxide synthase in the ovariectomized rat[J].Vascul Pharmacol,2010,52(5-6):236-242.
[5] Ishiguro M,Morielli AD,Zvarova K,et al.Oxyhemoglobin-induced suppression of voltage-dependent K+channels in cerebral arteries by enhanced tyrosine kinase activity[J].Circ Res,2006,99(11):1252-1260.
[6] Belevych AE,Warrier S,Harvey RD.Genistein inhibits cardiac L-type Ca2+channel activity by a tyrosine kinase-independent mechanism[J].Mol Pharmacol,2002,62(3):554 -565.
[7] Lucas KA,Pitari GM,Kazerounian S,et al.Guanylyl cyclases and signaling by cyclic GMP[J].Pharmacol Rev,2000,52(3):375 -414.
[8] Friebe A,Koesling D.Regulation of nitric oxide-sensitive guanylyl cyclase[J].Circ Res,2003,93(2):96 -105.
[9] Teixeira CE,Priviero FB,Webb RC.Molecular mechanisms underlying rat mesenteric artery vasorelaxation induced by the nitric oxide-independent soluble guanylyl cyclase stimulators BAY 41-2272[5-cyclopropyl-2-[1-(2-fluorobenzyl)-1H-pyrazolo[3,4-b]pyridin-3-yl]pyrimidin-4-ylamine]and YC-1[3-(5’-hydroxymethyl-2’-furyl)-1-benzyl indazole][J].J Pharmacol Exp Ther,2006,317(1):258 -266.
[10] Parkinson SJ,Jovanovic A,Jovanovic S,et al.Regulation of nitric oxide-responsive recombinant soluble guanylyl cyclase by calcium[J].Biochemistry,1999,38(20):6441 -6448.
[11] Serfass L,Carr HS,Aschenbrenner LM,et al.Calcium ion downregulates soluble guanylyl cyclase activity:evidence for a two-metal ion catalytic mechanism[J].Arch Biochem Biophys,2001,387(1):47-56.
[12] Jackson WF.Ion channels and vascular tone[J].Hypertension,2000,35[1Pt 2]:173 -178.
