应用免疫蛋白质组学方法鉴定日本血吸虫虫卵诊断抗原*
2011-08-21杨再峰施晓华陈璋辉刘晓龙干小仙
王 越,杨再峰,马 安,施晓华,陈璋辉,刘晓龙,干小仙
应用免疫蛋白质组学方法鉴定日本血吸虫虫卵诊断抗原*
王 越1,杨再峰2,马 安1,施晓华1,陈璋辉1,刘晓龙1,干小仙1
目的 虫卵可溶性抗原(soluble egg antigen,SEA)是目前日本血吸虫病免疫诊断中最常用的抗原。本研究联合应用双向凝胶电泳(2-DE)、Western blot和MALDI-TOF质谱等技术,鉴定SEA中诊断抗原蛋白质。方法 SEA经2-DE分离蛋白质后进行银染,或应用日本血吸虫感染兔血清Western blot筛选抗原蛋白点,用MALDI-TOF/TOF串联质谱鉴定每一抗原蛋白质分子。结果 虫卵可溶性蛋白分子经2-DE分离后转印PVDF膜上,与感染兔血清孵育出现29个特异性阳性反应点,与健康兔血清出现3个非特异的阳性反应点;29个特异性抗阳性反应点中,从银染2-DE胶图上找到21个匹配的抗原蛋白质点;MALDI-TOF/TOF质谱鉴定和 NCBI数据库检索,13个点(61.9%)获得匹配蛋白质,4个点(19.0%)获得匹配EST,4个点(19.0%)未能从数据库中找到相匹配的信息。重组表达筛选出的SjCHGC06040和SjP40两个抗原蛋白质,Western blot结果显示reSjCHGC06040、reSjP40均能与感染兔血清抗体发生特异性反应,具有潜在的应用价值。结论 2-DE、MALDI-TOF质谱联合Western blot的免疫蛋白质组学研究方法,用于筛选、鉴定SEA中诊断抗原蛋白质,是切实可行的;但该方法存在一定的局限性,有待进一步改进。
日本血吸虫;虫卵可溶性抗原;免疫蛋白质组学
中国是日本血吸虫肆虐最严重的国家,经过几十年的防治,大部分地区疫情得到控制或基本控制,流行区人体感染率和感染度逐步下降。但是,迄今仍有7省市存在不同程度流行,局部地区人群感染率出现回升,寻找更适合我国血吸虫病流行现状的防制新技术是当前亟待研究的内容[1]。近10年来,日本血吸虫和曼氏血吸虫的基因组、转录组研究取得重大突破,已基本完成基因组草图,同时积累了庞大的生物信息资料[2-3],这为血吸虫病防制新技术研究开创了新局面。
粪检虫卵曾是最常见、最经济、最可靠的日本血吸虫病查病方法。但随着防治工作的深入,人体感染率、感染度已降至较低水平,用粪检虫卵等病原学查病方法从庞大的流行区人群中将感染者筛查出来,不仅费时、费力,并且容易造成漏检。因此,需要建立操作简易并且敏感、特异的诊断技术替代病原学检查[4]。2008年对全国血吸虫病免疫诊断试剂进行评估,结果显示9种采用虫卵可溶性抗原(Soluble egg antigen,SEA)检测特异性IgG抗体的方法,敏感性均在92%以上,能基本满足人群筛查要求,但特异性为70%~97.1%不等[5]。为寻找适合新型诊断技术的特异性抗原分子,本文将经典的高分辨率的蛋白质分离技术双向凝胶电泳(2-DE)与Western blot相结合,从SEA中筛选抗原蛋白质分子,再利用MALDI-TOF质谱和血吸虫生物信息资料鉴定抗原蛋白质。
1 材料与方法
1.1 动物 日本血吸虫感染阳性钉螺由江西省寄生虫病研究所提供,逸放尾蚴前先在30~35℃恒温箱孵育7d;健康新西兰家兔,体重2.5~3.0kg,雄性,由浙江省实验动物中心提供。
1.2 日本血吸虫虫卵收集 用洁净盖玻片蘸取新逸出的日本血吸虫尾蚴,贴于健康家兔腹部皮肤进行人工感染,每兔约2 000条。感染后43d剖杀,取肝脏组织,剪碎后研磨成匀浆,按Ashton PD等[6]介绍的蛋白酶消化结合不同目数的铜筛淘洗分离获得纯净虫卵,分装后-80℃备用。
1.3 虫卵可溶性蛋白样本制备 取冻存的日本血吸虫虫卵样品,用细胞洗涤液洗涤2~3次后,置组织匀浆器中,加入适量预冷的细胞裂解液反复研磨,虫卵匀浆液移至PV管中,冰浴上超声粉碎5min(80W×5s×5次,每次间隔10s),4℃条件下30 000g离心45min,收集上清,按Bradford法测定蛋白浓度,分装后-80℃备用。
1.4 双向电泳 采用13cm IPG 胶条(pH 3-10),上样蛋白量300μg,水化液体积300μL。第一向等电聚焦,设置程序:30V水化12h,500V除盐1h,1 000V除盐1h,8 000V线性升压8h,8 000V快速聚焦35 000Vh,500V保持任意时间。第二向SDS-PAGE:丙烯酰胺胶浓度为12%,将聚焦好的IPG胶条置于PAGE凝胶上端,与凝胶紧密相接,再用0.5%琼脂糖/溴酚蓝封胶条,220V恒压6h。电泳结束后取下凝胶,置去离子水中漂洗2次。1个样本1次同时同样条件做3块胶,2块胶分别作电转印,1块胶进行银染色及质谱鉴定用。
1.5 Western blot 按半干转印仪(Trans-Blot SD Semi-Dry Transfer Cell,BIO-RAD)操作说明进行。电转印条件:24V/胶,30min。转印膜浸泡于5%脱脂奶粉中,4℃封闭过夜,TBST洗涤3次,每次10min;同一样本相同条件下电泳、转印的2张膜,分别与1∶200稀释的混合感染兔血清和混合健康兔血清在室温下孵育1h,TBST洗膜3次,每次10 min;加入1∶40 000稀释的羊抗兔IgG碱性磷酸酶标记物,室温孵育1h;TBST洗膜3次后加入20 mL/氯化硝基四氮唑蓝(5-bromo-4-chloro-3-indolyl phosphate/nitro-blue tetrazolium chloride,BCIP/NBT)底物溶液,避光反应10min,用20mmol/L EDTA溶液洗涤终止反应,结果扫描保存。
1.6 质谱鉴定
1.6.1 抗原蛋白点胶内消化 根据PVDF膜上特异性阳性反应点,在银染色的2-DE胶图上找到相匹配的抗原蛋白质点。手工挖点,用30%乙腈和100mmol/L的NH4HCO3将选定的蛋白质点胶粒脱色至胶块无色透明,吸去脱色液后低压冻干,加入30μL含50ng胰蛋白酶的50mmol/L NH4HCO3中水化,37℃消化过夜。用含0.1%三氟乙酸的60%乙腈提取3次,收集所得肽段低压冻干,-80℃保存待用。无蛋白的胶颗粒按上述方法处理后用作阴参,以鉴定由胰蛋白酶自体酶解产生的产物。
1.6.2 MALDI-TOF/TOF-MS/MS鉴定 MALDI-TOF/TOF质谱鉴定:先用标准肽外标校正ABI 4800Proteomics Analyzer质谱仪,选定5个离子强度最强的肽段作为母离子用于MS/MS串联质谱测序。质谱仪基本参数:波长为355nm,频率200Hz,在正离子反射模式下每张图谱为1 000次激光打击,离子源加速电压20kV,质量范围为800~4 000Da,信噪比最小值为10,本底噪音窗宽度为250m/z时自动确定单同位素峰质量。选定在MS/MS正离子模式下设定默认标准曲线,碰撞能量2kV。所有实验样品的质谱图均以默认模式获得。利用软件Mascot distiller过滤基线峰、识别信号峰。将分析获得的MS及MS/MS数据利用GPS搜索引擎及Matrix Science公司的Mascot软件搜索NCBInr数据库,寻找匹配的相关蛋白质,同时查询其功能。
1.7SjP40、SjCHGC06040抗原的重组表达 按RNA提取试剂盒操作说明书提取日本血吸虫虫卵总RNA。根据SjP40和SjCHGC06040的cDNA序列分别设计、合成1对引物,并插入酶切位点。SjP40:P1:GCGGATCC(BamH I)TTTCCGAGGCATAGACACGA,P2:GCGAATTC(EcoR I)TTATTTCTTGCCACCTGCACCAT;SjCHGC06040: P1:GCGGATCC (BamH I)AGCGAGTTTGTGC TTCACAAACC,P2:TATGCGGCCGC (NotI)TCACTTAGGTTGAT-CAATACGTACCA。以提取的总RNA为模板,应用oligo(dT)引物和逆转录酶RT-PCR合成cDNA,再以此为模板,分别加入SjP40和SjCHGC06040引物,扩增目的基因。PCR产物经BamH I/EcoR I (SjP40) 和BamH I/NotI(SjCHGC06040)双酶切后连接到pET28a载体,将连接产物分别转化E.coliTOP10感受态细胞。取转化产物涂布Kan阳性平板,37℃培养过夜。每个平板挑选10个克隆进行Colony PCR,1%Agarose凝胶电泳验证重组载体。选择Colony PCR阳性的克隆送测序检测。测序结果正确者小量培养抽提质粒,将质粒转化到E.coliRossetta(DE3)感受态细胞,涂布Kan阳性平板,37℃培养过夜,挑选单个白色克隆,接种于LB培养基,于37℃振荡培养OD600达到0.8左右时加入IPTG至终浓度为1mmol/L,诱导表达4h后收菌。收集的细菌经洗涤后,用细胞裂解液及超声粉碎破菌,取上清液,采用Ni-NAT层析柱纯化重组蛋白。用SDS-PAGE检测蛋白表达和纯化结果。
1.8 reSjP40和reSjCHGC06040抗原性检测 纯化的reSjP40和reSjCHGC06040重组蛋白经SDSPAGE电泳后转印到PVDF膜上,5%脱脂奶粉封闭后,分别与anti-His单抗、感染兔血清、健康兔血清孵育,洗涤后分别与碱性磷酸酶标记的抗鼠IgG、抗兔IgG二抗孵育,BCIP/NBT底物显色反应10~15min。
2 结 果
2.1 2-DE和2-DE Western blot图谱 日本血吸虫虫卵可溶性抗原2-DE获得>200个蛋白质点,与感染兔血清反应的Western blot出现29个阳性反应点,与健康兔血清孵育反应出现3个假阳性点(由红色虚线圈标示);29个阳性反应点在相应2-DE胶图上找到21个匹配蛋白质点;其中81.0%(17/21)抗原蛋白质点分子量主要分布在31~66.2kDa之间,5个抗原点分子量在14.4~20.1kDa之间;8个(26.7%)阳性反应点未能在2-DE胶图上找到匹配蛋白质点。
2.2 抗原蛋白质点 MALDI-TOF/TOF-MS/MS分析及搜库结果 21个抗原蛋白点经MALDITOF质谱鉴定,13个点(61.9%)从NCBI数据库找到匹配蛋白质,相关信息资料详见表1;4个点(13、16、18、21)仅从NCBI EST数据库找到匹配的序列;4个点(9、15、19、20)未能从数据库中找到相匹配的信息,占19.0%。
2.3SjP40和SjCHGC06040抗原基因重组表达SjP40和SjCHGC06040基因经PCR扩增产生分别为744bp和909bp的片段,并成功克隆至pET28a载体。重组质粒经测序后与SjP40(GI:226477158)和SjCHGC06040(GI:76156146)序列进行比对,同源性分别达到99.6%和99.0%。转化后的E.coli表达菌经IPTG诱导表达预期分子量的重组蛋白,结果见图2。
2.4 reSjP40和reSjCHGC06040免疫印迹结果纯化的reSjP40和reSjCHGC06040均与日本血吸虫感染兔血清有较强反应,而与健康兔血清未见反应,见图3。
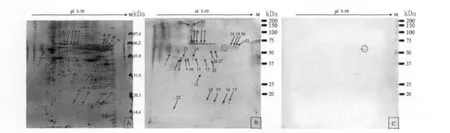
图1 日本血吸虫可溶性抗原2-DE胶图和Western blot结果A:日本血吸虫可溶性抗原2-DE胶图谱,1-21数字箭头所指为匹配的抗原蛋白质点;B:PVDF膜与混合感染兔血清反应的Western blot结果,1-29数字箭头所指为阳性反应点;C:与混合健康兔血清Western blot结果,虚线圈内为假阳性点。Fig.1 Silver-stained 2-DE gels of S.japonicumsoluble egg antigens(A)and corresponding Western blot results of reactivity with pooled infective rabbit sera(B),and pooled normal rabbit sera(C).
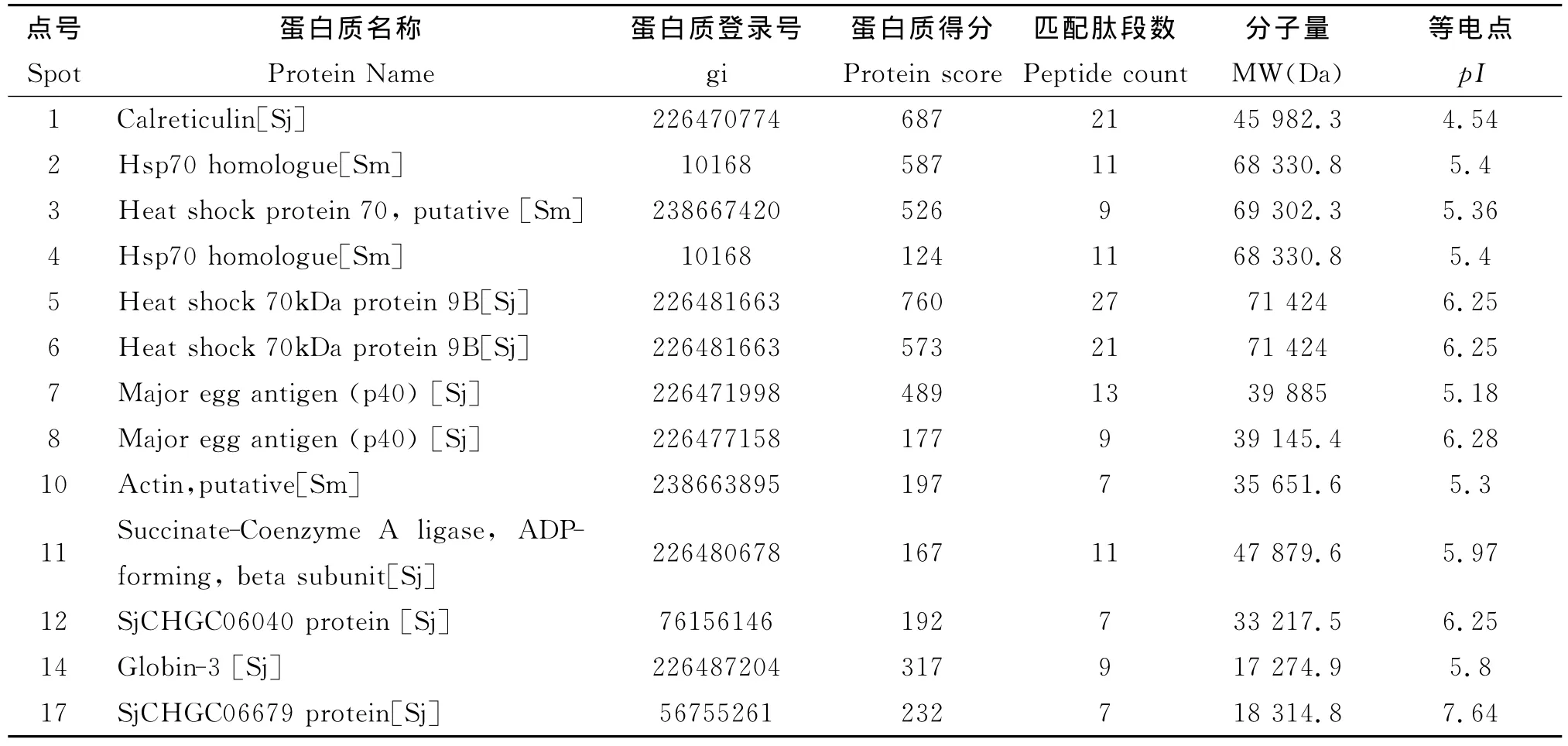
表1 日本血吸虫虫卵抗原蛋白质点质谱鉴定结果Table 1 Identification of proteins in S.japonicumsoluble egg antigens by MALDI-TOF/TOF MS/MS

3 讨 论
早在1975年O’Farrell应用双向电泳成功地分离E.coli蛋白分子,得到类似的蛋白图谱,受当时技术上限制,不能做胶上蛋白鉴定[7]。20年后生物质谱和生物信息学的发展,才使胶上蛋白质鉴定成为可能,蛋白质组学迅速发展。Jungblut PR等率先将双向凝胶电泳(2-DE)和 Western blot联合应用,成功鉴定伯氏疏螺旋体的抗原蛋白质,并于2001年提出免疫蛋白质组学(Immuno-proteomics)概念[8-9]。此后免疫蛋白质组学技术广泛地应用于细菌、病毒、寄生虫及肿瘤细胞抗原蛋白质组研究,形成一门新兴交叉学科。高分辨率的蛋白质分离方法是蛋白质组学及免疫蛋白质组学的技术关键,2-DE是最经典也是目前最常用的蛋白质分离方法。从最初一块胶分离1 000个蛋白质,发展到现在一块34cm×24cm大胶可同时分离10 000个蛋白质点[10]。Mathieson W 和 Wolson RA 用2-DE分离曼氏血吸虫成熟卵可溶性抗原(SEAd),获得686个蛋白质点[11]。本研究采用13cm(pH 3-10)IPG胶条等电聚焦和15cm×16cm SDS-PAGE电泳分离日本血吸虫SEA,结果显示蛋白质点在200个以上,证明有较好的分离效果。将2-DE胶上分离的蛋白质转印到PVDF膜上,用感染兔血清作Westerrn blot获得29个特异性阳性反应点,并在2-DE胶图上找到21个匹配蛋白质点,匹配成功率为72.4%,提示该方案筛选抗原蛋白质是切实可行的。
日本血吸虫成虫寄生在宿主肠系膜静脉内,每天产出大量虫卵,许多不能排出体外的虫卵沉集在肝脏、肠道等组织中。成熟虫卵中的毛蚴不断向组织释放虫卵可溶性抗原,诱发宿主产生一系列免疫反应,形成虫卵肉芽肿,随后继发纤维化。这是血吸虫病的重要致病机理,虫卵可溶性抗原是其主要的致病因子。因此,鉴定和分析虫卵可溶性抗原分子对血吸虫病免疫治疗、免疫诊断以及疫苗研究具有重要意义。Abdel-Hafeez等[12]应用二维高效液相色谱联合dot-ELISA从SEA和成虫可溶性抗原(SWAP)中筛选和鉴定具有疫苗研究价值的抗原蛋白,结果分别获得107个和18个抗原蛋白质,可见SEA中抗原蛋白质数量明显高于SWAP。本研究用2-DE联合Western blot方法用感染兔血清抗体从SEA中分离筛选诊断抗原蛋白质,获得21个匹配蛋白质点,明显多于Zhong ZR等[13]采用同样2DE-Western blot从成虫可溶性抗原(AWA)分离筛选获得的抗原蛋白质数。虽然2-DE是目前蛋白质组研究中首选的分离方法,在肿瘤、自身免疫性疾病免疫蛋白质组研究中应用较多,但是用于血吸虫抗原性蛋白质分离存在一些局限性,分离筛选到的抗原蛋白质数较少,这主要与2-DE的第二向SDSPAGE电泳中使蛋白质二硫键打开、变性有关,蛋白分子成为线性分子,导致抗原空间构像表位被破坏,大多数的抗原分子被漏检。
2-DE胶上21个抗原蛋白质点经 MALDITOF/TOF串联质谱和查库检索,61.9%(13/21)获得匹配蛋白质信息;有8个点NCBI蛋白质数据库检索失败,其中4个点在dbEST数据库检索中获得有意义的匹配,仅4个蛋白质点(19.0%)两库检索均失败。随着日本血吸虫、曼氏血吸虫基因组计划的完成,血吸虫转录组、蛋白质组研究不断深入,血吸虫生物信息资料不断得到完善,抗原蛋白质分子的鉴定成功率也将进一步提高。已鉴定的13个抗原蛋白分子中,38.5%(5/13)是70kDa热休克蛋白(HSP70)。从2-DE胶图上可见这些蛋白质点分子量基本相同,只是pI有微小变化,推测是蛋白分子修饰不同引起pI差异。SEA中主要虫卵抗原P40(major egg antigen,SjP40)也是高丰度蛋白质,已有研究证明曼氏血吸虫、日本血吸虫的主要虫卵抗原P40具有较好的抗原性和诊断价值[14-15]。本研究根据质谱鉴定取得的抗原基因信息,分别构建SjP40、SjCHGC06040原核表达质粒,获得的reSjP40、reSjCHGC06040经Western blot验证具有较好的抗原性。其中reSjCHGC06040印迹图中出现的3条带可能为降解的蛋白引起。已鉴定的其它抗原蛋白质分子有待进一步验证和开发利用。
2-DE、Western blot和 MALDI-TOF质谱蛋白质鉴定相结合是最经典的免疫蛋白质组学研究技术路线,已广泛应用于肿瘤、自身免疫性疾病及感染性疾病研究[16-18]。但是,2-DE 用于血吸虫抗原性蛋白质分离存在一些局限性,如血吸虫膜蛋白是理想的抗原分子,但其多为疏水性蛋白,不适合用2-DE进行分离;尽管现有的2-DE灵敏度能达到ng级,但一些低丰度蛋白质仍无法检测到,因此常见免疫印迹图上一些阳性反应点,在胶图上却找不到匹配的蛋白质点,本研究有8个阳性点未能在胶图上找到匹配蛋白质点,匹配率为72.4%。高丰度蛋白质大多是一些结构蛋白,无抗原性,往往低丰度蛋白抗原性特别强,可能是理想的诊断抗原;2-DE中第二向电泳中SDS为变性剂,使样本中所有蛋白质分子的二硫键打开成为线性分子,部分抗原决定簇被破坏而失去抗原性,在免疫筛检时被漏检。近年来多维高效液相色谱、免疫亲和层析、噬菌体展示等蛋白质分离方法陆续应用免疫蛋白质组研究,避免上述2-DE蛋白质分离技术上不足,可以应用于血吸虫免疫蛋白质组研究。
(对上海中科新生命生物科技有限公司呼建文、丁伟等工作人员在蛋白质组实验研究中给予技术上帮助表示诚挚的感谢!)
[1]Zhou XN,Bergquist R,Leonardo L,et al.Schistosomiasisjaponicacontrol and research needs[J].Adv Parasitol,2010,72:145-178.
[2]Berriman M,Haas BJ,LoVerde PT,et al.The genome of the blood flukeSchistosomamansoni[J].Nature,2009,460(7253):352-358.
[3]SchistosomajaponicumGenome Sequencing and Functional A-nalysis Consortium.TheSchistosomajaponicumgenome reveals features of host-parasite interplay[J].Nature,2009,460(7253):345-351.
[4]Bergquist R,Johansen MV,Utzinger J.Diagnostic dilemmas in helminthology:what tools to use and when?[J].Trends Parasitol,2009,25(4):151-156.
[5]Xu J,Peeling RW,Chen JX,et al.Evaluation of immunoassays for the diagnosis ofSchistosomajaponicuminfection using archived sera[J].PLoS Negl Trop Dis,2011,5(1):e949.
[6]Ashton PD,Harrop R,Shah B,et al.The schistosome egg:development and secretions[J].Parasitology,2001,122(Pt 3):329-338.
[7]O'Farrell PH.High resolution two-dimensional electrophoresis of proteins[J].J Biol Chem,1975,250(10):4007-4021.
[8]Jungblut PR,Grabher G,Stoffler G.Comprehensive detection of immunorelevantBorreliagariniiantigens by two-dimensional electrophoresis[J].Electrophoresis,1999,20(18):3611-3622.
[9]Jungblut PR.Proteome analysis of bacterial pathogens[J].Microbes Infect,2001,3(10):831-840.
[10]Gorg A,Weiss W,Dunn,MJ.Current two-dimensional electrophoresis technology for proteomics[J].Proteomics,2004,4(12):3665-3685.
[11]Mathieson W,Wilson RA.A comparative proteomic study of the undeveloped and developedSchistosomamansoniegg and its contents:the miracidium,hatch fluid and secretions[J].Int J Parasitol,2010,40(5):617-628.
[12]Abdel-Hafeez EH,Kikuchi M,Watanabe K,et al.Proteome approach for identification ofSchistosomiasisjaponicavaccine candidate antigen[J].Parasitol Int,2009,58(1):36-44.
[13]Zhong ZR,Zhou HB,Li XY,et al.Serological proteome-oriented screening and application of antigens for the diagnosis of Schistosomiasis japonica[J].Acta Trop,2010,116(1):1-8.
[14]Abouel-Nour MF,Lotfy M,Attallah AM,et al.Schistosoma mansonimajor egg antigen Smp40:molecular modeling and potential immunoreactivity for anti-pathology vaccine development[J].Mem Inst Oswaldo Cruz,2006,101(4):365-372.
[15]Zhou XH,Wu JY,Huang XQ,et al.Identification and characterization ofSchistosomajaponicumSjp40,apotential antigen candidate for the early diagnosis of schistosomiasis[J].Diagn Microbiol Infect Dis,2010,67(4):337-345.
[16]Martin K,Ricciardelli C,Hoffmann P,et al.Exploring the immunoproteome for ovarian cancer biomarker discovery[J].Int J Mol Sci,2011,12(1):410-428.
[17]Hoppes R,Ekkebus R,Schumacher NM,et al.Technologies for MHC class I immunoproteomics[J].J Proteomics,2010,73(10):1945-1953.
[18]Deenadayalan A,Heaslip D,Rajendiran AA,et al.Immunoproteomic identification of human T cell antigens ofMycobacteriumtuberculosisthat differentiate healthy contacts from tuberculosis patients[J].Mol Cell Proteomics,2010,9(3):538-549.
Identification of diagnostic antigens fromSchistosomajaponicumeggs with immunoproteomic approach
WANG Yue,YANG Zai-feng,MA An,SHI Xiao-hua,CHEN Zhang-hui,LIU Xiao-long,GAN Xiao-xian
(InstituteofParasiticDiseases,ZhejiangAcademyofMedicalSciences,Hangzhou310013,China)
In order to identify useful candidate antigens for diagnosis of schistosomiasis,two-dimensional electrophoresis(2-DE)technology combined with Western blot and MALDI-TOF/TOF-MS/MS spectrometry were applied to analyse soluble egg antigen(SEA)ofSchistosomajaponicum.After being extracted from eggs,soluble proteins were separated by 2-DE.The gels were used for sliver staining or reacted withS.japonicuminfected rabbit sera to screen antigenic proteins by Western blot.Each antigenic molecule identified by MALDI-TOF/TOF-MS/MS.There were 29spots showed on the PVDF membrane that incubated with infected rabbit sera,while 3non-specific spots were reacted with normal rabbit sera.Twenty-one of these 29positive spots were precisely matched with a homologous 2-DE gel.After identified by MALDI-TOF/TOF-MS/MS technique and searched in NCBI database,13molecules were successfully matched with protein database and 4were EST data,while 4were failed.Of these proteins,SjP40andSjCHGC06040were successfully expressed,and Western blot results showed a specific reaction between the recombinant proteins and infected rabbit sera.Therefore,our data suggests the immunoproteomic approach is a suitable method for screening and identification of diagnostic candidate antigens from eggs ofS.japonicum.
Schistosomajaponicum;soluble egg antigen;immunoproteomics
R383.2
A
1002-2694(2011)10-0861-05
*浙江省科技厅专项基金(2007F10029)资助
干小仙,Email:xiaoxian_gan@hotmail.com
1.浙江省医学科学院寄生虫病研究所,杭州 310013;2.浙江省医学科技教育发展中心,杭州 310006
2011-05-06;
2011-06-19
