中国北方汉族男性雄激素受体基因(CAG)n多态与低氧训练后心功能变化的关联性
2011-08-20王海燕胡扬许春艳郝鑫衣龙彦聂晶李燕春
王海燕 胡扬 许春艳 郝鑫 衣龙彦 聂晶 李燕春
1 北京体育大学科研中心(北京 100084) 2 北京体育大学运动人体科学学院3 国防科学技术大学指挥军官基础教育学院 4 江西师范大学体育学院
睾酮有同化作用,可增强蛋白质合成,增加肌肉重量,刺激红细胞生成,加速血红蛋白合成,促进体内抗体形成,增加机体免疫功能和抗感染能力。因此,较高的睾酮水平有利于提高运动能力,也有助于运动后机体疲劳的恢复[1]。在灵长类动物大部分心房、心室肌细胞和冠状动脉、主动脉等血管的大部分内膜平滑肌细胞中都存在雄激素受体,因此,性激素可以直接作用于心血管,在调节心脏代谢、功能,对缺血损伤的反应性和影响血管壁张力,血压、血流等方面可能有重要意义[2]。
雄激素的作用由其靶细胞内雄激素受体(androgen receptor,AR)介导,AR结合容量的高低决定体内有效雄激素水平的高低,是雄激素发挥同化作用的限制性因素[3-7]。因此,AR在睾酮调控途径中起重要作用。研究发现,AR基础的和配体引起的转录活性与该基因外显子1中的(CAG)n 多态重复次数呈负相关[8-13]。离体实验[9,14]、流行病学和临床研究均发现,AR基因CAG正常重复次数范围内的CAG长度与雄性功能有关[15]。目前对该多态与心功能或心血管功能关系的研究尚不多。Lind等在研究该多态与肥厚性心肌病相关性时发现,CAG多态重复次数较少的男性最大左心室壁厚较大[16],提示该多态可能与心脏结构或功能存在一定的相关性。鉴于雄激素对运动成绩和心功能的影响,以及(CAG)n多态对AR转录活性和心脏结构功能可能存在的影响,本研究假设AR基因(CAG)n多态与心功能对低氧训练的应答存在关联性。
1 对象和方法
1.1 受试者
北京体育大学体育系和运动系在校男性大学生71名,其中,健将1名,一级运动员5名,二级运动员42名。全部来自东北三省、河北、天津、山东等中国北方平原地区。身体健康、无家族疾病史,无血缘关系,并且均知情同意。实验前6个月内无高原训练或居住史,实验前1个月及实验期间未服用包括铁剂在内的营养补剂。其中,完成基因解析和心脏功能测试的受试者共58名。受试者基本情况:年龄 19.82 ± 0.21岁,身高 177.56 ± 0.68 cm,体重68.08 ± 0.92 kg,训练年限 4.23 ± 0.30 年。
1.2 低氧训练方案
受试者进行为期30天的低氧训练。低氧环境为人工模拟的常压低氧环境(北京体育大学常压低氧房),训练方案为高住高练低训(HiHiLo)。高住:每天低氧睡眠至少10 h(晚21:00~次日晨7:00),O2浓度为14.8% ~ 14.3%(模拟海拔约2800 ~ 3000米);高练:低氧训练3次/周,O2浓度为15.4%~14.8%(模拟海拔约2500 ~ 2800米),每次以个体常氧环境下75%VO2max为基础强度蹬功率自行车30 min(60 r/min),运动过程中微调功率自行车负荷,使受试者SpO2维持在90%左右(87%~93%);低训:常氧环境下进行平均5次/周、90分钟/次的专项训练,其他时间自行安排活动。北京平原地区的海拔高度在20~60米之间。
1.3 心功能和体重测试
心室结构和功能的测定:低氧训练前后分别测试1次。运动方式为卧式蹬车的极限下递增负荷运动。受试者身着单衣单裤,静坐10 min后平卧,测定安静时心室结构和功能指标,然后以起始负荷50 W、60 r/min的频率开始蹬车,每3 min递增负荷50 W,至150 W蹬完3 min后停止,平卧恢复3 min。分别测定50 W、100 W、150 W负荷和恢复期最后30 s的左心室结构和功能指标。每名受试者两次测试中的时间(上午、下午、晚上)保持一致。全部测试由同一名实验师完成。使用仪器:卧式功率自行车(ERICH JAEGER ERGOTEST ER3/A),德国;超声心动仪(CarisPLUS-DU3),意大利。
测量左心室收缩末期内径(LVEDS)和舒张末期内径(LVEDD),并计算射血分数(EF)、每搏输出量(SV)、每搏输出量指数(SI)、心输出量(CO)和心指数(CI)。计算公式如下:EF =(EDD3- ESD3)/ EDD3× 100% ;SV(m l)= EDD3- ESD3;SI = SV / bsa;CO(L/min)= SV × HR ;CI = CO / bsa。体表面积(bsa,单位 m2)= 0.006 ×身高(cm)+ 0.0128 × 体重(kg)- 0.1529。同时测量心率(HR)。
1.4 (CAG)n重复多态的基因型分析
从受试者血液白细胞中提取DNA,-80℃保存。PCR扩增:(1)使用primier5.0软件自行设计引物,并用HEX标记上游引物5’端。forward :5’- HEX CCA GAA TCT GTT CCA CAG CGT GC-3’;reverse:5’- CCT CAT CCA GGA CCA GGT AGC CT-3’。(CAG)22次 重 复 PCR 产 物 片 段长 269bp。(2) PCR 反应体系(20μl):DNA 模板100ng,0.2μl Taq 酶(5U/μl),0.4 μl dNTP(10mM),2μl Mg2+(25mM),上下引物各 1μl(0.05 μg/μl),2μl 10×buffer,13 μl灭菌双蒸水补齐。(3)PCR 扩增条件:95℃预变性5 min;循环参数:变性94℃30 s,退火60℃ 30 s,延伸72℃ 30 s,共30个循环;72 ℃延伸10 min。经1%琼脂糖凝胶电泳,EB染色检测PCR产物。(4)荧光标记复合STR(Short Tandem Repeat)-genescan方法检测(TAAAA)n多态重复次数:Genescan-500〔Rox〕作为内标(美国ABI公司),使用ABI-377DNA分析仪(美国ABI公司)确定片段长度;genescan3.1软件分析扩增产物。随机选取10个PCR扩增片段进行测序以效验以上分析的准确性。(CAG)22次重复等位基因的片段长度为266bp。
1.5 统计学分析
分别以CAG 21和22次重复等位基因作为分割点分组,将受试者分为短链组(≤21组和≤22组)和长链组(>21组和>22组)。心功能指标对低氧训练应答的计算公式为Δ =(训练后-基础值)/ 基础值 ×100%。
若数据符合正态分布,使用独立样本t检验分析不同基因型组间各指标差异,使用配对t检验分析低氧训练前后各指标差异;不符合正态分布则进行非参数检验。采用SPSS11.5统计软件处理所有数据,结果以Mean ± SE表示。双尾检验,显著性水平为P ≤ 0.05,极显著性水平为P ≤ 0.01。
2 结果
本研究受试者均为男性,AR基因位于X性染色体上,因此在男性中不需做Hardy-Weinberg平衡检验。
2.1 (CAG)n 多态等位基因携带者的身高、体重、Bmi和体表面积
表1显示,(CAG)n多态短链组的身高,以及低氧训练前后体重和体表面积值均显著低于长链组;低氧训练后≤22次重复等位基因携带组Δweight、ΔBmi和Δbsa均显著低于>22次组。
同时进行配对t检验发现,与低氧训练前相比,两短链携带组低氧训练后体重、Bmi和bsa均无显著性变化,而两长链携带组以上三项指标均有显著性变化。
2.2 (CAG)n 多态等位基因携带者的心功能
2.2.1 安静时心功能(表2)
安静时,≤22次组低氧训练前SV初始值显著低于>22次组,HR显著高于>22次组。与低氧训练前相比,低氧训练后各基因型组SV和SI均显著增加,且长短链组间SV存在显著差异;各基因型组HR均显著降低;短链组CO和CI显著降低,且CO在≤21组和>21组间存在显著差异;两长链组EF均显著增加。低氧训练后,短链组安静时ΔCO和ΔCI下降幅度均显著大于长链组,同时≤21次组安静时ΔHR下降幅度显著大于>21次组。
2.2.2 50W负荷运动时心功能(表3)
50W负荷时,两短链组低氧训练前SV初始值均分别显著低于两长链组;≤22次组HR显著高于>22次组。与低氧训练前相比,低氧训练后各基因型组SV和SI均显著增加,且SV在两长短链组间均存在显著性差异;各基因型组HR均显著降低;短链组CO和CI显著降低,且CO在≤21和>21组间存在显著性差异;除≤22组外,EF均显著增加。低氧训练后,≤21次组ΔHR和ΔCI下降幅度显著大于>21次组。

表1 AR基因(CAG)n多态各基因型携带者身高、体重、Bmi 和体表面积

表2 AR基因(CAG)n多态各基因型携带者安静心功能
2.2.3 100W负荷运动时心功能(表4)
100W负荷时,≤22和>22次组携带者低氧训练前SV初始值存在显著性差异。与低氧训练前相比,低氧训练后长链组的SV和SI均极显著性增加,且SV在长短链组间存在显著性差异;各基因型组的HR均极显著性降低;短链组CO和CI均显著性降低,且CO在≤21和>21组间存在显著性差异。低氧训练后,除≤22和>22次重复等位基因携带组ΔCO差异的P值为0.056外,短链携
带组ΔCO和ΔCI下降幅度均显著性大于长链组。

表3 AR基因(CAG)n多态各基因型携带者50W负荷心功能变化
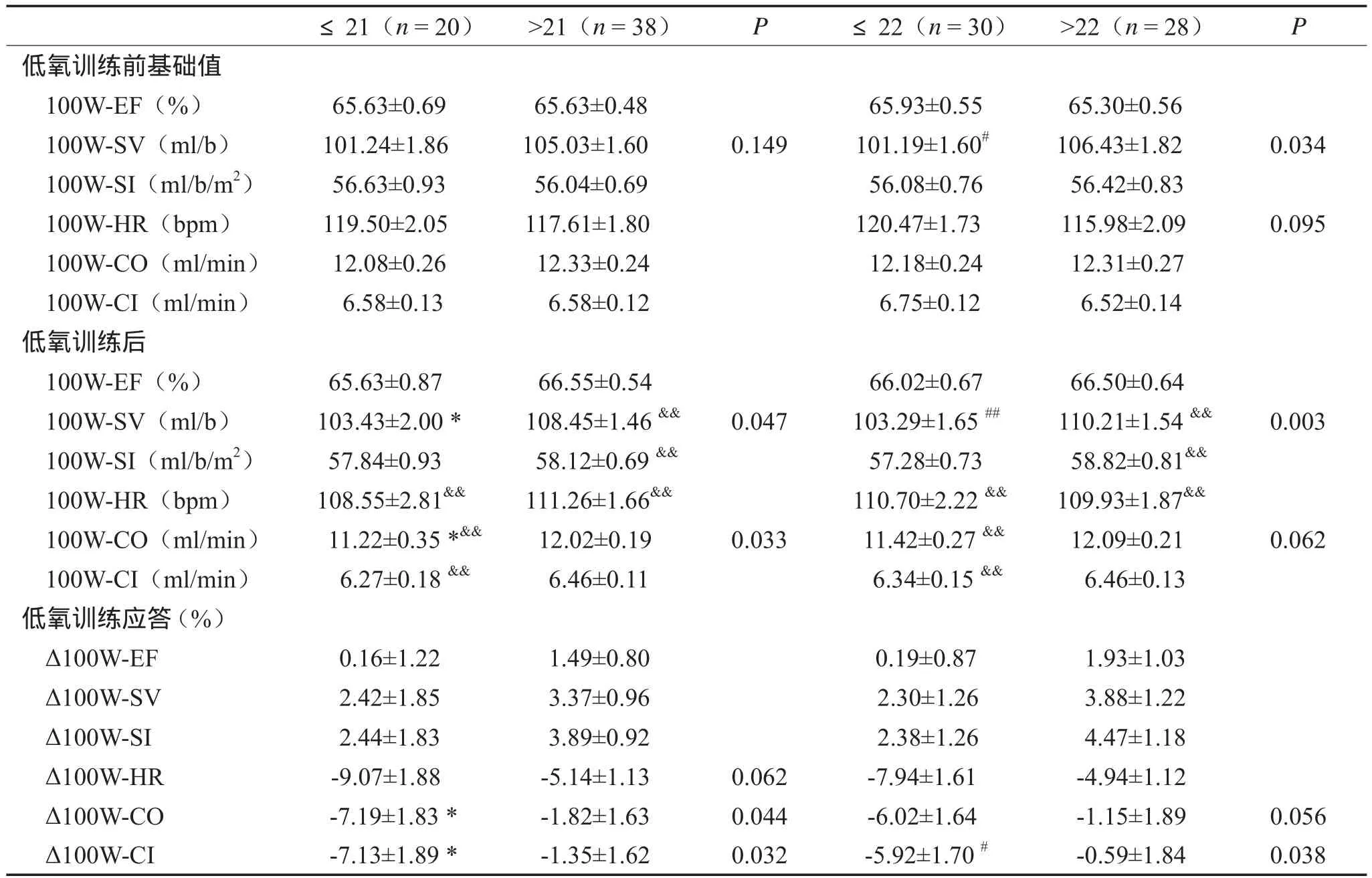
表4 AR基因(CAG)n多态各基因型携带者100W负荷心功能变化
2.2.4 150W负荷运动时心功能(表5)
150W负荷时,CAG ≤22次组携带者低氧训练前SV初始值显著低于>22次组。与低氧训练前相比,低氧训练后长链组SV和SI均极显著性增加,且SV在≤22和>22次组间存在显著性差异;各基因型组的HR均极显著性降低;除>22次组外,各基因型组的CO和CI均显著性降低。低氧训练后,≤22次组ΔCI下降幅度显著性大于>22次组。
2.2.5 运动后恢复时心功能(表6)
恢复时,≤22次组携带者低氧训练前SV初始值显著低于>22次组。与低氧训练前相比,低氧训练后>21次和≤22次组的SV和SI均显著性增加,且SV在≤22和>22次组间存在显著性差异;各基因型组的HR均极显著性降低;各基因型组的CO和CI均极显著性降低。

表5 AR基因(CAG)n多态各基因型携带者150W负荷心功能变化
3 讨论
完成所有测试的58名受试者中,CAG短链携带组身高、低氧训练前体重和体表面积基础值均显著低于长链组。为期30天的低氧训练后,体重和体表面积仍存在显著性差异,≤22次重复携带者体重、Bmi和体表面积变化率显著低于>22次组。文献中关于AR基因CAG多态重复长度与体成分关系的报道不一致。有的研究报道该多态长度与Bmi、腰围和肥胖程度正相关;有的报道与体成分指标包括体重、腰围和体脂百分比等均无相关性;有的报道与瘦体重正相关,而有些则报道与体脂正相关[15,17-21]。这可能与受试者性别、健康状况,以及样本量不同有关。关于这方面的研究仍需进一步深入。
本实验中,HiHiLo对全体受试者的心功能有显著影响。除100W、150W和恢复时EF外,其他安静、运动和恢复时EF、SV和SI均显著升高,而HR、CO和CI均显著下降。
按基因型分组,低氧训练前,≤22次组安静、运动和恢复时SV显著低于> 22次组,但SI无显著性差异。低氧训练后,两短链组在安静、运动和恢复时SV均分别显著低于两长链组(仅≤21次和>21次组在150W运动和恢复期除外),但SI无显著性差异。而且,低氧训练前后,两短链组身高、体重和体表面积均分别显著低于两长链组。低氧训练后,安静、运动和恢复时的ΔSV和ΔSI长、短链组间均无显著性差异。综合以上分析,提示(CAG)n长、短链基因型组间SV的显著差异主要是不同基因型体重和体表面积差异引起的,而非不同基因型携带者SV对低氧训练应答的差异。
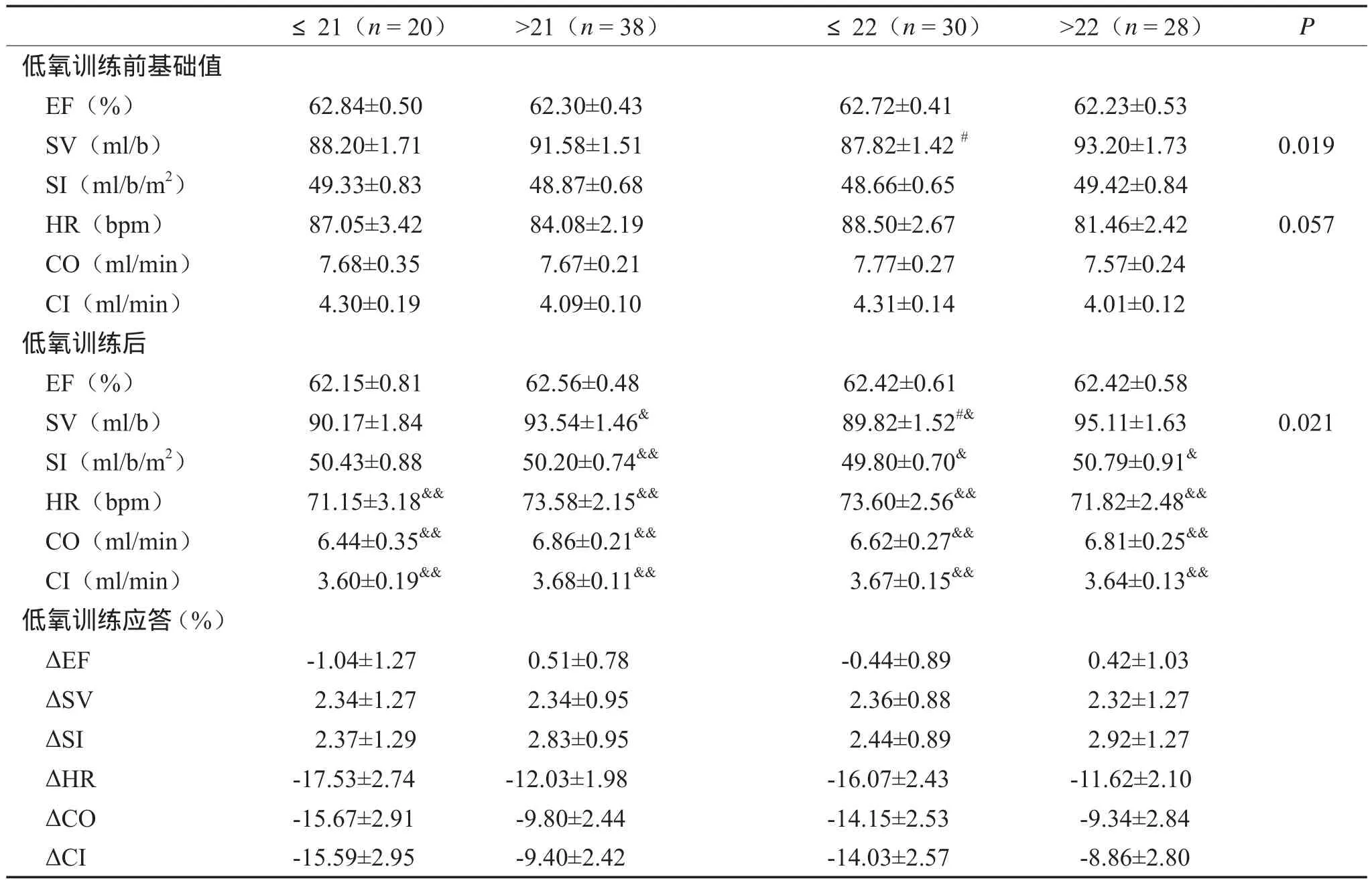
表6 AR基因(CAG)n多态各基因型携带者恢复时心功能变化

与低氧训练前相比,低氧训练后两短链组安静、运动和恢复时的CO和CI均显著降低,而两长链组仅在恢复期和150 W运动时(> 21次组)显著降低,并且,除150 W运动(P = 0.059)和恢复期外,CO在≤21次和>21次组间均存在显著性差异;同时,除50 W和150 W(均以22次划分基因型)外,低氧训练后短链组安静和运动时ΔCI下降幅度均显著大于长链组(图1),提示机体血液运氧能力和肌肉用氧能力增加。
与低氧训练前相比,低氧训练后各基因型组安静、运动和恢复时的HR基本呈显著下降。低氧训练后≤21次组安静、50 W运动时ΔHR下降幅度显著大于>21次组。
本课题前期关于CAG多态与VO2max关联性的研究中,也分别以重复21和22次等位基因作为分割点划分基因型,发现低氧训练后短链组ΔVO2max和ΔrVO2max均显著高于长链组[22]。本研究中不同基因型组间CO、CI和HR对低氧训练应答的差异可能是低氧训练前后其ΔVO2max和ΔrVO2max存在显著性差异的原因之一。
AR可能通过该基因多态性调节体内的激素水平,间接或直接作用于心血管系统影响心功能。
4 总结
本研究以AR基因(CAG)n多态重复21次和22次等位基因作为分割点划分基因型组,分析中国北方汉族男性该重复多态与低氧训练后心功能变化的关联性。结果发现,AR基因(CAG)n多态与常压低氧环境下HiHiLo训练效果之间可能存在关联性。
[1]Hartgens F & Kuipers H. Effects of androgenic–anabolic steroids in athletes. Sports Med,2004,34,513-554.
[2] 吴赛珠. 性激素平衡紊乱与疾病. 北京:人民军医出版社,2005. 96-99.
[3]Choong CS,Wilson EM. Trinucleotide repeats in the human androgen receptor:a molecular basis for disease. J Mol Endocrinol,1998,21 :235-257.
[4]Griffin JE,Wilson JD. Disorders of the testes and the male reproductive tract. In:W illiams Textbook of Endocrinology,9th edn(eds J. D. Wilson,D. W. Foster,H. M. Kronenberg & P. R.Larsen),WB Saunders Co.,Philadelphia,1998. 819-875.
[5]Chang CY,McDonnell DP. Androgen receptor–cofactor interactions as targets for new drug discovery. Trends Pharmacol Sci,2005,26:225-228.
[6]Zitzmann M. The role of CAG repeat androgen receptor polymorphismin andrology. Front Horm Res,2009,37:52-61.
[7]Heinlein CA,Chang C. The roles of androgen receptors and androgen-binding proteins in nongenomic androgen actions. Mol Endocrinol,2002,16(10):2181-2187.
[8]Tilley WD,Marcelli M,Wilson JD,et al. Characterization and expression of a cDNA encoding the human androgen receptor. Proc Natl Acad Sci USA,1989,86:327-331.
[9]Chamberlain NL,Driver ED,miesfeld RL. The length and location of CAG trinucleotide repeats in the androgen receptor N-terminal domain affect transactivation function. Nucleic Acids Res,1994,22:3181-6.
[10]Kazemi-Esfarjani P,Trifiro MA,Pinsky L. Evidence for a recessive function of the long polyglutamine tract in the human androgen receptor:possible pathogenetic relevance for the(CAG)n-expanded neuronopathies. Hum Mol Genet,1995,4 :523-27.
[11]Choong CS,Kemppainen JA,Zhou ZX,et al. Reduced androgen receptor gene expression w ith fi rst exon CAG repeat expansion. Mol Endocrinol,1996,10 :1527-1535.
[12]Tut T,Ghadeesy F,Trifiro M,et al. Long polyglutamine tracts in the androgen receptor are associated w ith reduced transactivation,impaired sperm production,and male infertility. J Clin Endocrinol Metab,1997,82:3777-82.
[13]Callewaert L,Christiaens V,Haelens A,et al. Implications of a polyglutamine tract in the function of the human androgen receptor. Biochem Biophys Res Commun,2003,(20):46-52.
[14]Beilin J,Ball EM,Favaloro JM,et al. Effect of the androgen receptor CAG repeat polymorphism on transcriptional activity:specificity in prostate and non-prostate cell lines. J Mol Endocrinol,2000,25:85-96.
[15]Zitzmann M,Gromoll J,von Eckardstein A,et al. The CAG repeat polymorphismin the androgen receptor gene modulates body fat mass and serum concentrations of leptin and insulin in men. Diabetologia,2003,46:31-39.
[16]Lind JM,Chiu C,Ingles J,et al. Sex hormone receptor gene variation associated w ith phenotype in male hypertrophic cardiomyopathy patients. J Mol Cell Cardiol,2008,45(2):217-22.
[17]Walsh S,Zmuda JM,Carley JA,et al. Androgen receptor CAG repeat polymorphismis associated w ith fatfree mass in men. J Appl Physiol,2005,98 :132-137.
[18]Stanworth RD,Kapoor D,Channer KS,et al. Androgen receptor CAG repeat polymorphismis associated w ith serum testosterone levels,obesity and serum leptin in men w ith type 2 diabetes. Eur J Endocrinol,2008,159:739-746.
[19]Gustafson DR,Wen MJ,Koppanati BM. Androgen receptor gene repeats and indices of obesity in older adults.Int J Obes Relat Metab Disord,2003,27:75-81.
[20]Huhtaniemi IT,Pye SR,Limer KL,et al. Increased estrogen rather than decreased androgen action is associated w ith longer androgen receptor CAG repeats. J Clin Endocrinol Metab,2009,94:277-284.
[21]Lapauw B,Goemaere S,Crabbe P,et al. Is the effect of testosterone on body composition modulated by the androgen receptor gene CAG repeat polymorphismin elderly men? Eur J Endocrinol,2007,156 :395-401.
[22]王海燕,胡扬,郝鑫,等. 中国北方汉族男性雄激素受体基因(CAG)n多态分布及其与低氧训练效果的关联性研究. 中国运动医学杂志,2010,29(2):128-132.
