不同化疗药物介入干预环境下对肝癌细胞系的敏感性
2011-08-20朱林忠杨仁杰
朱林忠,朱 旭,杨仁杰,宁 涛
(1.北京大学临床肿瘤学院介入科;2.北京肿瘤医院暨北京市肿瘤防治研究所,恶性肿瘤发病机制及转化研究教育部重点实验室;北京 100142)
原发性肝癌(primary hepatic carcinoma)是常见恶性肿瘤之一,我国是原发性肝癌的高发地区,每年约有10余万人死于肝癌,外科手术切除率不足1/3,对于多数中晚期恶性肿瘤患者往往缺少有效的治疗手段;全身化疗、放疗和局部消融等治疗方法效果仍然不满意,经动脉灌注化疗栓塞术(transcatheter arterical chemoembolization,TACE)近年来以其可靠的疗效及较低的并发症逐渐成为中晚期原发性肝癌的首选治疗方法[1,2];目前我院行介入治疗时术中以栓塞为主,术后常规于肿瘤供血动脉留置导管6-48 h行持续动脉化疗;采用2-3种化疗药物序贯化疗;该方法改变了药代动力学,避免了首过效应,显著增加了局部浓度;但是绝大多数的肝癌发生在已存在肝脏疾病(慢性乙型、丙型病毒性肝炎和/或酒精性肝硬化)的基础上,肝功能已有损害,肝癌细胞暴露于高浓度的细胞毒性药物的同时,同时也能够造成靶血管的损伤及邻近正常肝组织的损伤;使肝星状细胞、内皮细胞、库弗氏细胞的活性增加,导致细胞外基质合成、代谢异常,促进肝纤维化的发生;
为此介入学界已经进行了多种临床实验,证实小剂量动脉持续化疗同样可以达到满意的临床效果,同时极大的保护了人体功能;但是给药的剂量仍旧混乱,也没有考虑每个患者的肿瘤负荷及分布;给药的时间、方式也没有定论;为此设计本实验以便找出临床最适合的药物、浓度、作用时间以及药物序贯,在减少毒副反应的情况下保证疗效;推进精细化及规范化的肿瘤介入化疗。
1 材料与方法
1.1 化疗药物浓度的设定
经动脉持续化疗期间,局部血药浓度极高,给药期间,肿瘤组织中化疗药始终维持在高浓度状态;给药结束后,该种药物在肿瘤内的浓度急剧下降;目前关于化疗药对肿瘤的作用的大部分研究采取的浓度多为静脉化疗模式下的血药浓度,与动脉化疗实际能达到的浓度相差很大;各种高浓度的化疗药对肿瘤的作用也有研究,但是其作用时间临床实践难以达到;介入化疗中如何确定局部血药浓度目前仍没有定论;即使按照统一方案给药,每个患者的肿瘤供血量均不相同,局部血药浓度差别也很大,造成局部用药量不足/过剩;我们在介入治疗术中测定了患者的肝癌供血动脉血流量,依据最终导管头所处动脉的不同,血流量波动在0.5-6ml/s之间;根据这一结果及临床药物的常用剂量,我们计算出在各种情况下局部血药浓度的范围,在此范围内选取5个阶梯血药浓度,每一种药物浓度分别与肝癌细胞系作用4个不同的时间段。
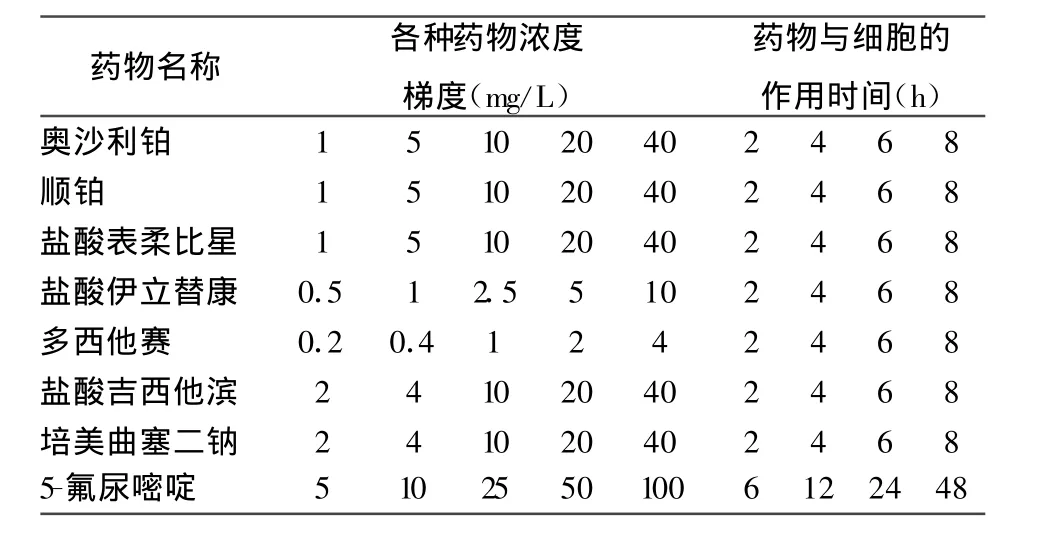
表1 各种药物的药物浓度梯度及持续作用时间
1.2 实验用试剂及仪器
1.2.1 试验用药物 药物的选择:目前,多数临床研究均集中于蒽环类、5-Fu类、铂类、喜树碱类、吉西他滨等药物[3-6],以奥沙利铂、吉西他滨为基础的新一代方案显示了一定的疗效优势和较好的安全性;为此,我们选择了奥沙利铂、顺铂、盐酸表柔比星、盐酸伊立替康、多西他赛、盐酸吉西他滨、培美曲塞二钠、5-氟尿嘧啶注射液作为观察对象;分析方法采用常用的MTT法;各药物来源如下:注射用盐酸吉西他滨,0.2 g,哈尔滨誉衡药业股份有限公司,100607;注射用培美曲塞二钠,0.2 g,齐鲁制药有限公司,1010012DV;注射用奥沙利铂,50 mg,赛诺菲,安万特,2010.03;注射用顺铂,10 mg齐鲁制药有限公司,111023CF;5-氟尿嘧啶注射液,0.25 g,天津金耀氨基酸有限公司,20101123;注射用盐酸表柔比星,辉瑞制药(无锡)有限公司,1007021;多西他赛注射液;江苏恒瑞医药股份有限公司,10112612;注射用盐酸伊立替康40 mg江苏恒瑞医药股份有限公司20100409;
1.2.2 实验用试剂及设备 96孔板:Costar 3599 Corning Incorporated,细胞系:人肝癌HepG-2细胞系,北京大学临床肿瘤学院遗传室提供;培养液:DMEM+10%胎牛血清;MTT:MTT(四甲基氮唑蓝):Sigma公司产品108178;DMSO:国药集团化学试剂有限公司,分析纯 101201;洁净台:Heal Force;孵育箱:SANYO MCO-15AC 37℃,5%CO2;显微镜:Olympus IX50倒置光显微镜;酶标仪:BIO-RAD Model 680 microplate Reader;
1.2.3 实验方法 采用人肝癌细胞系HepG-2,接种于100 ml玻璃培养瓶中,在含体积分数10%胎牛血清的DMEM培养基中贴壁生长,于37℃、5%CO2孵育箱中培养。细胞贴壁生长,每2-3天传代一次。至细胞足够数量,按照每孔2×103个细胞备用;
将对数生长的人肝癌细胞HepG-2以2×103个/ml浓度100 μ l接种于96孔培养板上,加空白培养液90 μ l;DMEM培养基孵育24 h后,其中化疗药与3种辅助用药分别按照不同浓度各取10 μ l分别加入孔内,每一浓度加4个复孔,空白对照组加10 μ l培养液。药物与细胞作用4h后,吸弃药液及培养液,实验组和空白组均以培养液反复清洗,更换空白培养液继续培养至72 h,然后统一进行MTT检测,每孔加入MTT(5 g/L)10 μ l培养4 h,弃去培养液,每孔加入二甲基亚砜(DMSO)200 μ l,在 BIO-RAD Model 680 microplate Reader型酶标仪上以570nm波长检测各孔吸光度值(OD值,A值),计算抑制率(%)=(1-A/A0)×100%。A:各药物浓度组光吸收值(均值),A0:未加药物组(对照组)光吸收值(均值)。
2 结果
本实验在人肝癌HepG-2细胞系中分别测定了9种化疗药物不同作用浓度和时间的作用特点,发现各种化疗药对肝癌细胞的抑制率存在较大差别,以奥沙利铂、表柔比星、多柔吡星脂质体抑制率最高,5-Fu,顺铂、吉西他滨、培美曲塞二钠、伊立替康次之,多西他赛抑制率较低;每一种药物随着浓度的提高,对肝癌细胞的抑制率增加,但是当浓度增加到一定程度后,其抑制率基本保持不变;作用时间对抑制率也有很大影响,但是大多数化疗药达到一定时间后其效果增加也趋于平缓。
下列各图为不同浓度化疗药物与肝癌细胞系作用不同时间的结果,横轴为作用时间,纵轴为抑制率,每一条曲线代表一种浓度的化疗药在不同作用时间下对肝癌细胞系的抑制率。
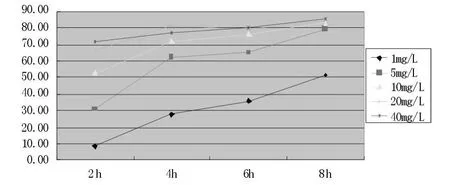
图1 不同浓度奥沙利铂与HepG-2细胞系作用不同时间的结果
图1中可以看出,奥沙利铂在1 mg/L浓度下,其对肿瘤抑制率随着时间的延长而持续增加,而当浓度提高到5 mg/L和10 mg/L,作用2-4 h抑制率提高较快,4 h后则提高程度趋缓;当浓度大于20 mg/L时,作用2 h和4 h抑制率差别不大,随着时间延长抑制率未见提高,继续提高至40 mg/L未见变化;说明奥沙利铂在较低浓度情况下其抑制率与时间呈正相关,当浓度提高时,达到稳定抑制率时间缩短,继续提高浓度很快达到极限值。
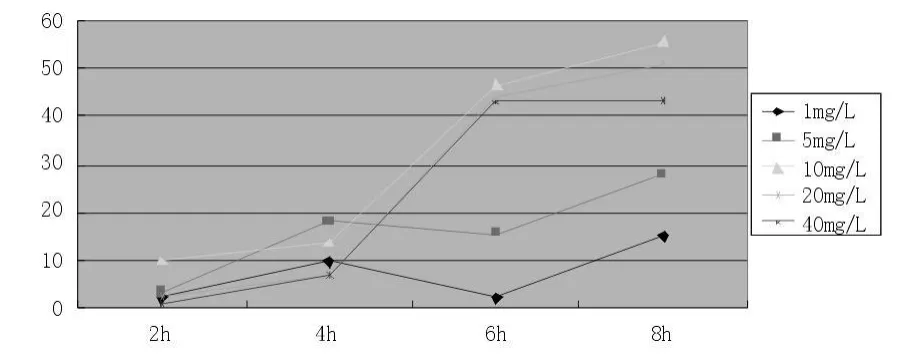
图2 不同浓度顺铂与HepG-2细胞系作用不同时间的结果
图2中可以看出,各个浓度的顺铂在2 h和4 h内抑制率差别不大,但是作用时间延长到6 h后,1 mg/L、5 mg/L浓度抑制率随着时间的延长而轻度增加,当浓度提高到10 mg/L及更高浓度后,抑制率明显增加,且差别不大,说明顺铂作用需要较高浓度及较长时间;6 h及10 mg/L浓度均达到较好的抑制效果。
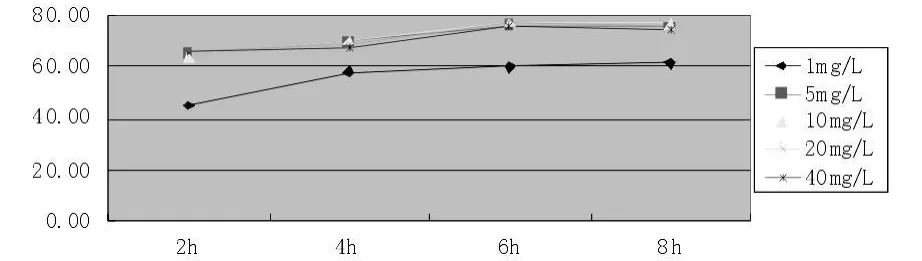
图3 不同浓度表柔比星与HepG-2细胞系作用不同时间的结果
表柔比星起效迅速,除1 mg/L浓度需要4 h达到最大抑制率外,其它浓度在2 h即达到较为稳定的抑制率,且各浓度下抑制率相近;说明该药起效浓度低,需要维持的时间短。
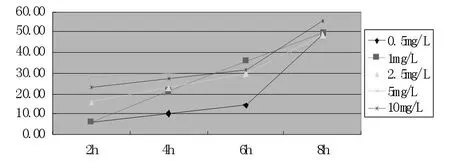
图4 不同浓度多西他赛与HepG-2细胞系作用不同时间的结果
多西他赛在0.5 mg/L的低浓度下,其抑制率随时间延长缓慢提高,到8 h时明显提高,当浓度大于1 mg/L后,随时间延长抑制率快速提高;继续提高浓度抑制率提高缓慢;各个浓度到8 h时抑制率相近(图3)。
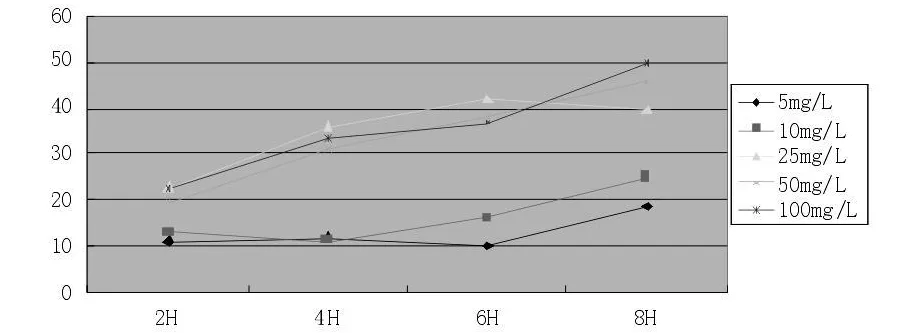
图5 不同浓度吉西他滨与HepG-2细胞系作用不同时间的结果
吉西他滨在5 mg/L和10 mg/L的较低浓度下,其抑制率随时间延长而缓慢提高;当浓度大于25 mg/L后,三个浓度下2-4 h抑制率增加,大于4 h后增加缓慢;各浓度之间无明显差别(图4)。
吉西他滨作用于S期,低浓度下表现为随时间延长抑制率增加,但是在高浓度下作用方式也类似于CCNSA,较快达到最大抑制率,延长时间、增加浓度无明显变化。
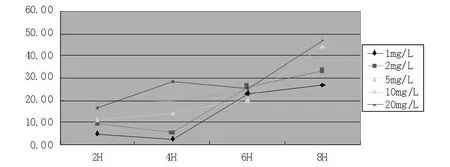
图6 不同浓度 CPT-11与HepG-2细胞系作用不同时间的结果
CPT-11在各个浓度下均表现为抑制率随时间延长而增加,8 h以内抑制率持续提高,但是当浓度≥5 mg/L时抑制率不随浓度增加而增加;单纯表现为时间依赖特性(图5)。
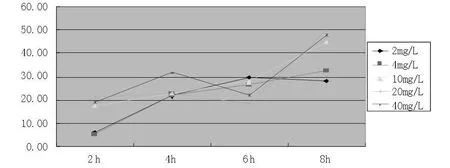
图7 不同浓度培美曲塞二钠与HepG-2细胞系作用不同时间的结果
培美曲塞二钠在各个浓度下均表现为抑制率随时间延长而增加,各组浓度之间抑制率随浓度增加轻度增加,更多表现为时间依赖特性(图7)。
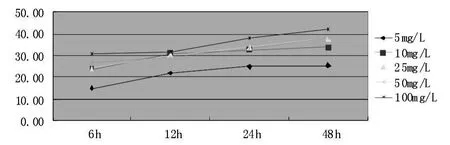
图8 不同浓度5-Fu与HepG-2细胞系作用不同时间的结果
5-Fu随着浓度增加,抑制率逐渐提高,大于10 mg/L后各浓度效果相近;24 h后抑制率增加缓慢(图8)。
3 讨论
经动脉持续灌注化疗模式下,药物经动脉泵持续、均匀的泵入,动脉血流也同时以相对恒定的流量流入肿瘤组织内,使得局部血液中及肿瘤组织内的药物浓度在一特定时间段内始终保持相对稳定状态;取得了全身化疗无法取得的持续、稳定的血药浓度;在该时间段内,可以理解为肿瘤组织“浸泡”在恒定浓度的化疗药物中;且该药物系直接接触肿瘤,而没有经过人体代谢变化;为此我们完全可以在体外模拟出类似的药物环境。
目前我科在原发性肝癌介入治疗中常规于栓塞治疗后留置导管,于病房行持续动脉灌注化疗;较从前术中直接灌注,患者疗效及耐受性均有改善;但是对于某一种化疗药的最佳作用时间及浓度仍缺乏基础研究。
传统实验涉及实验中所列项目,但是其浓度极少能达到临床实践中所能达到的浓度;高浓度下药物的作用方面的资料较为零散;且其与作用时间的关联缺乏报道;通过实验,我们发现,对于周期依赖型药物如5-Fu、CPT-11、多西他赛、培美曲塞二钠随着浓度提高,抑制率增加;但是更多的表现为随时间延长,疗效增加[7-9]。
CPT-11在人体中该药经过肝脏代谢、转化,会成为细胞毒性更强的SN-38,我们实验中没有能模拟出该代谢途径;但是通过观察CPT-11本身对肝癌细胞系的作用,发现在各个浓度下均表现为抑制率随时间延长而增加,8h以内抑制率持续提高,但是当浓度≥5 mg/L时抑制率不随浓度增加而增加;单纯表现为时间依赖特性;实验使用的是药物原型,没用使用其体内代谢产物SN-38;抑制率偏低可能与此有关。
培美曲塞二钠为叶酸代谢抑制剂,近年来也逐渐用于肝癌治疗;实验结果显示各个浓度下均表现为抑制率随时间延长而增加,不除外随时间进一步延长至8 h之外,抑制率会进一步增加。
吉西他滨的细胞毒性表现随时间延长持续增加,这符合其细胞周期依赖型药物的特点;但是实验还显示,当浓度≥25 mg/L与浓度≤10 mg/L效果差别明显;这说明细胞周期依赖型药物同样在高浓度下可以达到更好的杀伤作用;当浓度≥25 mg/L时,各浓度之间无明显差别;
浓度依赖型药物奥沙利铂、顺铂、盐酸表柔比星对于动脉化疗比较适合,虽然各自作用曲线不同,但是基本表现类似,在较低浓度情况下,作用效果同时间成正相关,在较高浓度下,则表现为起效时间缩短,延长时间疗效增加不明显;在高浓度情况下,则更多的表现为与浓度相关,延长时间并不能增加疗效[10]。
药物浓度和时间的关系:在低浓度情况下,药物对肿瘤的抑制率岁时间延长而逐渐增加;但是随着浓度的提高,其毒性作用很快即能达到最大值,继续延长作用时间意义不大;从曲线中还可以看出,大多数药物是有“饱和浓度”的,当浓度提高到一定程度时,继续增加浓度,抑制率没有明显提高;每一种药物都有各自最佳浓度—时间组合,在此浓度/时间之上则存在饱和现象;这提示我们用药时要把握合适的剂量及时间,在保证足够的细胞毒性前提下,减少药物不良反应。
实验结果表明,每一种药物都有其适合的作用浓度及作用时间;临床上完全可以根据每一个患者的具体情况设计用药;在保证足够浓度的情况下,没有必要无限制的延长作用时间,这样只能增加用药总量,加重肝脏损伤及全身毒性。
实验只检测了各种药物在肝癌细胞系中的作用,对于其它肝癌细胞系未作进一步检测;细胞学代谢环境与生物体内环境的差别以及人体肿瘤的基因型的差异,该实验结果与生物体内结果是否相符还需要进一步验证;对于浓度依赖性药物,最低浓度与下一浓度之间相差5倍,需要进一步实验细化浓度梯度。
[1]Ganeshan A,Upponi S,Hon LQ,Warakaulle D,Uberoi R.Hepatic arterial infusion of chemotherapy:the role of diagnostic and interventional radiology[J].Ann Oncol,2008,19:847.
[2]Iguchi T,Arai Y,Inaba Y,Yamaura H,Sato Y,Miyazaki M,Shimamoto H.Hepatic arterial infusion chemotherapy through a port-catheter system as preoperative initial therapy in patients with advanced liver dysfunction due to synchronous and unresectable liver metastases from colorectal cancer[J[.Cardiovasc Intervent Radiol,2008,31:86.
[3]杨朝旭,秦叔逵.奥沙利铂治疗原发性肝癌的临床研究进展[J].临床肿瘤学杂志,2010,(09).
[4]华燕艳,李 杰,杨章庚,王琼瑶,王卫国,谢其根.含奥沙利铂方案TACE治疗原发性肝癌的临床观察[J].临床肿瘤学杂志,2011,(05).
[5]QIAN J.The progress of clinical research on systemic chemotherapy for primary liver cancer[J].Medical Imformation,2008,21(5):758.
[6]彭小东,肖恭卫,元建华.低剂量持续静脉滴注吉西他滨一线治疗晚期肝细胞癌的临床研究[J].中国现代医学杂志,2007,21(8):946.
[7]Cohn AL,Myers JW,Mamus S,et al.A phase II study of pemetrexed in patients with advanced HepGGatocellular carcinoma[J].Invest New Drugs,2008,26(4):381.
[8]Ohtsubo K,Watanabe H,Tsuchiyama T,et al.Advanced HepGGatocellular carcinoma treated effectively with irinotecan via hepatic arterial infusion followed by proton beam therapy[J].J Infect Chemother,2009,15(5):316.
[9]Takahata T,Ookawa K,Suto K,et al.Chemosensitivity determinants of irinotecan hydrochloride inHepGGatocellular carcinoma cell lines[J].Basic Clin Pharmacol Toxicol,2008 Apr;102(4):399.
[10]Rathore R,Safran H,Soares G,et al.Phase I study of hepatic arterial infusion of oxaliplatin in advanced hepatocellular cancer:a brown university oncology group study[J].Am J Clin Oncol,2010,33(1):43.
