大鼠BMSCs的体外分离培养和鉴定
2011-08-20李树贵于海翔
李树贵,于海翔,杨 光*
(1.柳河县医院外四科,吉林柳河 135300;2.吉林大学中日联谊医院)
骨髓间充质干细胞(MSCs)是一种来源于骨髓的成体干细胞,具有自我更新和多向分化能力。它不仅能分化为中胚层的成骨细胞、软骨细胞和脂肪细胞等,近年的研究还发现可跨胚层分化为肝细胞[1]、神经细胞[2、3]、心肌细胞[4],因而引起了更广泛的关注,已成为组织工程、基因治疗和再生医学中的研究热点。在体外成功分离培养MSCs是研究其分化机制、基因调控、乃至实验应用的前提。我们采用贴壁法分离培养大鼠骨髓来源的间充质干细胞(BMSCs),观察其生物学特性和多向分化能力,并给予鉴定,为下一步实验应用提供依据。
1 材料和方法
1.1 实验动物和主要试剂
选取出生5-7天的清洁级Wistar大鼠(体重6.0-8.0 g),由吉林大学基础医学院动物实验中心提供。低糖DMEM培养基(GIBCO公司)、标准胎牛血清(GIBCO公司)、胰蛋白酶(Sigma公司)。
1.2 骨髓间充质干细胞的分离提取
将新生大鼠颈椎脱臼处死后,放入75%的乙醇内浸泡5 min。无菌条件下取出双侧股骨,去除附带组织,两端剪断暴露骨髓腔。以1 ml注射器吸取低糖DMEM细胞培养液反复冲洗,至骨质发白为止,将所收集的细胞悬液用200目滤网过滤,制备成单细胞悬液。细胞计数后以1.0×106/ml接种到含20%胎牛血清的低糖DMEM细胞培养液的培养瓶内。
1.3 骨髓间充质干细胞的传代培养和扩增
培养瓶置于37℃、5%CO2培养箱中静置培养。5天后首次半量换液,以后根据培养液颜色变化,每隔3-4天更换全部培养液1次。在贴壁细胞80%-90%融合后,吸尽培养液,以低糖DMEM培养液洗1遍后,加入适量0.25%胰蛋白酶,放入培养箱内消化30 s,倒置相差显微镜下观察细胞成片收缩,弃掉胰酶,加入胎牛血清终止消化,低糖DMEM培养液洗1遍,加入含20%胎牛血清的低糖DMEM培养液,弯头吸管轻轻吹打成单细胞悬液,以1∶2传代扩增培养。
1.4 流式细胞仪测定细胞周期
取生长良好的第3代细胞,细胞数至少1×106个,消化离心收集后,加入到70%冰乙醇中20 min,1,000 rpm离心5 min,弃上清,PBS重悬细胞,200目滤网过滤,PBS洗2遍,以0.3 ml细胞周期染色液重悬细胞,4℃放置30 min,上流式细胞仪检测。
1.5 成骨细胞诱导
第3代细胞传代时,在培养瓶中预先放置玻片,观察细胞70%-80%贴壁后,加入成骨诱导剂,各成分使用终浓度:地塞米松0.1 μ M、β-磷酸甘油钠10 mM、抗坏血酸磷酸盐50 uM。培养液为含10%胎牛血清的高糖D MEM细胞培养液,继续在培养箱内培养,相差显微镜定期观察,每3天半量换液,诱导2周,进行碱性磷酸酶(AKP)染色。
1.6 成脂肪细胞诱导
第3代细胞传代时,在培养瓶中预先放置玻片,观察细胞60%-70%贴壁后,更换成脂诱导培养基,为含20%马血清的低糖DMEM细胞培养液。相差显微镜定期观察,3天半量换液,共诱导2周,进行油红O染色。
2 结果
2.1 细胞形态学观察
相差显微镜下观察,刚接种时为悬浮于培养液中的大小不等圆形细胞,48 h后可见少数细胞贴壁,为成纤维细胞样细胞,以后贴壁细胞逐渐增多,约在9-12天80%-90%长满培养瓶底,融合成单层,此时传代,传代后的 BMSCs形态更加均一,排列更加有序,呈鱼群样、漩涡状或网状排列,3-4天左右即可长满培养瓶底。传至第6代,形态无明显变化,未出现衰老征象。
2.2 流式细胞仪测定细胞周期结果
通过流式细胞仪测定BMSCs细胞周期,发现平均11.41%的细胞处于S+G2+M期,88.59%处于G0/G1期(图1),提示BMSCs绝大多数处于静止期,而少数处于S+G2+M期,即增殖期。
2.3 向成骨细胞诱导结果
诱导培养后,细胞变为多角形、不规则形,胞浆中含有较多颗粒,部分细胞聚集成集落,碱性磷酸酶染色呈阳性(图2)。
2.4 向成脂肪细胞诱导结果
诱导培养3 d后,镜下可见小部分细胞内有少量细小脂滴,以后内含脂滴的细胞逐渐增多,并且脂滴增大,融合成团,细胞也由长梭形变为圆形、椭圆形。诱导2周时油红O染色,Giemsa复染,细胞内可见大小不等圆形脂滴空泡,部分被染成特异性橘红色(图3)。未经诱导的细胞胞浆中无脂滴,油红染色阴性。
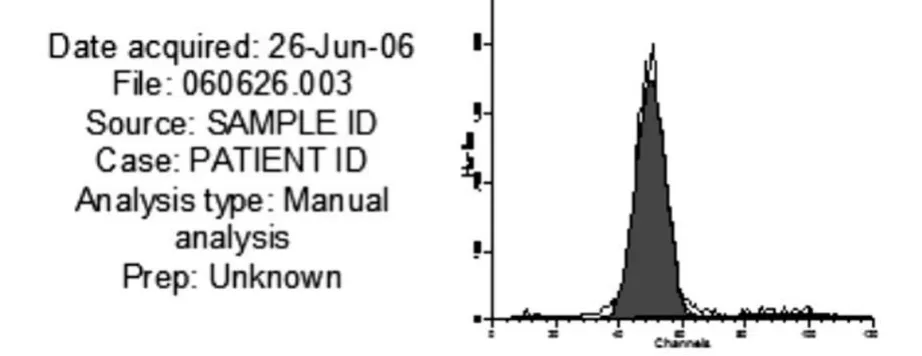
图1 第3代BMSCs培养3天

图2 BMSCs成骨诱导碱性磷酸酶染色(×200)胞浆中可见黑色颗粒沉着,呈阳性反应。
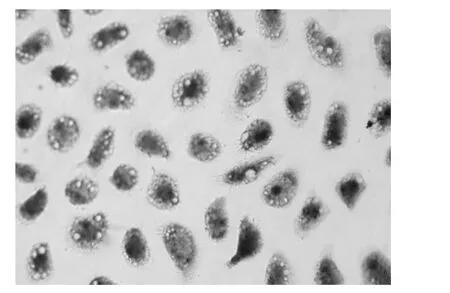
图3 BMSCs成脂诱导油红O染色、Gimesa复染(×400)胞浆内可见脂肪空泡,被油红染成橘红色。
3 讨论
人们已经从骨、脂肪、脐血等多种组织中成功分离培养出间充质干细胞[5-8],但目前从骨髓中分离培养仍为获取间充质干细胞的主要方法。由于间充质干细胞在骨髓中含量极少,贴壁生长干细胞仅占人骨髓中有核细胞的0.001%[5],故需特定的分离培养方法。1976年由Friedenstein等[8]首先利用贴壁法从小鼠的骨髓中分离得到间充质干细胞,他将全部骨髓细胞置于塑料培养皿中,根据干细胞在特定培养基中贴壁生长的特性,通过换液去除不贴壁的其它杂质细胞后,获得呈梭形的贴壁干细胞。之后人们采用密度梯度离心法和贴壁法相结合,即根据骨髓中细胞成分密度的不同,先离心分离单个核细胞后再接种,之后通过贴壁法进一步纯化。另外还有免疫磁珠法和流式细胞仪筛选法[9,10],但成本较高、技术难度大,加之骨髓间充质干细胞尚未发现其特有的表面标志,故应用较少,目前常用方法仍为贴壁法和密度梯度离心法。
虽然密度梯度离心法可在原代获得较纯化的细胞,但BMSCs的分离密度尚未明确,且离心后仍需用贴壁法进一步纯化,操作步骤复杂,离心过程中不可避免的造成细胞损失,故其优势并不明显。本实验采用贴壁法分离培养大鼠BMSCs,利用干细胞贴壁生长的特性,换液去除悬浮的血细胞,并随着细胞传代,去除其它可贴壁的杂质细胞,经过传代后细胞形态趋向一致,为成纤维细胞样,从而获得纯化的细胞,具有操作简便,费用低廉,成功率高的优点。有研究表明细胞经扩增1、2代后纯度可达 95%和98%[5]。在先前的预实验,小鼠BMSCs分离培养的过程中[11],我们发现随着取材鼠龄增大,细胞活性和增殖能力下降,故本实验选择出生1周内的新生大鼠取材,所获得细胞活性好,增殖能力强。传至第6代,细胞形态无明显变化,未出现衰老征象,适于进一步实验应用。
在使用的血清浓度问题上,国内外不同的实验室所用并不一致,报道多在5%-20%之间[12-14]。虽然也有人对比过不同浓度血清对所培养BMSCs的影响,但因实验条件和所使用的血清来源不同,得出的结论也并不一致[15-17],故尚无统一标准。本实验使用浓度20%的国产胎牛血清,细胞生长良好,并未过早出现生长停滞和分化的现象。对于细胞接种密度,如果密度过小,会造成细胞生长缓慢,甚至死亡;而密度过大,细胞间产生接触抑制,也将致使生长缓慢,同时由于细胞代谢旺盛,导致换液频繁,加大了工作量,增加了污染机率。经过摸索,我们认为原代接种时细胞密度4.0×105/cm2左右比较适合。
在相差显微镜下观察,刚接种时为大小不等的多种细胞悬浮在培养液中,BMSCs逐渐贴壁生长,并拉长为成纤维细胞样,经换液和传代去除杂质细胞后,所获细胞形态均一,排列有序,培养3~4天即可传代扩增,表现了较强的增殖能力。
本实验通过流式细胞仪检测了第3代BMSCs的细胞周期,发现绝大部分细胞处于静止期G1/G0期,少部分处于S+G2+M期,这和大多数文献报道的相一致[18],说明绝大部分细胞处于静止态,但保留自我更新和增殖能力,少部分处于功能态,符合干细胞的生长特性。具有多向分化能力是干细胞的另一主要特性,本实验对所培养的BMSCs进行成骨和成脂肪诱导分化,鉴定结果显示实现了向成骨和脂肪细胞分化。而未经诱导的细胞碱性磷酸酶染色为阴性,排除了所获细胞为成骨细胞或成纤维细胞。
BMSCs的表面抗原表型并不是单一的,而是兼有间充质细胞、上皮细胞和肌肉细胞的特点,可表达细胞粘附分子、生长因子、细胞因子、细胞外基质成分等多种抗原。目前尚未发现可作为BMSCs标志物的特异性抗原[19,20],故无法直接鉴定得到的BMSCs。一般的鉴定方法都是通过培养传代后,对所培养的细胞根据干细胞的生物学特性逆推,从而得知是否是BMSCs。本实验所培养的细胞由骨髓取材,在特定的培养基中呈成纤维细胞样贴壁生长,形态结构具有幼稚细胞的特征,并可分化为成骨和脂肪两种不同的终末细胞,故可认为是骨髓来源的间充质干细胞。
综上所述,我们在体外成功的分离培养和扩增了大鼠骨髓来源的间充质干细胞,熟悉了其一般生物学特性,并通过检测其多向分化能力给予鉴定,为下一步实验应用奠定了基础。
[1]Lange C,Bruns H,Kluth D,et al.Hepato-cytic differentiation of mesenchymal stem cells in coc-ultures with fetal liver cells[J].World J Gastroenterol,2006,12(15):2394.
[2]Woodbury D,Schwarz EJ,Prockop DJ,et al.Adult rat and human bone marrow stromal cells differentiate into neurons[J].J Neurosci Res,2000,61(4):364.
[3]Krampera M,Marconi S,Pasini A,et al.Induction of neural-like differentiation in human mesenchymal stem cells derived from bone marrow,fat,spleen and thymus[J].Bone,2007,40(2):382.
[4]Xu W,Zhang X,Qian H,et al.Mesenchymal stem cells from adult human bone marrow differentiate into a cardiomyocyte phenotype in vitro[J].Exp Biol Med,2004,229(7):623.
[5]Pittenger MF,Mackay AM,Beck SC,et al.Multilineage potential of adult
human mesenchymal stem cells[J].Science,1999,284(5411):143.[6]Kern S,Eichler H,Stoeve J,et al.Comparative analysis of mesenchymal stem cells from bone marrow,umbilical cord blood,or adipose tissue[J].Stem Cells,2006,24(5):1294.
[7]Campagnoli C,Roboerts AG,Kumar S,et al.Multilineage potent-ial of adult human mesenchymal stem cells[J].Science,1999,248:143.
[8]Friedenstein AJ,Gorskaja JF,Kulagina NN.Fibroblast precursors in normal and irradiated mouse hematopoietic organs.Exp Hematol,1976,4(5):267.
[9]JE Dennis,JP Carbillet,AI Caplan,et al.The STRO-1+marrow cell population is multipotential[J].Cells Tissues Organs,170(2002):73.
[10]Tondreau T,Lagneaux L,Dejeneffe M,Isolation of BM mesenchymal stem cells by plastic adhesionornegative selection:phenotype,proliferation kinetics and differentiation potential[J].Cytotherapy,2004,6(4):372.
[11]杨 光,范东艳,陈 强,等.贴壁法培养不同龄小鼠骨髓间充质干细胞的生物学特点[J].中国实验诊断学,2007,11(1):13.
[12]Guillermo Mu,oz-Elías,Dale Woodbury,Ira B Black.Marrow Stromal Cells,Mitosis,and Neuronal Differentiation:Stem Cell and Precursor Functions[J].Stem Cells,2003,21:43.
[13]Richard Tulia,Suraj Tulia,Sumon Nandia,et al.Characterization of Multipotential Mesenchymal Progenitor Cells Derived from Human[J].Trabecular Bone Stem Cells,2003,21:681.
[14]Tremain N,Korkko J,Ibberson D,et al.MicroSAGE analysis of 2353 expressed genes in a single cell-derived colony of undifferentiated human mesenchymal stem cells reveals mRNAs of multiple cell lineages[J].Stem Cells,2001,19(5):408.
[15]Meuleman N,Tondreau T,Delforge A,et al.Humanmarrow mesenchymal stem cell culture:serum-free medium allows better expansion than classical alpha-MEM medium[J].Eur J Haematol,2006,76(4):309.
[16]滕晓华,徐如祥,邹雨汐,等.不同浓度血清对大鼠骨髓基质细胞生长的影响[J].中国病理生理杂志,2005,07:1452.
[17]韦育林,李楚强,伍 卫,等.大鼠骨髓间充质干细胞生长特性和表面标志与培养基中胎牛血清浓度的关系[J].中国临床康复,2006,1:28.
[18]Conget PA,Minguell JJ.Phenotypical and functional properties of human bone marrow mesenchymal progenitor cells.J Cell Physiol,1999,181:67.[19]Minguell,Alejandro Erices,Paulette Conget.Mesenchymal Stem Cells[J].Experimental Biology andMedicine,2001,226:507.
[20]Bianco P,Riminucci M,Gronthos S,et al.Bone marrow stromal stem cells:nature,biology,and potential applications[J].Stem Cells,2001,19(3):180.
