同型半胱氨酸对人血管平滑肌细胞凋亡及凋亡相关蛋白表达的影响
2011-08-20王红月窦海川崔明姬
邢 跃,王红月,窦海川,崔明姬*
(1.吉林大学中日联谊医院神经内二科,吉林长春 130033;2.吉林大学第一医院肾内科,吉林 长春 130021)
高同型半胱氨酸血症是动脉粥样硬化(AS)性血管疾病形成的独立危险因素,但其机制至今不完全清楚。起初,人们大都致力研究于同型半胱氨酸(Hcy)对内皮细胞的毒性作用,发现Hcy可损害内皮细胞,影响其舒张功能,近年来,研究发现一定剂量的Hcy能诱导血管平滑肌细胞(VSMC)的增殖,而VSMC的异常增殖是AS性血管性疾病发生过程中重要的病理现象[1]。然而,VSMC的增殖又并存着VSMC凋亡,VSMC增殖与凋亡是维持血管壁细胞相对稳定的一对基本因素,其调节失控是AS的主要原因之一。本研究观察Hcy对体外培养的人VSMC凋亡和凋亡相关蛋白Bcl-2、Bax及Caspase-3表达的影响,进一步探讨Hcy导致AS的机制。
1 材料与方法
1.1 主要试剂与仪器
DMEM、胎牛血清、新生牛血清(Gibco公司提供)、胰蛋白酶、转铁蛋白(Sigma公司)、医用胰岛素、EDTA、青霉素 、链霉素、D-Hank′s 液、PBS 液、DBA液,兔抗人α-actin抗体(武汉博士德公司提供)、同型半胱氨酸(Sigma公司提供)、PI/Annexin V凋亡检测试剂盒(Sigma公司提供)、RNA提取试剂TR IZOL(Invitrogen)、dNTP、Taq酶(美国Promega公司提供),PCR试剂盒(美国Promega公司提供),引物赛百盛公司合成。全封闭PCR紫外透射仪(上海精科实业有限公司)紫外与可见光分光分析仪(HITACHI u-2000型,日本)FACS Calibur型流式细胞仪(美国BD公司)。
1.2 人VSMC的体外培养、鉴定及实验分组
取无菌新鲜脐带,采用贴块法培养人VSMC,细胞鉴定用第5代细胞,倒置显微镜下观察细胞形态,行α-actin免疫组化检测。取5-10代细胞用于实验。
将人VSMC细胞分别置于Hcy终浓度为0 μ mol/L 、150 μ mol/L、250 μ mol/L 、550 μ mol/L、1 000 μ mol/L,1 550 μ mol/L,即 6个浓度组 ,每个浓度组设6个培养孔,培养24 h,同时设阴性对照组(磷酸盐缓冲液组)和阳性对照组(脂多糖组)。还有Hcy终浓度为1 000 μ mol/L的培养液中分别孵育0 h、6 h、12 h、24 h、48 h,即5个时间组,每个时间组设6个培养孔。
1.3 VSMC细胞凋亡的检测
凋亡检测采用Annexin V-FITC/PI标记试剂盒检测和流式细胞术(flowcytometry,FCM)分析。结果判断:凋亡及死亡的细胞均表现膜磷脂酰丝氨酸(Phosphatidylserine,PS)外翻以致Annexin V染色阳性,而活细胞Annexin V染色阴性,但细胞凋亡早期仍保持细胞膜的完整性,因此,同活细胞一样,PI不能透过细胞膜而表现为PI染色阴性,而死亡细胞则为PI染色阳性。即左下象限PI-Annexin V-为活细胞,右下象限PI-/Ann-exin V+为凋亡细胞,右上象限PI+/Annexin V+为死亡细胞,左上象限PI+Annexin V-为机械损伤的细胞。
1.4 RT-PCR法检测 Bcl-2、Bax及 Caspase-3mRNA的表达
用TR IZOL总RNA抽提试剂盒抽提各组细胞的总RNA各5 μ g,按 RT-PCR试剂盒说明书逆转录合成cDNA,取产物2 μ l进行PCR扩增。Bcl-2的引物 :正义链 :5′-CGA CGA CTT CTC CCG CCG CTA CCG C-3′,反义链 :5′-CCG CAT GCT GGG GCC GTA CAT TTC C-3′,扩增产物为318 bp;Bax的引物:正义链:5′-TCC ACC AAG AAG CTG AGC GAG-3′,反义链:5′-GTC CAG GCC CAT GAT GGT TCT-3′,扩增产物为257bp;Caspase-3 的引物:正义链 :5′-TGG AAT GTC ATC TCG CTCTG-3′,反义链 :5′-GTC CCA CTG TCT GTC TCAAT-3′,扩增产物为 357 bp;β-actin 引物:正义链:5′-GTG GGG CGC CCC AGC ACC A-3′,反义链:5′-CTC CTT AAT GTC ACG CAC GAT TC-3′,扩增产物为548 bp。反应后取终产物5 μ l在1.0%的琼脂糖凝胶中电泳分析,至外线照像,用图像分析系统测出目的基因及β-actin的积分吸光度(A)值,计算目的基因与β-actin扩增条带吸光度(A)比值作为目的基因mRNA的表达强度。每组检测6次。
1.5 统计学处理
2 结果
2.1 不同浓度Hcy对人VSMC凋亡的影响
人VSMC在6个不同浓度Hcy的培养液中孵育24h后,细胞凋亡率分别为(2.98±0.23)%、(3.11±0.89)%、(8.45±2.41)%(P均 <0.05 vs 0、150μ mol/L)、(14.37±4.71)%(P均 <0.05 vs 0、150 μ mol/L 、250 μ mol/L)、(15.75 ±4.56)%、(P均 <0.05 vs 0 、150 μ mol/L 、250 μ mol/L)、(13.56 ±3.02)%(P均 <0.05 vs 0 、150 μ mol/L、250 μ mol/L),VSMC 的凋亡率随着Hcy浓度的增加明显升高,至1 000 μ mol/L达到峰值,而后降低,表明在1 000 μ mol/L浓度范围内,Hcy呈剂量依赖性诱导人VSMC细胞凋亡。
2.2 同一浓度不同时间Hcy对人VSMC凋亡的影响
在浓度为1 000 μ mol/L Hcy的培养液中孵育0 h 、6 h、12 h、24 h、48 h 后的细胞凋亡率分别为(2.53±0.47)%、(2.67±1.25)%、(7.68±3.04)%(P均<0.05vs 0 h、6 h)、(14.37±4.71)%(P均<0.05 vs 0 h 、6 h、12 h)、(13.76±4.34)%(P均<0.05 vs 0 h、6 h、12 h),6 h细胞凋亡无显升高,但随后细胞凋亡率逐渐升高,至24 h达到峰值,而后降低,表明在作用早期,Hcy无明显的诱导VSMC凋亡作用,但在24 h内Hcy呈时间依赖性诱导人VSMC细胞凋亡。
2.3 Hcy对人VSMC Bcl-2、Bax及Caspase-3mRNA表达的影响
VSMC在6个不同浓度Hcy的培养液中孵育24 h后 Bax mRNA的表达量除了Hcy 150 μ mol/L组与对照组比较差异无统计学意义外,余四组与对照组比较差异均有统计学意义(P<0.05),在Hcy 1 000 μ mol/L组时达到峰值,而后降低;Bcl-2 mRNA表达量在1 000 μ mol/L浓度范围内,随着Hcy浓度的增加Bcl-2 mRNA表达量有下降趋势,但各组与对照组比较差异无统计学意义(P>0.05);Caspase-3 mRNA表达量除了Hcy 150 μ mol/L组与对照组比较差异无统计学意义外,余四组与对照组比较差异均有统计学意义(P<0.05),在1 000 μ mol/L浓度范围内,随着Hcy浓度的增加Caspase-3mRNA的表达量逐渐上升,表达在 1 000 μ mol/L Hcy达到峰值,而后降低。(见图 1、2、3 和表 1)。
图1 人VSMC Bax mRNA RT-PCR电泳图
图2 人VSMC Bcl-2 mRNA RT-PCR电泳图
图3 人VSMC Caspase-3 mRNA RT-PCR电泳图
3 讨论
AS是危害人类健康的最重要的心血管疾病。AS是指发生在大型或中型弹性动脉、肌型动脉壁内膜及内膜下,以脂质沉着,并伴有中层VSMC向内膜移行、增殖为特征,内膜增厚发展而形成的粥样病灶或纤维脂质斑块。细胞凋亡是受基因调控的一种生理性死亡模式,通过这一模式机体控制组织中细胞数目,清除无用的、有害的及异常的细胞,从而维持机体自身稳定。最近的许多研究已经证实细胞凋亡是AS病变的独立危险因素[2]。VSMC是AS斑块主要的细胞成分,VSMC的过度增殖与过度凋亡构成了AS斑块形成的主要病理基础。chen等[3]研究证实晚期粥样斑块内VSMC较正常血管壁的VSMC增殖减少且更易凋亡。
表1 不同浓度组 VSMC Bax、Bcl-2mRNA和Caspase-3mRNA表达量(±s)
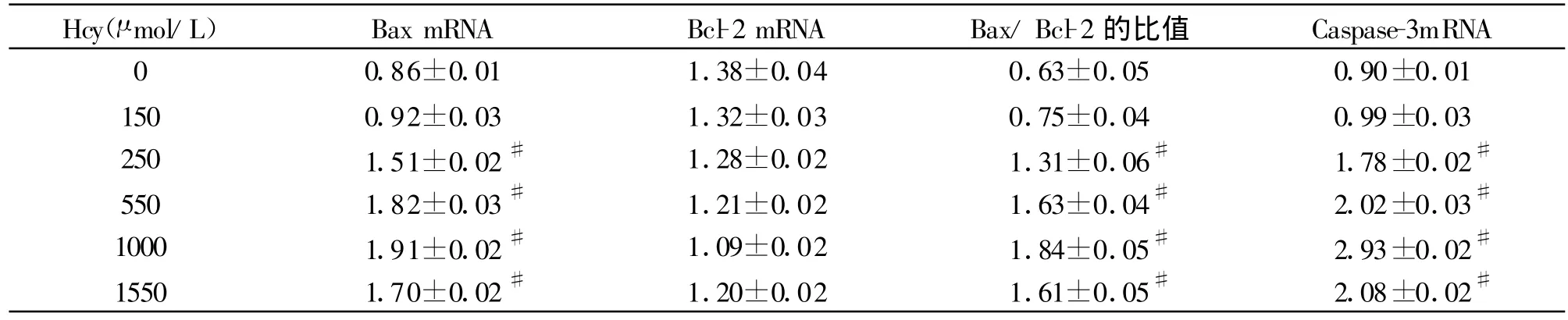
表1 不同浓度组 VSMC Bax、Bcl-2mRNA和Caspase-3mRNA表达量(±s)
与对照组比较:#P<0.05
Hcy(μ mol/L) Bax mRNA Bcl-2 mRNA Bax/Bcl-2 的比值 Caspase-3mRNA 0.86±0.01 1.38±0.04 0.63±0.05 0.90±0.01 150 0.92±0.03 1.32±0.03 0.75±0.04 0.99±0.03 250 1.51±0.02# 1.28±0.02 1.31±0.06# 1.78±0.02#550 1.82±0.03# 1.21±0.02 1.63±0.04# 2.02±0.03#1000 1.91±0.02# 1.09±0.02 1.84±0.05# 2.93±0.02#1550 1.70±0.02# 1.20±0.02 1.61±0.05# 2.08±0.02#0
Hcy是一种含硫氨基酸,体内蛋氨酸分解过程中产生的一个重要中间产物。高Hcy血症是AS和血栓形成等心脑血管疾病发病的独立危险因子,但其机制尚未完全阐明。Buemi等[4]的研究表明,人股动脉VSMC与10-20mmol/L Hcy孵育24 h后,细胞凋亡数目呈浓度依赖性增加。本研究的结果显示,人脐动脉VSMC 在150 μ mol/L Hcy孵育24 h后,细胞凋亡无明显升高,但是随着浓度的增加,细胞凋亡明显升高,至1 000 μ mol/L达到峰值,而后降低,表明在1 000 μ mol/L浓度范围内,Hcy呈剂量依赖性诱导人VSMC细胞凋亡;550 μ mol/L Hcy在作用早期6h对人脐动脉VSMC凋亡无明显升高,但随后细胞凋亡率逐渐升高,至24 h达到峰值,表明在24 h内Hcy呈时间依赖性诱导人VSMC细胞凋亡,提示高Hcy血症导致AS作用可能与其诱导VSMC调亡有关。
Hcy诱导VSMC调亡的机制目前尚不清楚。细胞凋亡有多条死亡信号通路介导,其中Bcl-2家族和Caspase家族目前被认为是在凋亡的信号传递和调节方面具有关键性的作用。Bcl-2家族蛋白又分为两类,即凋亡抑制蛋白(包括 Bcl-2、Bcl-xl、bag、Bcl-w等)和凋亡诱导蛋白(Bax、Bcl-xs、Bak 、Bad、Bid 等),这两类蛋白的比例决定了细胞在收到信号时是否发生凋亡。Caspase是一组天门冬氨基酸特异性的半胱氨酸蛋白酶,Caspase在凋亡信号作用下发生逐级水解活化,最后裂解细胞的结构蛋白和功能蛋白,使细胞分解引起凋亡,故Caspase的活化是导致凋亡的中心环节。Caspase家族有多个成员,已有14种Caspase被克隆,其中Caspase-2、8、9可介导相应凋亡信号,启动的细胞凋亡,称为启动性Caspase;Caspase-3、6、7通过裂解细胞的结构蛋白和功能蛋白,使细胞解体,称为效应性Caspase。尽管在不同细胞或同一细胞受不同刺激诱发凋亡过程中激活的Caspase不尽相同。Caspase-3是直接诱导细胞凋亡最重要的蛋白酶之一[5],Kim等[6]等研究证实了小鼠VSMC的凋亡是由Caspase-3介导的一系列蛋白酶激活而造成的。本研究的结果显示,体外培养的人脐动脉VSMC在不同浓度Hcy的培养液中孵育24h后的Bax mRNA表达量在一定浓度范围内,随浓度增加逐渐升高,而Bcl-2 mRNA的表达与浓度无关;同时还发现Hcy在一定浓度范围内,可上调Bax/Bcl-2的比值,并呈浓度依赖性。Caspase-3mRNA的表达在Hcy浓度1000μ mol/L时达峰值,在此浓度范围内Caspase-3mRNA的表达呈剂量依赖性上升。本研究结果,可推测,VSMC在Hcy浓度1 000 μ mol/L范围内的作用下,Bax水平升高,而Bcl-2水平下降,导致Bax与Bcl-2比例失调,Bax形成同源二聚体,进而线粒体通透性增加,跨膜电位下降,线粒体内细胞色素C释放,使Caspase-9激活,并进一步激活Caspase-3,导致细胞凋亡。
就高Hcy血症而言,虽然研究表明其可能通过诱导VSMC的凋亡而致AS,但是目前其机制尚不清楚,对于凋亡发生、调节机制的进一步理解,将推动高Hcy血症与AS性血管疾病关系等方面的研究,如何调控高Hcy血症对VSMC凋亡尚有待于进一步研究。
[1]Lee hY,Chae IH,Kim HS.Differential effects of homocysteine on porcine endothelial and vascular smooth muscle cells[J].J Cardiovasc Pharmacol,2002,39:643.
[2]方丽娟,刘乃丰.细胞凋亡与动脉粥样硬化关系的研究进展[J].东南大学学报(医学版),2010,29(1):107.
[3]Chen F,Eriksson P,Kimura T,et al.Apoptosis and angiogenesis are induced in the unstable coronary atherosclerotic plaque[J].Coron Artery Dis,2005,16:191.
[4]Buemi M,Marino D,Di Pasquale G,et al.Effects of homocysteine on proliferation,necrosis,and apoptosis of vascular smooth muscle cells in culture and influence of folic acid[J].Thromb Res.2001;104:207.
[5]Matsuhiko H,Takashi A.Caspase in renal development[J].Nephrol Dial Transplant,2002,17(Sup9):8.
[6]Kim SC,Rho MC,Lee HS,et al.Caspase-3-dependent apoptosis in vascular smooth muscle cell by proteasome inhibition[J].J Cardiovasc Pharmacol,2003,42(4):554.
